- 2021-08-23 发布 |
- 37.5 KB |
- 10页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2017-2018学年山西省怀仁县第一中学、应县第一中学校高二下学期期末考试化学试题(Word版)
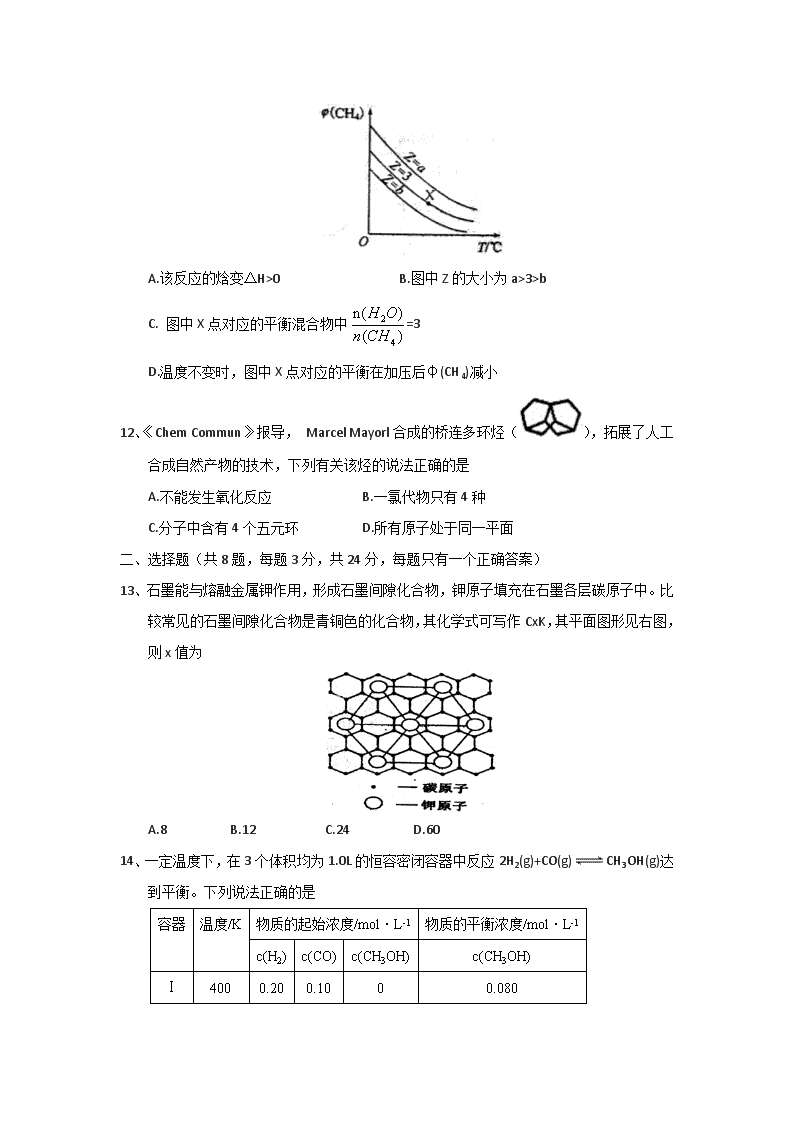
山西省怀仁县第一中学、应县第一中学校2017-2018学年高二 下学期期末考试化学试题 一、选择题:(本题共12小题,每题2分,共24分,每题只有一个正确答案) 1、下列各组物质的熔点均与所含化学键的键能有关的是 A.CaO与CO2 B.NaCl与HCl C.SiC与SiO2 D.Cl2与I2 2、工业上可由乙苯生产苯乙烯:,下列说法正确的是 A.该反应的类型为消去反应 B.乙苯的同分异构体共有三种 C.用Br2/CCl4鉴别不出乙苯和苯乙烯 D.乙苯和苯乙烯分子内共平面的碳原子数均为7 3、下列叙述正确的是 A.使用催化剂能够降低化学反应的反应热(△H) B.金属发生吸氧腐蚀时,被腐蚀的速率与氧气浓度无关 C.原电池中发生的反应达平衡时,该电池仍有电流产生 D.在同浓度的盐酸中,ZnS可溶而CuS不溶,说明CuS的溶解度比ZnS的小 4、关于晶体的下列说法正确的是 A.只要含有金属阳离子的晶体就一定是离子晶体 B.离子晶体中一定含金属阳离子 C.在共价化合物分子中各原子都形成8电子结构 D.分子晶体的熔点不一定比金属晶体熔点低 5、由反应物X转化为Y和Z的能量变化如图所示。下列说法正确的是 A.由X→Y反应的△H=E5-E2 B.升高温度有利于提高Z的产率 C.降低压强不利于提高Y的产率 D.由X→Z反应的△H<0 6、下列关于牛油的叙述中不正确的是 A.牛油属于酯类 B.牛油没有固定的熔点和沸点,也不溶于水 C.可用食用碱的热溶液洗涤餐具上粘附的牛油 D.工业上将牛油加氢可制得硬化油 7、下列说法中,正确的是 A.冰融化时,分子中H—O键发生断裂 B.原子晶体中,共价键的键长越短,通常熔点就越高 C.分子晶体中,共价键键能越大,该分子的熔沸点就越高 D.分子晶体中,分子间作用力越大,则分子越稳定 8.下列图示与对应的叙述不相符合的是 A.图甲表示燃料燃烧反应的能量变化 B.图乙表示酶催化反应的反应速率随反应温度的变化 C.图丙表示弱电解质在水中建立电离平衡的过程 D.图丁表示强碱滴定强酸的滴定曲线 9、下列的晶体中,化学键种类相同,晶体类型也相同的是 A.SO2与SiO2 B.CO2与H2O C.NaC1与HC1 D.CC14与KC1 10、下列各项所述的数字不是6的是 A.在NaC1晶体中,与一个Na+最近的且距离相等的Cl-的个数 B.在金刚石晶体中,最小的环上的碳原子个数 C.在二氧化硅晶体中,最小的环上的原子个数 D.在石墨晶体的片层结构中,最小的环上的碳原子个数 11、一定条件下,CH4与H2O(g)发生反应:CH4(g)+H2O(g)CO(g)+3H2(g)。设起始=Z,在恒压下,平衡时CH4的体积分数φ(CH4)与Z和T(温度)的关系如图所示。下列说法正确的是 A.该反应的焓变△H>0 B.图中Z的大小为a>3>b C. 图中X点对应的平衡混合物中=3 D.温度不变时,图中X点对应的平衡在加压后φ(CH4)减小 12、《Chem Commun》报导, Marcel Mayorl合成的桥连多环烃(),拓展了人工合成自然产物的技术,下列有关该烃的说法正确的是 A.不能发生氧化反应 B.一氯代物只有4种 C.分子中含有4个五元环 D.所有原子处于同一平面 二、选择题(共8题,每题3分,共24分,每题只有一个正确答案) 13、石墨能与熔融金属钾作用,形成石墨间隙化合物,钾原子填充在石墨各层碳原子中。比较常见的石墨间隙化合物是青铜色的化合物,其化学式可写作CxK,其平面图形见右图,则x值为 A.8 B.12 C.24 D.60 14、一定温度下,在3个体积均为1.0L的恒容密闭容器中反应2H2(g)+CO(g)CH3OH(g)达到平衡。下列说法正确的是 容器 温度/K 物质的起始浓度/mol·L-1 物质的平衡浓度/mol·L-1 c(H2) c(CO) c(CH3OH) c(CH3OH) Ⅰ 400 0.20 0.10 0 0.080 Ⅱ 400 0.40 0.20 0 Ⅲ 500 0 0 0.10 0.025 A.达到平衡时,容器Ⅲ中的正反应速率比容器I中的小 B.达到平衡时,容器I中反应物转化率比容器Ⅱ中的大 C.达到平衡时,容器Ⅱ中c(H2)大于容器Ⅲ中c(H2)的两倍 D.该反应的正反应放热 15、合成导电高分子化合物PPV的反应为 下列说法正确的是 A.PPV是聚苯乙炔 B.该反应为缩聚反应 C.PPV与聚苯乙烯的最小结构单元组成相同 D.1 mol 最多可与2molH2发生反应 16、工业上电解NO制备NH4NO3,其工作原理如右图所示(图中电极均为石墨电极)下列说法错误的是 A.a极连接电源的负极 B.阳极反应为NO+5e-+6H+=NH4++H2O C.总反应方程式为8NO+7H2O3NH4NO3+2HNO3 D.为使电解产物全部转化为NH4NO3,需补充物质A,A是NH3 17、组成晶体的质点(分子、原子、离子)以确定的位置在空间作有规则排列,具有一定几何形状的空间格子,称为晶格,晶格中能代表晶体结构特征的最小重复单位称为晶胞。在冰晶石(Na3AlF6)晶胞中,AlF63-占据的位置相当于NaC1晶胞中Cl- 占据的位置,则冰晶石晶胞中含有的原子数与食盐晶胞中含有的原子数之比为 A.2∶1 B. 3∶2 C. 5∶2 D.5∶1 18、已知:磷酸分子中的三个氢原子都可以跟重水分子(D2O)中的D原子发生氢交换,又知次磷酸(H3PO2)也可跟D2O进行氢交换,但次磷酸钠( NaH2PO2)却不再能跟D2O发生氢交换,由此可推断出H3PO2的分子结构是 A. B. C. D. 19、化合物W、X、Y、Z的分子式均为C7H8,Z的空间结构类似于篮子。下列说法正确的是 A.化合物W的同分异构体只有X、Y、Z B.X、Y、Z均可与酸性KMnO4溶液反应 C.1mo1X、1molY与足量Br2/CCl4溶液反应最多消耗Br2均为2mol D.Z的一氯代物只有3种 20、化合物X是一种医药中间体,其结构简式如图所示。下列有关化合物X的说法正确的是 A分子中两个苯环一定处于同一平面 B.不能与饱和Na2CO3溶液反应 C.在酸性条件下水解,水解产物只有一种 D.1mol化合物X最多能与2 mol NaOH反应 三、填空题(共52分) 21、(共16分,每空2分)正丁醛是一种化工原料。某实验小组利用如下装置合成正丁醛。 发生的反应如下: CH3CH2CH2CH2OHCH3CH2CH2CHO 反应物和产物的相关数据列表如下: 沸点/℃ 密度/(g·cm-3) 水中溶解性 正丁醇 117.2 0.8109 微溶 正丁醛 75.7 0.8017 微溶 实验步骤如下: 将6.0gNa2Cr2O7放入100mL烧杯中,加30mL水溶解,再缓慢加入5mL浓硫酸,将所得溶液小心转移至B中。在A中加入4.0g正丁醇和几粒沸石,加热。当有蒸汽出现时,开始滴加B中溶液。滴加过程中保持反应温度为90~95℃,在E中收集90℃以下的馏分。将馏出物倒入分液漏斗中,分去水层,有机层干燥后蒸馏,收集75~77℃馏分,产量2.0g。 回答下列问题: (1)实验中,能否将Na2Cr2O7溶液加到浓硫酸中,说明理由 ________________ 。 (2)加入沸石的作用是 _____________ 。若加热后发现未加沸石,应采取的正确方法是 ____________________。 (3)上述装置图中,B仪器的名称是 ___________________ 。 (4)分液漏斗使用前必须进行的操作是 _________ (填正确答案标号)。 a.润湿 b.干燥 c.检漏 d.标定 (5)将正丁醛粗产品置于分液漏斗中分水时,水在 ______ 层(填“上”或“下”) (6)反应温度应保持在90~95℃,其原因是 _______________________________ 。 (7)本实验中正丁醛的产率为 __________ %。 22、(10分,每空2分)某研究小组以甲苯为主要原料按下列路线合成D和E。 已知:,请回答: (1)反应I的试剂和条件是__________________________________。 (2)反应Ⅱ的化学方程式是__________________________________。 ()化合物C中官能团的名称是_____________________。 (4)化合物D的结构简式是_____________________。 (5)C→E的化学方程式是__________________________________。 23、(12分,每空2分)顺-1,2-二甲基环丙烷和反-1,2-二甲基环丙烷可发生如下转化: 该反应的速率方程可表示为:v(正)=k(正)c(顺)和v(逆)=k(逆)c(反),k(正)和k(逆)在一定温度时为常数,分别称作正,逆反应速率常数。回答下列问题: (1)已知:t1温度下,k(正)=0.006s-1,k(逆)=0.002s-1,该温度下反应的平衡常数值K1=___________;该反应的活化能Ea(正)小于Ea(逆),则ΔH________0(填“小于”“等于”或“大于”)。 (2)t2温度下,图中能表示顺式异构体的质量分数随时间变化的曲线是_______(填曲线编号),平衡常数值K2=_____;温度t2___t1(填“小于”“等于”或“大于”),判断理由是____________________。 24、(14分,每空2分)科学家正在研究温室气体CH4和CO2的转化和利用。 (1)CH4和CO2所含的三种元素电负性从小到大的顺序为_____________________。 (2)下列关于CH4和CO2的说法正确的是_______________(填序号)。 a.固态CO2属于分子晶体 b.CH4分子中含有极性共价键,是极性分子 c.因为碳氢键键能小于碳氧键,所以CH4熔点低于CO2 d. CH4和CO2分子中碳原子的杂化类型分别是sp3和sp (3)在Ni基催化剂作用下,CH4和CO2反应可获得化工原料CO和H2。 ①基态Ni原子的电子排布式为____________________,该元素位于元素周期表的第______族。 ②Ni能与CO形成正四面体形的配合物Ni(CO)4,1mol Ni(CO)4中含有σ键的数目为_________。 mol。 (4)一定条件下,CH4和CO2都能与H2O形成笼状结构(如下图所示)的水合物晶体,其相关参数见下表。CH4与H2O形成的水合物俗称“可燃冰”。 参数 分子 分子直径/mm 分子与H2O的结合能(E/kJ·mol-1) CH4 0.436 16.40 CO2 0.512 29.91 ①“可燃冰”中分子间存在的2种作用力是___________________。 ②为开采深海海底的“可燃冰”,有科学家提出用CO2置换CH4的设想。已知上图中笼状结构的空腔直径为0.586m,根据上述图表,从物质结构及性质的角度分析,该设想的依据是________________。 一、选择题:(本题共12小题,每题2分,共24分,每题只有一个正确答案) 1-5CADDD 6-10 DBABC 11-12 AC 二、选择题(共8题,每题3分,共24分,每题只有一个正确答案) 13-20 ADBBDBDC 21、(16分,每空2分) (1)不能 易迸溅。 (2)防止暴沸 冷却后补加 (3)分液漏斗 (4)c (5)下 (6)既可保证正丁醛及时蒸出,又可尽量避免其被进一步氧化(7)51 22、(10分,每空2分)(1)C12/光照 (2) (3)羟基 羧基 (4) (5) 23、(12分,每空2分) (1)3 小于 (2)B 大于 放热反应升高温度时平衡向逆反应方向移动 24、(14分,每空2分)(1)H、C、O (2)a、d (3)①1s22s22p63s23p63d84s2或[Ar]3d84s2 Ⅷ ②8NA (4)①氢键、范德华力 ②CO2的分子直径小于笼状空腔直径,且与H2O的结合能大于CH4查看更多