- 2021-08-23 发布 |
- 37.5 KB |
- 10页
申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2018-2019学年河南省顶级名校高二下期期末模拟试题——化学(Word版)
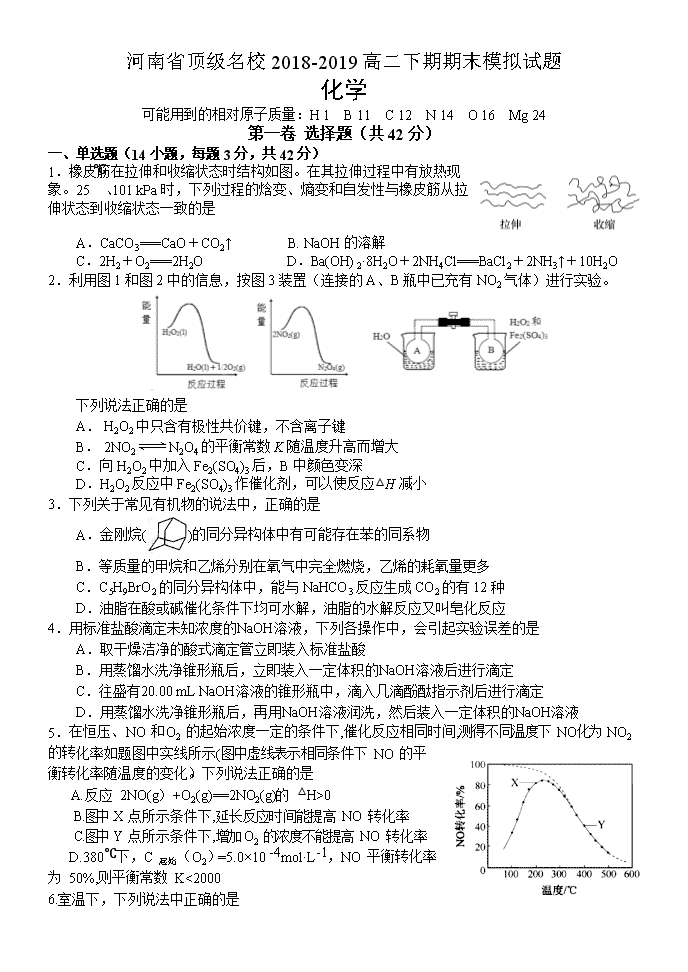
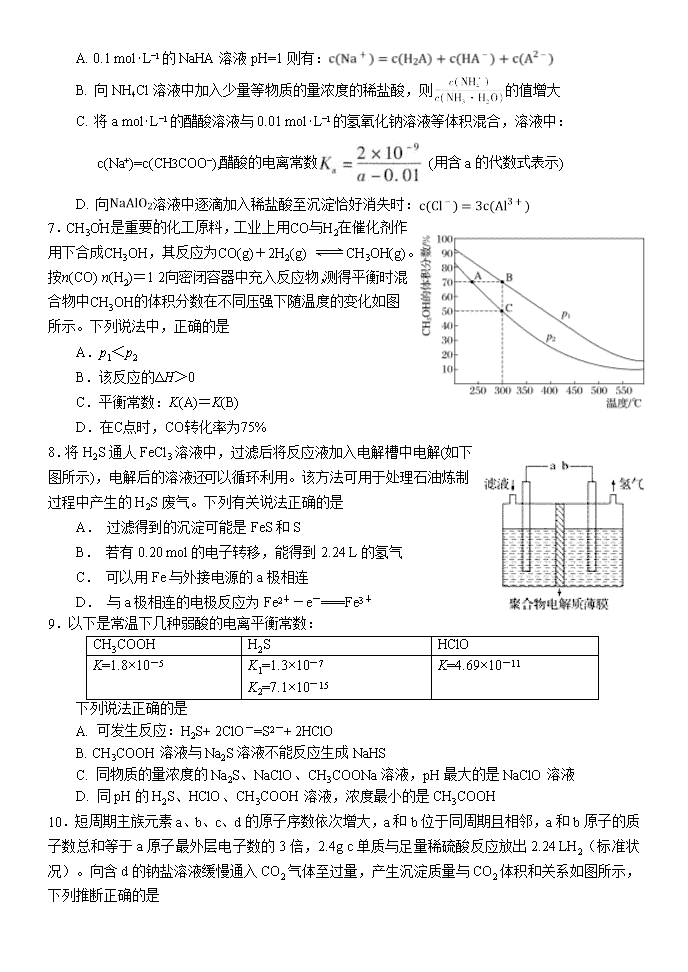
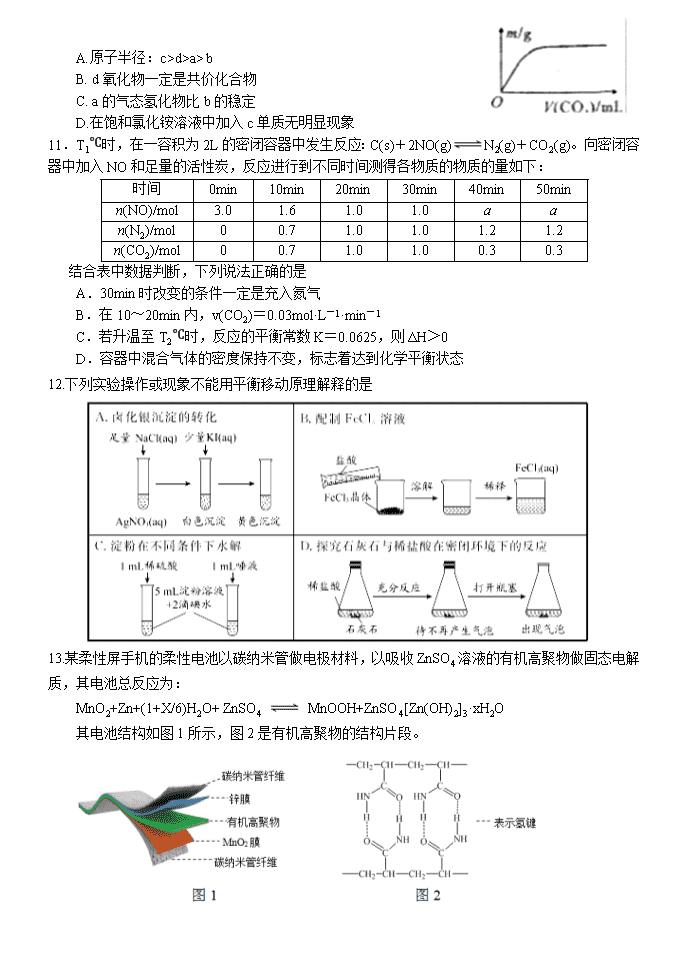
河南省顶级名校2018-2019高二下期期末模拟试题 化学 可能用到的相对原子质量:H 1 B 11 C 12 N 14 O 16 Mg 24 第一卷 选择题(共42分) 一、单选题(14小题,每题3分,共42分) 1.橡皮筋在拉伸和收缩状态时结构如图。在其拉伸过程中有放热现象。25 ℃、101 kPa时,下列过程的焓变、熵变和自发性与橡皮筋从拉伸状态到收缩状态一致的是 A.CaCO3===CaO+CO2↑ B. NaOH的溶解 C.2H2+O2===2H2O D.Ba(OH)2·8H2O+2NH4Cl===BaCl2+2NH3↑+10H2O 2.利用图1和图2中的信息,按图3装置(连接的A、B瓶中已充有NO2气体)进行实验。 下列说法正确的是 A. H2O2中只含有极性共价键,不含离子键 B. 2NO2N2O4的平衡常数K随温度升高而增大 C.向H2O2中加入Fe2(SO4)3后,B中颜色变深 D.H2O2反应中Fe2(SO4)3作催化剂,可以使反应△H减小 3.下列关于常见有机物的说法中,正确的是 A.金刚烷()的同分异构体中有可能存在苯的同系物 B.等质量的甲烷和乙烯分别在氧气中完全燃烧,乙烯的耗氧量更多 C.C5H9BrO2的同分异构体中,能与NaHCO3反应生成CO2的有12种 D.油脂在酸或碱催化条件下均可水解,油脂的水解反应又叫皂化反应 4.用标准盐酸滴定未知浓度的NaOH溶液,下列各操作中,会引起实验误差的是 A.取干燥洁净的酸式滴定管立即装入标准盐酸 B.用蒸馏水洗净锥形瓶后,立即装入一定体积的NaOH溶液后进行滴定 C.往盛有20.00 mL NaOH溶液的锥形瓶中,滴入几滴酚酞指示剂后进行滴定 D.用蒸馏水洗净锥形瓶后,再用NaOH溶液润洗,然后装入一定体积的NaOH溶液 5.在恒压、NO 和 O2 的起始浓度一定的条件下,催化反应相同时间,测得不同温度下 NO化为 NO2 的转化率如题图中实线所示(图中虚线表示相同条件下 NO 的平衡转化率随温度的变化)。下列说法正确的是 A.反应 2NO(g)+O2(g)==2NO2(g)的 △H>0 B.图中 X 点所示条件下,延长反应时间能提高 NO 转化率 C.图中 Y 点所示条件下,增加 O2 的浓度不能提高 NO 转化率 D.380℃下,C 起始(O2)=5.0×10 -4mol·L-1,NO 平衡转化率为 50%,则平衡常数 K<2000 6.室温下,下列说法中正确的是 A. 0.1 mol⋅L−1的NaHA溶液pH=1则有: B. 向NH4Cl溶液中加入少量等物质的量浓度的稀盐酸,则的值增大 C. 将a mol⋅L−1的醋酸溶液与0.01 mol⋅L−1的氢氧化钠溶液等体积混合,溶液中:c(Na+)=c(CH3COO−),醋酸的电离常数 (用含a的代数式表示) D. 向溶液中逐滴加入稀盐酸至沉淀恰好消失时: 7.CH3OH是重要的化工原料,工业上用CO与H2在催化剂作用下合成CH3OH,其反应为CO(g)+2H2(g) CH3OH(g)。按n(CO)∶n(H2)=1∶2向密闭容器中充入反应物,测得平衡时混合物中CH3OH的体积分数在不同压强下随温度的变化如图所示。下列说法中,正确的是 A.p1<p2 B.该反应的ΔH>0 C.平衡常数:K(A)=K(B) D.在C点时,CO转化率为75% 8.将H2S通人FeCl3溶液中,过滤后将反应液加入电解槽中电解(如下图所示),电解后的溶液还可以循环利用。该方法可用于处理石油炼制过程中产生的H2S废气。下列有关说法正确的是 A. 过滤得到的沉淀可能是FeS和S B. 若有0.20 mol的电子转移,能得到2.24 L的氢气 C. 可以用Fe与外接电源的a极相连 D. 与a极相连的电极反应为Fe2+-e-===Fe3+ 9.以下是常温下几种弱酸的电离平衡常数: CH3COOH H2S HClO K=1.8×10-5 K1=1.3×10-7 K2=7.1×10-15 K=4.69×10-11 下列说法正确的是 A. 可发生反应:H2S+ 2ClO-=S2-+ 2HClO B. CH3COOH溶液与Na2S溶液不能反应生成NaHS C. 同物质的量浓度的Na2S、NaClO、CH3COONa溶液,pH最大的是NaClO溶液 D. 同pH的H2S、HClO、CH3COOH溶液,浓度最小的是CH3COOH 10.短周期主族元素a、b、c、d的原子序数依次增大,a和b位于同周期且相邻,a和b原子的质子数总和等于a原子最外层电子数的3倍,2.4g c单质与足量稀硫酸反应放出2.24 LH2(标准状况)。向含d的钠盐溶液缓慢通入CO2气体至过量,产生沉淀质量与CO2体积和关系如图所示,下列推断正确的是 A.原子半径:c>d>a> b B. d氧化物一定是共价化合物 C. a的气态氢化物比b的稳定 D.在饱和氯化铵溶液中加入c单质无明显现象 11.T1℃时,在一容积为2L的密闭容器中发生反应:C(s)+2NO(g)N2(g)+CO2(g)。向密闭容器中加入NO和足量的活性炭,反应进行到不同时间测得各物质的物质的量如下: 时间 0min 10min 20min 30min 40min 50min n(NO)/mol 3.0 1.6 1.0 1.0 a a n(N2)/mol 0 0.7 1.0 1.0 1.2 1.2 n(CO2)/mol 0 0.7 1.0 1.0 0.3 0.3 结合表中数据判断,下列说法正确的是 A.30min时改变的条件一定是充入氮气 B.在10~20min内,v(CO2)=0.03mol·L-1·min-1 C.若升温至T2℃时,反应的平衡常数K=0.0625,则ΔH>0 D.容器中混合气体的密度保持不变,标志着达到化学平衡状态 12.下列实验操作或现象不能用平衡移动原理解释的是 13.某柔性屏手机的柔性电池以碳纳米管做电极材料,以吸收ZnSO4溶液的有机高聚物做固态电解质,其电池总反应为: MnO2+Zn+(1+X/6)H2O+ ZnSO4 MnOOH+ZnSO4[Zn(OH)2]3·xH2O 其电池结构如图1所示,图2是有机高聚物的结构片段。 下列说法中,不正确的是 A.碳纳米管具有导电性,可用作电极材料 B.放电时,电池的正极反应为:MnO2 + e−+ H+== MnOOH C.充电时,Zn2+移向Zn膜 D.合成有机高聚物的单体是: 14.常温下,向10 mL0.1 mol/L的CuCl2溶液中滴加0.1 mol/L的Na2S溶液,滴加过程中溶液中“-lgc(Cu2+)”随滴入的Na2S溶液体积的变化如图所示(忽略滴加过程中的温度变化和溶液体积变化)。下列叙述正确的是 A.b 点溶液中 c(Na+)=2c(Cl-) B.c点溶液中水的电离程度大于a点和d点溶液 C.d 点溶液中 c (Na+) >c (Cl-) >c (S2-) >c (OH-) >c (H+) D.常温下Ksp (CuS)的数量级为10-35 第二卷 非选择题(共58分) 二、非选择题 必做题(本题包括2小题,共28分) 15.(14分) 碳、氮等元素及其化合物和人类生产、生活密切相关,请回答下列问题: (1)氨催化氧化是硝酸工业的基础,在某催化剂作用下只发生如下反应: 主反应:4NH3(g)+5O2(g)4NO(g)+6H2O(g) △H=-905kJ/mol 副反应:4NH3(g)+3O2(g)2N2(g)+6H2O(g) △H=-1268kJ/mol ①氮气被氧气氧化为NO的热化学方程式为 。 ②有关物质产率与温度的关系如图。下列说法正确的是 。 A.工业上进行氨催化氧化生成 NO时,温度应控制在780~840℃之间 B.工业上采用物料比 在1.7~2.0,主要目的是为了提高反应速率 C.在加压条件下生产能力可提高5~6倍,是因为加压可提高转化率 D.选择合适的催化剂,可以大幅度提高NO在最终产物中的比率 (2)NaOH溶液可以吸收氮的氧化物:NO2+NO+2NaOH=2NaNO2+H2O。室温下,用一定量的NaOH溶液吸收NO、NO2混合气体,得到NaNO2溶液。已知HNO2的电离常数Ka=7.1×10-4,那么室温下NO2-的水解常数Kh=_________, NaNO2溶液中微粒浓度的大小顺序为____ ______________。 (3)一定温度下,在3.0L密闭容器中,通入0.10mol CH4和0.20mol NO2进行反应, CH4(g)+2NO2(g) CO2(g)+N2(g)+2H2O(g)△H<0,反应时间(t)与容器内气体总压强(p)的数据见下表: 时间(t/min) 0 2 4 6 8 10 总压强(p/100kPa) 4.80 5.44 5.76 5.92 6.00 6.00 ①由表中数据计算0~4min内υ(NO2)=_________,该温度下的压强平衡常数Kp=______kPa。 ②在一恒容密闭容器中,通入一定量CH4和NO2,测得在相同时间内,在不同温度下,NO2的转化率如图 [横坐标为反应温度,纵坐标为NO2转化率α(NO2)/%]: c点 (填“是”或“不是”)反应达平衡的点。d点之后,转化率随温度升高而降低的原因是 。 16. (14分) Li4Ti5O12和LiFePO4都是锂离子电池的电极材料,可利用钛铁矿(主要成分为FeTiO3,还含有少量MgO、SiO2等杂质)来制备,工艺流程如下:回答下列问题: (1)“酸浸”实验中,铁的浸出率结果如下图所示。由图可知,当铁的浸出率为70%时,所采用的实验条件为_________________________________________________。 (2)“酸浸”后,钛主要以TiOCl42-形式存在,写出相应反应的离子方程式_______________________________________________________。 (3)TiO2·xH2O沉淀与双氧水、氨水反应40 min所得实验结果如下表所示:分析40 ℃时TiO2·xH2O转化率最高的原因 ________________________________________________________。 (4)Li2Ti5O15中Ti的化合价为+4,其中过氧键的数目为__________________。 (5)若“滤液②”中c(Mg2+)=0.02mol/L,加入双氧水和磷酸(设溶液体积增加1倍),使Fe3+恰好沉淀完全即溶液中c(Fe3+)=1×10-5mol/L,此时是否有Mg3(PO4)2 沉淀生成?(列式计算)。FePO4、Mg3(PO4)2的Ksp分别为1.3×10-22、1.0×10-24。_____________________________________________________________________________________________________________________________________________________________________。 (6)写出“高温煅烧②”中由FePO4制备LiFePO4的化学方程式 ____________________________________________________________________________ 。 选做题(共30分) 考生只能从选修五和选修三这两个模块中任选其中一个模块答题,不能交叉选择。 选修五——有机化学基础模块 17.(15分) 2氧代环戊羧酸乙酯(K)是常见医药中间体,聚酯G是常见高分子材料,它们的合成路线如图所示: 已知:①气态链烃A在标准状况下的密度为1.875 g·L-1 回答下列问题: (1)B的名称为_______ _;E的结构简式为______ __。 (2)下列有关K的说法正确的是________。 A.易溶于水,难溶于CCl4 B.分子中五元环上碳原子均处于同一平面 C.能发生水解反应、加成反应 D.1 mol K完全燃烧消耗9.5 mol O2 (3)⑥的反应类型为_____ ___;⑦的化学方程式为_____________________________。 (4)与F官能团的种类和数目完全相同的F的同分异构体有________种(不含立体异构),其中核磁共振氢谱为4组峰,且峰面积之比为1∶2∶3∶4的是_______________________ _________________________________________________(写结构简式)。 (5) 利用以上合成路线中的相关信息,请写出以乙醇为原料(其他无机试剂任选)制备的合成路线。 ______________________________________________________________________________________________________________________________________________________________ 。 18. (15分) 有机物K是一种治疗缺血性脑卒药物,其合成路线如下: 已知:ⅰ.有机物K是一种酯,分子中除苯环外还含有1个五元环; ⅱ.。 回答下列问题: (1)有机物B的名称为____________,D的含氧官能团的名称是________________。 (2)F→G的反应类型分别为_________________。 (3)J的结构简式为______________,K的分子式为___________________。 (4)E与银铵溶液反应的化学方程式为____________________________。 (5)已知B在一定条件下可以水解生成X,与X互为同分异构体且含有苯环的有机物有_____种(不含X自身),写出其中核磁共振氢谱有4组吸收峰,且峰值比为3:2:2:1的结构简式__________________(任写一种)。 (6)利用题中信息所学知识,写出以甲烷和化合物A为原料,合成苯乙烯的路线流程图(其他试剂自选)__________________________________________________。 选修三——物质结构与性质模块 19.(15分)X、Y、Z、M、N、Q、P为元素周期表前四周期的7种元素。其中,X原子核外的M层中只有两对成对电子,Y原子核外的L层电子数是K层的两倍,Z是地壳内含量最高的元素,M的内层电子数是最外层电子数的9倍,N的原子序数比M小1,Q在元素周期表的各元素中电负性最大。P元素的第三电子层处于全充满状态,第四电子层只有一个电子请回答下列问题: (1)基态X的外围电子电子排布式为 ,P元素属于 区元素。 (2)XZ2分子的空间构型是 ,YZ2分子中Y的杂化轨道类型为 ,相同条件下两者在水中的溶解度较大的是 (写分子式),理由是 。 (3)含有元素N的盐的焰色反应为 色,许多金属盐都可以发生焰色反应,其原因是 。 (4)元素M与元素Q形成晶体中,M离子与Q离子的配位数之比为 。 (5)P单质形成的晶体中,P原子采取的堆积方式为 ,P原子采取这种堆积方式的空间利用率为 (用含π表达式表示)。 20.(15分)钕铁硼磁铁是目前为止具有最强磁力的永久磁铁,预计在未来20年里,不可能有替代钕铁硼磁铁的磁性材料岀现。生产钕铁硼磁铁的主要原材料有稀土金属钕、纯铁、铝、硼以及其它稀土原料。 (1)钕(Nd)为60号元素,位于周期表中第______周期;基态铁原子的外围电子轨道表示式为__________________。 (2)实验测得AlCl3的实际存在形式为Al2Cl6,其分子的球棍模型如图所示。 ①已知Al2Cl6分子中正负电荷中心重合,则Al2Cl6属于_________分子(填“极性”或“非极性”),分子中A1原子的轨道杂化方式为________。 ②Al2Cl6与过量NaOH溶液反应生成Na[Al(OH)4],[A1(OH)4]-中存在的化学键有_______。 A.离子键 B.共价键 C.金属键 D.配位键 E.氢键 (3)B(硼)元素及与其同周期相邻的两种元素第一电离能由小到大的顺序为____________(用元素符号表示)。 (4)配合物CrCl3·6H2O中心离子Cr3+的配位数为6,向含0.1molCrCl3·6H2O 的溶液中滴加2mol·L-1 AgNO3溶液,反应完全后共消耗AgNO3溶液50mL,则配离子的化学式为___________。 (5)氯和钾与+2价的铜可生成一种催化乙炔聚合反应的配合物,其阴离子为无限长链结构(如下图),这种配合物的化学式为_________。 (6)已知立方BN晶体硬而脆,其晶胞结构如图所示,N原子填充在B原子构成的正四面体空隙中,则晶胞中正四面体的空隙填充率为___________,设晶胞中最近的B、N原子之间的距离为a nm,晶体的密度为b g·cm-3,则阿伏加德罗常数为_________mol-1(列式即可,用含a、b的代数式表示) 化学期末模拟题答案 1-5:DCCDB 6-10:BDDDA 11-14:DCBC 15 (14分) (除标注外,其余2分) (1)①N2(g)+O2(g)2NO(g) △H=+181.5 kJ/mol ②AD (2)1.4×10-11 (1分) c(Na+ )>c(NO2-)>c(OH-)>c(HNO2)>c(H+) (3)①0.01mol/(L•min) 3240 ②不是 (1分) 正反应放热,温度升高,平衡逆向移动,反应物转化率降低 16. (14分) (1)100℃、2h,90℃,5h (2分) (2)FeTiO3+ 4H++4Cl− = Fe2++ + 2H2O(2分) (3)低于40℃,TiO2·xH2O转化反应速率随温度升高而增加;超过40℃,双氧水分解与氨气逸出导致TiO2·xH2O转化反应速率下降 (2分) (4)4(2分) (5)Fe3+恰好沉淀完全时,c()=mol·L−1=1.3×10–17 mol·L−1,c3(Mg2+)×c2()=(0.01)3×(1.3×10–17)2=1.7×10–40<Ksp [Mg3(PO4)2],因此不会生成Mg3(PO4)2沉淀(3分) (6)2FePO4 + Li2CO3+ H2C2O42LiFePO4+ H2O↑+ 3CO2↑(3分) 17.(15分) (1)1,2二氯丙烷 (1分) (2分) (2) C D (2分) (3)取代反应(1分) (2分) (4) (2分) (2分) (5) (3分) 18. (15分) (1)邻溴甲苯或2-溴甲苯;(1分)羟基(1分) (2) 加成反应(1分) (3) (2分) C12H14O2 (2分) (4) (2分) (5)4 (2分) (1分) (6)CH4CH3Br CH3MgBr; (3分) 19. (15分)(1) 3s23p4 ;(1分) ds;(1分) (2) V形;(1分)sp杂化;(1分)SO2;(1分) (3) SO2为极性分子,CO2为非极性分子,H2O为极性溶剂,极性分子易溶于极性溶剂,故SO2的溶解度较大;(2分) (3)紫;(1分)电子由较高能级跃迁到较低能级时,以光的形式释放能量;(2分) (4)2:1;(2分) (5)面心立方最密堆积;(1分) ;(2分) 20. (15分)(1)六(1分) (1分) (2)①非极性(1分) sp3(1分) ②BD(2分) (3)B查看更多
相关文章
- 当前文档收益归属上传用户