2019-2020学年江苏省海安高级中学高一上学期期中考试化学试题(创新班)
2019-2020学年度第一学期期中考试
高一化学(创新班)试卷
本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分,共100分,考试用时90分钟。
注意事项:
1.考生务必在答题纸姓名栏内写上自己的姓名、准考证号等,并用2B铅笔涂写在答题卡上。
2.每小题选出正确答案后,用2B铅笔把答题卡上对应题号的答案标号涂黑。如需改动,用橡皮擦干净后,再选涂其他答案。不能答在试题卷上。II卷答案填写在答题卡相应位置。
可能用到的相对原子质量:H 1 C 12 N 14 O 16 Na 23 Mg 24 Al 27 Cl 35.5 Zn 65
第Ⅰ卷(选择题,共40分)
单项选择题(本题包括10小题,每小题2分,共计20分。每小题只有一个选项符合题意。)
1.下列有关物质性质与用途具有对应关系的是
A.碳酸钠溶液显碱性,可用作食用碱或工业用碱
B.浓硫酸具有脱水性,可用于干燥氯气
C.明矾与水反应生成氢氧化铝胶体,可用于饮用水杀菌消毒
D.晶体硅熔点高硬度大,可用于制作半导体材料
2.下列关于各实验装置与对应现象或结论的叙述均正确的是
图1 图2 图3 图4
A.图1装置:可用于分离石油,分别得到汽油、煤油和柴油等各种纯净物
B.图2装置:可用于吸收NH3或HCl气体,并防止倒吸
C.图3装置:“a进b出”可用于收集NO2,“b进a出”可用于收集NH3
D.图4装置:持续通入CO2气体,现象是先出现白色沉淀,后变澄清
3.常温下,下列各组离子一定能在指定溶液中大量共存的是
A. =10-12的溶液中:NH4+、Cu2+、NO3-、SO42-
B.能使甲基橙变红的溶液:Ca2+、K+、HCO3-、NO3-
C.pH=l 的溶液中:Ba2+、Fe3+ 、Cl-、SCN-
D.由水电离的c(H+)=10-12mol·L-1的溶液中:Na+、Al3+、Cl-、NO3-
4.某温度下,在恒容密闭容器中充入NO2,发生反应2NO2(g)N2O4(g) ΔH<0,达到平衡后,下列说法不正确的是
A.升高温度,体系的颜色加深
B.再充入少量NO2,达平衡后NO2的体积分数增大
C. 再充入少量NO2,达平衡后NO2的转化率增大
D.再充入少量N2O4,平衡向逆反应方向移动,达到新平衡后NO2的体积分数减小
5.煤的液化可以合成甲醇。下列有关说法正确的是
①“气化”: C(s)+2H2O(g) CO2(g)+2H2(g) ΔH1=+90.1 kJ·mol-1
②催化液化Ⅰ: CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH2= - 49.0 kJ·mol-1
③催化液化Ⅱ: CO2(g)+2H2(g) CH3OH(g)+1/2O2(g) ΔH3= a kJ·mol-1
A.催化液化Ⅰ中使用催化剂,反应的活化能Ea、ΔH2都减小
B.反应C(s)+H2O(g)+H2(g)CH3OH(g) ΔH=+41.1 kJ·mol-1
C.ΔH2>ΔH3
D.如图为甲醇燃料电池的工作原理示意图,负极的电极反应为:
CH3OH-6e- + 6OH- === CO2↑ + 5H2O
6.下列化学反应对应的离子方程式书写正确的是
A.氢氧化钡溶液与稀硫酸溶液反应:Ba2+ + SO42-===BaSO4↓
B.用稀硝酸洗涤试管内壁的银:Ag + 2H++ NO3-===Ag++ NO↑ + H2O
C.用过量的氨水吸收烟道气中的SO2:SO2 + 2NH3·H2O === 2NH4+ + SO32- + H2O
D.Ca(OH)2溶液与过量NaHCO3溶液反应:HCO3-+Ca2++OH-===CaCO3↓+H2O
7.在给定条件下,下列选项所示的物质间转化均能实现的是
A.Fe Fe2O3 Fe2(SO4)3
B.SiO2 Na2SiO3 H2SiO3
C.
D.
8.短周期主族元素X、Y、Z、W的原子序数依次增大。X原子的最外层电子数是其内层电子数的2倍,Y是地壳中含量最高的元素,Z2+与Y2-具有相同的电子层结构,W与X同主族。下列说法正确的是
A.原子半径大小顺序:r(W)>r(Z)>r(Y)>r(X)
B.Y分别与Z、W形成的化合物中化学键类型相同
C.X的最高价氧化物对应水化物的酸性比W的弱
D.Y的气态简单氢化物的热稳定性比X的强
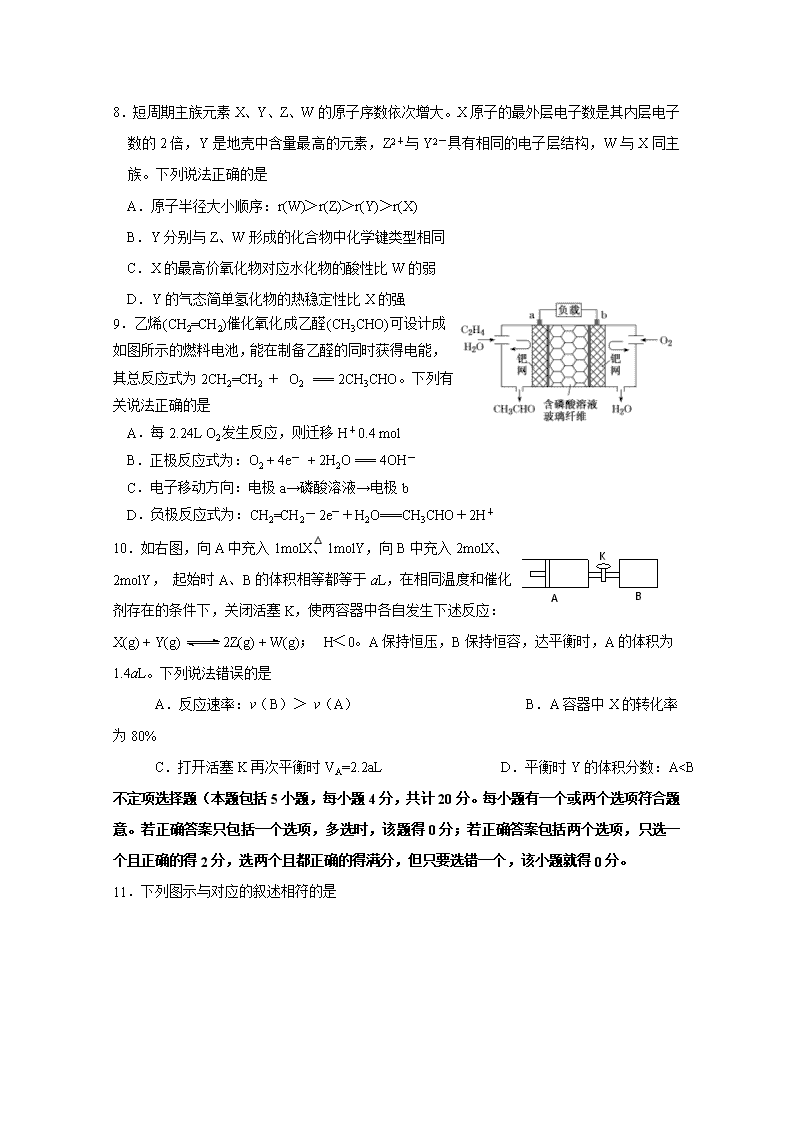
9.乙烯(CH2=CH2)催化氧化成乙醛(CH3CHO)可设计成如图所示的燃料电池,能在制备乙醛的同时获得电能,其总反应式为2CH2=CH2 + O2 === 2CH3CHO。下列有关说法正确的是
A.每2.24L O2发生反应,则迁移H+0.4 mol
B.正极反应式为:O2 + 4e- + 2H2O === 4OH-
C.电子移动方向:电极a→磷酸溶液→电极b
D.负极反应式为:CH2=CH2-2e-+H2O===CH3CHO+2H+
K
A
B
10.如右图,向A中充入1molX、1molY,向B中充入2molX、2molY, 起始时A、B的体积相等都等于aL,在相同温度和催化剂存在的条件下,关闭活塞K,使两容器中各自发生下述反应:X(g) + Y(g)2Z(g) + W(g);△H<0。A保持恒压,B保持恒容,达平衡时,A的体积为1.4aL。下列说法错误的是
A.反应速率:v(B)> v(A) B.A容器中X的转化率为80%
C.打开活塞K再次平衡时VA=2.2aL D.平衡时Y的体积分数:A
Si
12. 根据下列实验操作和现象所得出的结论正确的是
13.已知:CH4(g)+2H2S(g)CS2(g)+4H2(g)。向恒容密闭容器中充入0.1 mol CH4和0.2 mol H2S发生反应,各物质的物质的量分数随温度变化如图所示:
下列说法正确的是
A.该反应的ΔH<0
B.X点与Y点容器内压强比为55∶51
C.X点CH4的转化率为20%
D.维持Z点温度,向容器中再充入CH4、H2S、CS2、H2 各0.1 mol 时v(正) II
15.利用CO2重整CH4制合成气的反应为CO2(g)+CH4(g)2CO(g)+2H2(g);ΔH>0。在容积均为2.0 L的四个恒容密闭容器中,按不同方式投料(如下表所示),测得反应的相关数据如下:下列说法正确的是
容器
温度/℃
物质的起始物质的量/mol
物质的平衡物质的量/mol
n(CO2)
n(CH4)
n(CO)
n(H2)
n(H2)
Ⅰ
T1
0
0.8
0.8
0.8
0.6
Ⅱ
T1
1.2
1.2
1.2
1.2
/
Ⅲ
T2
1.0
2.0
0
0
1.0
Ⅳ
T2
0.5
1.0
0
0
/
A.T1>T2
B.容器Ⅱ起始时的反应速率:v(正)>v(逆)
C.容器Ⅳ的平衡常数为1.33
D. 容器Ⅲ中CO2的平衡转化率比容器Ⅳ中的小
第Ⅱ卷(非选择题 共60分)
16.(12分)使用磷肥副产物氟硅酸钠(Na2SiF6)为原料合成冰晶石(Na3AlF6)成为一条合理利用资源、提高经济效益的新方法。工艺流程如下图所示:
(1) 传统合成冰晶石的方法是萤石(CaF2)法:使用萤石、石英和纯碱在高温下煅烧生成NaF,在NaF溶液中加入Al2(SO4)3溶液制得。在加入硫酸铝溶液前,需先用硫酸将NaF溶液的pH调至5左右,否则可能产生副产物 ▲ (填物质的化学式),但酸度不宜过强的原因是 ▲ 。
(2) 氨解时白炭黑产率和冰晶石纯度与pH的关系如图,氨解时需要控制溶液的pH= ▲ ;能提高氨解速率的措施有 ▲ (填字母)。
A.快速搅拌
B.加热混合液至100 ℃
C.减小氨水浓度
D.及时分离出白炭黑
(3) 工艺流程中氨解反应的化学方程式为 ▲ ;
冰晶石合成反应的离子方程式为 ▲ _________。
(4)为了提高原料利用率,减少环境污染,可采取的措施是 ▲ 。
17.(14分)已知t ℃时,0.01 mol/L NaOH溶液的pH=11,0.1 mol/L的HA溶液中c(H+)/c(OH-)=107
请回答下列问题:
(1)该温度下,水的离子积Kw= ▲ ,0.1 mol/L的HA溶液中水电离出的c(OH-)= ▲ 。
(2)在室温下,将pH之和为14的NaOH溶液和HA溶液等体积混合后,所得溶液呈 ▲ (填“酸”“碱”或“中”)性。
(3)在室温下,蒸馏水稀释0.01 mol/L HA溶液时,下列呈减小趋势的是 ▲ 。
A.水的电离程度 B.c(HA)/c(A-)
C.溶液中c(H+)和c(OH-)的乘积 D.溶液中HA的电离程度
(4)室温下,取pH=2的盐酸和HA溶液各100 mL,向其中分别加
入适量的Zn粒,反应过程中两溶液的pH变化如右图所示:
①图中表示HA溶液pH变化曲线的是 ▲ (填“A”或“B”)。
②设盐酸中加入Zn的质量为m1,HA溶液中加入Zn的质量为m2,则m1 ▲ m2(填“>”“<”或“=”)。
(5) 室温下,取0.01 mol/L的盐酸和HA溶液各100 mL,分别滴加0.01 mol/LNaOH溶液至恰好完全反应,所需NaOH溶液的体积前者 ▲ 后者(填“>”“<”或“=”)。
18.(14分)草酸晶体的组成可用H2C2O4·xH2O表示,为了测定x值,进行如下实验:
①称取w g草酸晶体,配成100.0mL水溶液。
②量取25.00mL所配制的草酸溶液置于锥形瓶内,加入适量稀硫酸。
③用浓度为a mol·L−1的KMnO4溶液滴定至恰好完全反应。
所发生反应:KMnO4+H2C2O4+H2SO4——K2SO4+CO2↑+MnSO4+H2O(未配平)。
试回答:
(1) 实验中,标准液KMnO4溶液应装在 ▲ 中。
(2) 滴定终点的现象为 ▲ 。
(3) 误差讨论:
①若滴定终点时俯视滴定管刻度,则由此测得的x值会 ▲ (填“偏大”“偏小”或“不变”,下同)。
②若滴定时所用的酸性KMnO4溶液因久置而导致浓度变小,则由此测得的x值会 ▲ 。
(4) 在滴定过程中若用a mol·L−1的KMnO4溶液V mL,则所配制的草酸溶液的物质的量浓度为____ ▲ mol·L−1,由此可计算x值是____▲ ____。(用代数式表达)
19.(14分)Ⅰ.甲、乙两个容积相等的恒容密闭容器,向甲中通入6mol A和2mol B,向乙中通入1. 5mol A、0.5mol B和3molC和2molD,将两容器的温度恒定在770K,使反应3A(g)+B(g)xC(g) +D(s)达到平衡,此时测得甲、乙两容器中C的体积分数都为0.2,试回答下列有关问题:
(1)若平衡时,甲、乙两容器中A的物质的量相等,则x=____ ▲ __;若平衡时,甲、乙两容器中A的物质的量不相等,则x=____ ▲ _。
(2)平衡时甲中A的体积分数为____ ▲ ___。
(3)若平衡时,甲、乙两容器中A的物质的量相等,改为按不同配比作为乙的起始物质,达到平衡后,C的体积分数都仍为0.2。若加入0.6molA和0.2molB,则C的起始物质的量应满足_____ ▲ __ ,D的起始物质的量应满足的条件是 __ ▲ ___。
Ⅱ.综合利用CO2、CO对构建低碳社会有重要意义。
(4)CO和H2在催化剂作用下发生如下反应:CO(g)+2H2(g)CH3OH(g)。对此反应进行如下研究:某温度下在一恒压容器中分别充入1.2 mol CO和1 mol H2,达到平衡时容器体积为2 L,且含有0.4 mol CH3OH(g),则该反应平衡常数为 __ ▲ ,此时向容器中再通入0.35 mol CO气体,则此平衡将__ ▲ (填“向正反应方向”、“不”或“向逆反应方向”)移动。
20.(6分)A、B、C、D为原子序数依次增大的前四周期元素,元素A原子最外层电子数比内层多3个,元素B基态原子核外有2个未成对电子,元素C的最高价和最低价代数和等于0,元素D位于周期表ⅥB 族。
(1) 判断离子AB3-的空间构型为 ▲ 。
(2) 元素A、C形成的化合物熔点 ▲ C形成的单质晶体熔点。(填“大于”、“小于”)
(3) 在A的氢化物(A2H4)分子中,A原子轨道的杂化类型是 ▲ 。
(4)
元素B与D形成的一种化合物广泛应用于录音磁带上,其晶胞如右图所示。该化合物的化学式为 ▲ 。
(5) 向D的氯化物DCl3溶液中滴加氨水可形成配合物[D(NH3)3(H2O)Cl2]Cl。
①离子D3+的外围电子排布式为 ▲ 。
②1 mol该配合物中含配位键的数目为 ▲ 。
2019—2020学年度第一学期期中考试
化学(创新班)参考答案及评分标准
1
2
3
4
5
6
7
8
A
C
A
B
B
C
B
D
9
10
11
12
13
14
15
D
C
B
C
CD
BD
AD
16. (12分,每空2分)
(1) Al(OH)3(2分) H+和F-结合生成弱酸HF,使F-浓度减低不易生成Na3AlF6(2分)
(2) 8.5 A (各1分)
(3) Na2SiF6+4NH3·H2O === 2NaF+4NH4F+SiO2+2H2O (2分)
3Na++4NH+6F-+AlO+2H2O == Na3AlF6↓+4NH3·H2O(2分)
(4) 过滤2的滤液氨水可循环利用(2分)
17. (14分,每空2分)
(1)1×10-13 10-10mol/L (2)酸 (3)B
(4)①B ②< (5) =
18. (14分,每空2分)
(1)酸式滴定管(2分)
(2) 最后一滴KMnO4溶液加入时,溶液变成紫红色,且半分钟内不褪色 (2分)
(3)①偏大(2分) ②偏小(2分)
(4);(2分)
(5)-5(4分)
19. (14分,每空2分)
⑴ 2,4 ⑵0.6 ⑶n(C)=3.6mol n(D)>1.13mol ⑷50 向逆反应方向
20. (6分,每空1分)
(1)平面三角形
(2)大于
(3)sp3
(4)VO2
(5)①3d2 ②17mol