2021高考化学全国通用一轮习题:第八章 微考点66 水溶液中的“三大守恒”和浓度大小比较 Word版含解析
1.常温下,下列有关溶液的叙述正确的是( )
A.浓度均为0.1 mol·L-1的硫酸氢铵溶液与氢氧化钠溶液等体积混合:
c(SO)=c(Na+)>c(NH)>c(H+)>c(OH-)
B.在Na2SO3溶液中:c(Na+)=2c(SO)+c(HSO)+c(OH-)
C.pH=6的CH3COOH溶液和pH=6的NH4Cl溶液,由水电离出的c(H+)均为1×10-8 mol·L-1
D.在0.1 mol·L-1 Na2C2O4溶液中:
2c(Na+)=c(C2O)+c(HC2O)+c(H2C2O4)
2.(2020·西安模拟)下列溶液中粒子的物质的量浓度关系正确的是( )
A.0.1 mol·L-1 NaHCO3溶液与0.1 mol·L-1 NaOH溶液等体积混合,所得溶液中:
c(Na+)>c(CO)>c(HCO)>c(OH-)
B.20 mL 0.1 mol·L-1 CH3COONa溶液与10 mL 0.1 mol·L-1 盐酸混合后溶液呈酸性,所得溶液中:c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+)
C.室温下,pH=2的盐酸与pH=12的氨水等体积混合,所得溶液中:c(Cl-)+c(H+)>c(NH)+c(OH-)
D.0.1 mol·L-1 CH3COOH溶液与0.1 mol·L-1 NaOH溶液等体积混合,所得溶液中:
c(OH-)>c(H+)+c(CH3COOH)
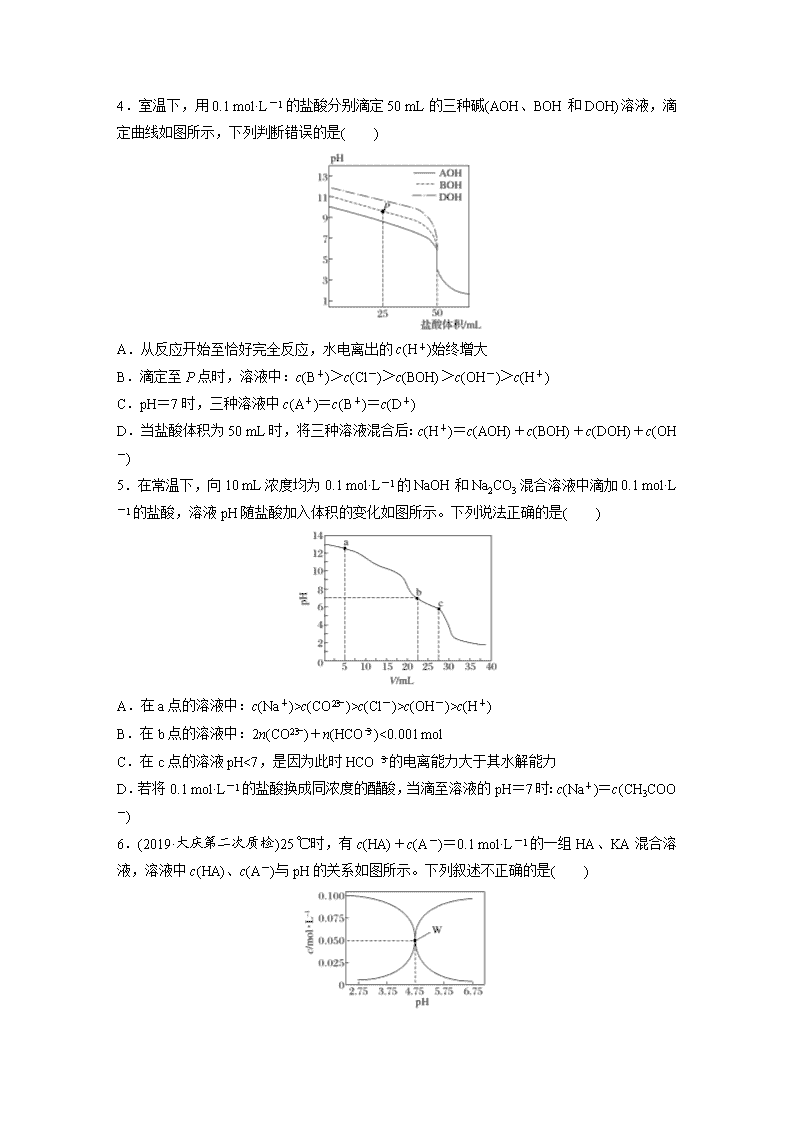
3.(2019·咸阳质检)亚砷酸(H3AsO3)可以用于治疗白血病,在溶液中存在多种微粒形态。向1 L 0.1 mol·L-1 H3AsO3溶液中逐滴加入KOH溶液,各种微粒物质的量分数与溶液的pH关系如图所示。下列说法正确的是( )
A.H3AsO3的电离常数Ka1的数量级为10-9
B.pH在8.0~10.0时,反应的离子方程式:H3AsO3+OH-===H2AsO+H2O
C.M点对应的溶液中:c(H2AsO)+c(HAsO)+c(AsO)+c(H3AsO3)=0.1 mol·L-1
D.pH=12时,溶液中:c(H2AsO)+2c(HAsO)+3c(AsO)+c(H3AsO3)>c(H+)+c(K+)
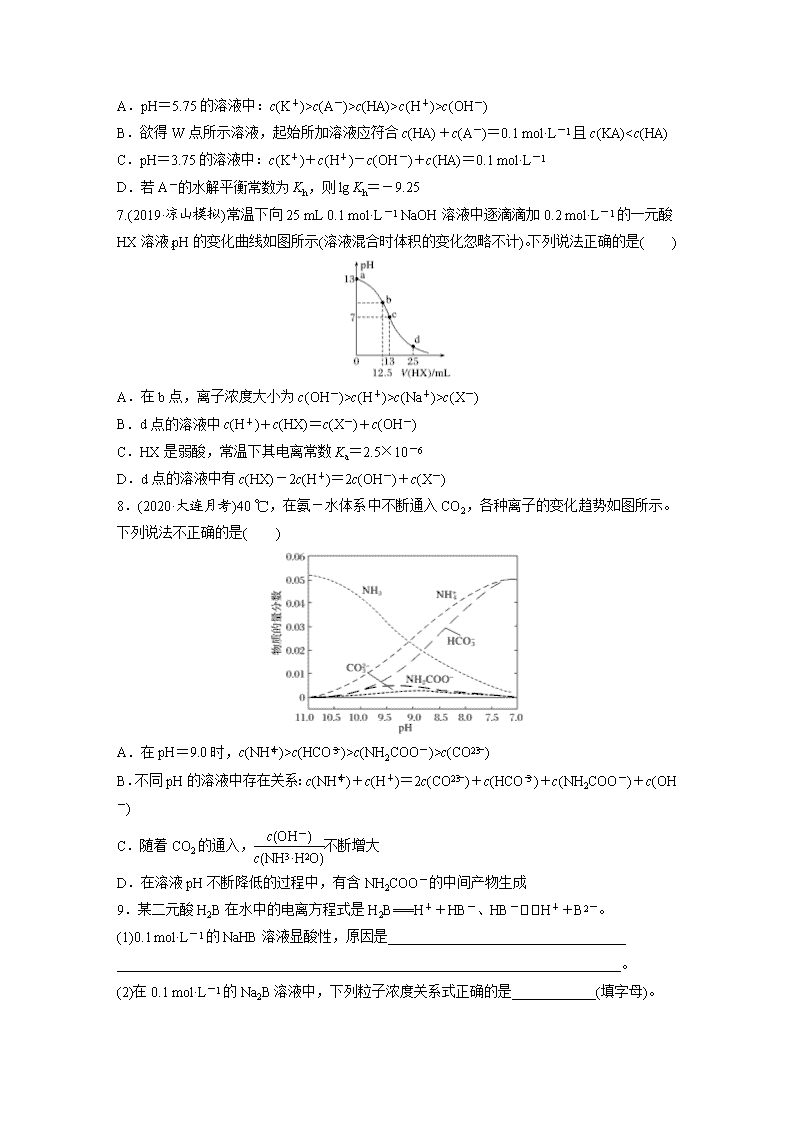
4.室温下,用0.1 mol·L-1的盐酸分别滴定50 mL的三种碱(AOH、BOH和DOH)溶液,滴定曲线如图所示,下列判断错误的是( )
A.从反应开始至恰好完全反应,水电离出的c(H+)始终增大
B.滴定至P点时,溶液中:c(B+)>c(Cl-)>c(BOH)>c(OH-)>c(H+)
C.pH=7时,三种溶液中c(A+)=c(B+)=c(D+)
D.当盐酸体积为50 mL时,将三种溶液混合后:c(H+)=c(AOH)+c(BOH)+c(DOH)+c(OH-)
5.在常温下,向10 mL浓度均为0.1 mol·L-1的NaOH和Na2CO3混合溶液中滴加0.1 mol·L-1的盐酸,溶液pH随盐酸加入体积的变化如图所示。下列说法正确的是( )
A.在a点的溶液中:c(Na+)>c(CO)>c(Cl-)>c(OH-)>c(H+)
B.在b点的溶液中:2n(CO)+n(HCO)<0.001 mol
C.在c点的溶液pH<7,是因为此时HCO的电离能力大于其水解能力
D.若将0.1 mol·L-1的盐酸换成同浓度的醋酸,当滴至溶液的pH=7时:c(Na+)=c(CH3COO-)
6.(2019·大庆第二次质检)25 ℃时,有c(HA)+c(A-)=0.1 mol·L-1的一组HA、KA混合溶液,溶液中c(HA)、c(A-)与pH的关系如图所示。下列叙述不正确的是( )
A.pH=5.75的溶液中:c(K+)>c(A-)>c(HA)>c(H+)>c(OH-)
B.欲得W点所示溶液,起始所加溶液应符合c(HA)+c(A-)=0.1 mol·L-1且c(KA)
c(H+)>c(Na+)>c(X-)
B.d点的溶液中c(H+)+c(HX)=c(X-)+c(OH-)
C.HX是弱酸,常温下其电离常数Ka=2.5×10-6
D.d点的溶液中有c(HX)-2c(H+)=2c(OH-)+c(X-)
8.(2020·大连月考)40 ℃,在氨-水体系中不断通入CO2,各种离子的变化趋势如图所示。下列说法不正确的是( )
A.在pH=9.0时,c(NH)>c(HCO)>c(NH2COO-)>c(CO)
B.不同pH的溶液中存在关系:c(NH)+c(H+)=2c(CO)+c(HCO)+c(NH2COO-)+c(OH-)
C.随着CO2的通入,不断增大
D.在溶液pH不断降低的过程中,有含NH2COO-的中间产物生成
9.某二元酸H2B在水中的电离方程式是H2B===H++HB-、HB-H++B2-。
(1)0.1 mol·L-1的NaHB溶液显酸性,原因是__________________________________
________________________________________________________________________。
(2)在0.1 mol·L-1的Na2B溶液中,下列粒子浓度关系式正确的是____________(填字母)。
A.c(B2-)+c(HB-)=0.1 mol·L-1
B.c(B2-)+c(HB-)+c(H2B)=0.1 mol·L-1
C.c(OH-)=c(H+)+c(HB-)
D.c(Na+)+c(H+)=c(OH-)+c(HB-)
10.在25 ℃时,对于0.10 mol·L-1的氨水,请回答以下问题:
(1)若向氨水中加入少量硫酸铵固体,溶液的pH将____(填“增大”“减小”或“不变”),这是因为________________________________________________________________________
________________________________________________________________________。
(2)若向氨水中加入等体积pH=1的硫酸,此时溶液的pH________(填“>”“<”或“=”)7;用离子方程式表示其原因______________________________________________;
此时溶液中各离子浓度由大到小的顺序为_________________________________________
_____________________________________________________________________________。
(3)向氨水中加入0.05 mol·L-1稀硫酸至溶液正好呈中性,则c(NH)________(填“>”“<”或“=”)2c(SO),此时混合溶液中c(NH)=176c(NH3·H2O),则NH3·H2O的电离常数Kb为________________。
(4)向10 mL 0.10 mol·L-1的氨水中加入10 mL 0.02 mol·L-1的CaCl2溶液,通过计算说明是否会生成沉淀。[已知Ca(OH)2的Ksp=5.5×10-6,氨水中c(OH-)≈ ]
�
答案精析
1.A
2.B [A项,等浓度等体积的NaHCO3与NaOH混合时,两者恰好反应生成Na2CO3,在该溶液中CO能进行两级水解:CO+H2OHCO+OH-、HCO+H2OH2CO3+OH-,故溶液中c(OH-)>c(HCO),错误;B项,CH3COONa与盐酸混合反应后生成的溶液中含有等量的CH3COONa、CH3COOH、NaCl,因溶液显酸性,故溶液中CH3COOH的电离程度大于CH3COO-的水解程度,正确;C项,在混合前两溶液的pH之和为14,则氨水过量,所得溶液为少量NH4Cl和过量NH3·H2O的混合溶液,则c(Cl-)<c(NH)、c(H+)<c(OH-),故c(Cl-)+c(H+)<c(NH)+c(OH-),错误;D项,等浓度的CH3COOH与NaOH溶液混合时恰好生成CH3COONa,溶液中质子守恒式为c(OH-)=c(H+)+c(CH3COOH),错误。]
3.B
4.C [根据图像,加入盐酸50 mL时,达到滴定终点,则三种碱液的浓度均为0.1 mol·L-1,由图中起点坐标可知三种碱均为弱碱,碱性强弱大小关系为AOH<BOH<DOH。从反应开始至恰好完全反应,不断生成可水解的盐,促进水的电离,故水电离出的c(H+)始终增大,A项正确;滴定至P点时,溶质为BOH和BCl,且二者物质的量之比为1∶1,溶液呈碱性,说明BOH的电离程度大于B+的水解程度,故溶液中存在:c(B+)>c(Cl-)>c(BOH)>c(OH-)>c(H+),B项正确;pH=7时,溶液中c(H+)=c(OH-),由电荷守恒可知,c(A+)、c(B+)、c(D+)分别与相应溶液中c(Cl-)相等,由图可知,pH=7时,c(Cl-)大小关系为A<B<D,则c(A+)<c(B+)<c(D+),C项错误;当盐酸体积为50 mL时,三种溶液的溶质分别为ACl、BCl、DCl,将三种溶液混合后根据质子守恒可得c(H+)=c(AOH)+c(BOH)+c(DOH)+c(OH-),D项正确。]
5.B [向10 mL浓度均为0.1 mol·L-1的NaOH和Na2CO3混合溶液中滴加0.1 mol·L-1盐酸,依次发生反应:①H++OH-===H2O、②H++CO===HCO、③H++HCO===H2CO3。a点的溶液中加入盐酸的体积为5 mL,则溶液中溶质的物质的量之比为n(NaCl)∶n(NaOH)∶n(Na2CO3)=1∶1∶2,故溶液中离子浓度大小为c(Na+)>c(CO)>c(OH-)>c(Cl-)>c(H+),A项错误;b点的溶液pH=7,结合电荷守恒式:c(Na+)+c(H+)=c(OH-)+c(HCO)+2c(CO)+c(Cl-),可得c(HCO)+2c(CO)=c(Na+)-c(Cl-),故n(HCO)+2n(CO)=0.003 mol-n(Cl-),由题图知溶液pH=7时加入盐酸的体积大于20 mL,故n(Cl-)>0.002 mol,所以2n(CO)+n(HCO)<0.001 mol,B项正确;c点的溶液pH<7,是因为反应生成的H2CO3的电离能力大于HCO的水解能力,C项错误;若将0.1 mol·L-1的盐酸换成同浓度的醋酸,当滴至溶液的pH=7时,电荷守恒式为c(Na+)+c(H+)=c(OH-)+c(HCO)+2c(CO)+c(CH3COO-),则c(Na+)≠c(CH3COO-),D项错误。]
6.A
7.C [b点代表加入12.5 mL HX溶液,此时恰好反应转化为NaX溶液,溶液显碱性,所以浓度为c(Na+)>c(X-)>c(OH-)>c(H+),A项错误;d点代表加入25 mL HX 溶液,所以溶液为HX和NaX浓度相等的混合溶液,此溶液存在电荷守恒:c(H+)+c(Na+)=c(X-)+c(OH-),物料守恒:c(Na+)=c(HX)+c(X-),两式联立消去c(Na+)得到:c(HX)+2c(H+)=c(X-)+2c(OH-),B、D项错误;选取图中的c点数据进行运算,c点代表向25 mL 0.1 mol·L-1 NaOH溶液中逐滴滴加13 mL 0.2 mol·L-1的一元酸HX溶液,溶液总体积为38 mL,此时溶液显中性,pH=7,所以c(H+)=1×10-7 mol·L-1;溶液中c(Na+)=0.1 mol·L-1×,c(HX)+c(X-)=0.2 mol·L-1×。因为溶液显中性,根据电荷守恒得到c(X-)=c(Na+),所以c(HX)=mol·L-1,故Ka===2.5×10-6,C项正确。]
8.C
9.(1)HB-只能电离,不能水解 (2)AC
10.(1)减小 NH3·H2ONH+OH-,加入硫酸铵后NH浓度增大,平衡逆向移动,使得OH-浓度减小,从而使pH减小
(2)< NH+H2ONH3·H2O+H+ c(NH)>c(SO)>c(H+)>c(OH-)
(3)= 1.76×10-5
(4)c2(OH-)=4.4×10-7,Qc=4.4×10-9<Ksp,无沉淀生成。
解析 (1)氨水中存在电离平衡:NH3·H2ONH+OH-。加入少量硫酸铵固体,c(NH)增大,平衡逆向移动,c(OH-)减小,pH将减小。(2)pH=1的硫酸溶液中c(H+)=0.1 mol·L-1,H+浓度与氨水浓度相等,体积相同,所以恰好反应生成硫酸铵,但由于硫酸铵是强酸弱碱盐,NH水解使溶液呈酸性,pH<7;如果NH不水解,c(NH)∶c(SO)=2∶1,但水解是较弱的,所以c(NH)>c(SO);溶液呈酸性,所以c(H+)>c(OH-)。(3)向氨水中加入0.05 mol·L-1稀硫酸至溶液正好呈中性,则根据电荷守恒有c(NH)+c(H+)=c(OH-)+2c(SO),所以c(NH)=2c(SO)。因混合溶液中c(NH)=176c(NH3·H2O),NH3·H2O的电离常数Kb==1.76×10-5。(4)由(3)可知,NH3·H2O的电离常数Kb=1.76×10-5,因氨水中c(OH-)≈,故混合后c2(OH-)≈×0.10×1.76×10-5=4.4×10-7,10 mL 0.02 mol·L-1的CaCl2溶液中c(Ca2+)=0.02 mol·L-1,混合后c(Ca2+)=0.01 mol·L-1,则Qc=c(Ca2+)·c2(OH-)=0.01×4.4×10-7=4.4×10-9
查看更多