- 2021-08-23 发布 |
- 37.5 KB |
- 9页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2018-2019学年河南省辉县市一中高二(普通班)上学期第一次阶段性考试化学试题 Word版
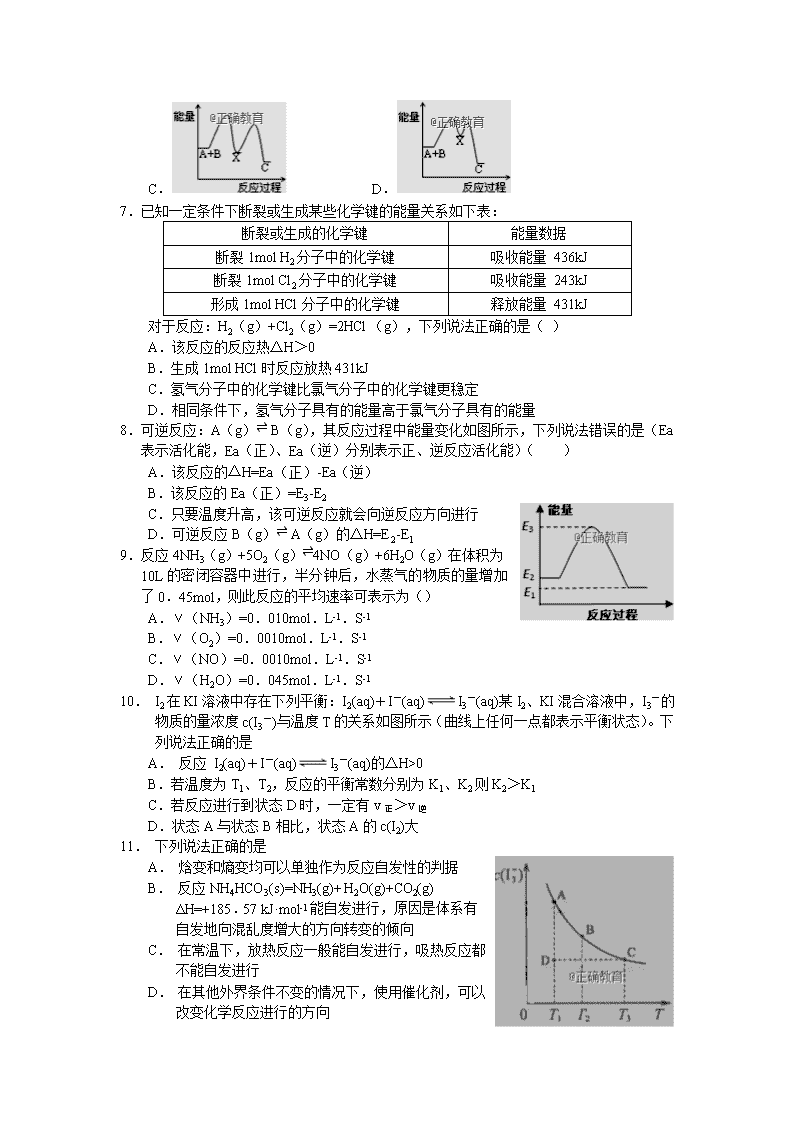
辉县市一中2018——2019学年上期第一次阶段性考试 高二化学试卷 命题人:杨彬蔚 本试卷分选择题和非选择题两部分,时间90分钟,满分100分。 可能用到的相对原子质量: H—1 B—11 C—12 N—14 O—16 S—32 Ba—137 第Ⅰ卷(选择题,共54分) 一、选择题(本题包括18小题,每小题3分,共54分,每题只有一个选项符合题意) 1.下列变化过程中一定不存在化学能与热能相互转化的是( ) A. 烧制陶瓷 B.干冰汽化 C.粮食酿酒 D.使用火药 2.下列变化属于吸热反应的是( ) ①液态水汽化 ②将胆矾加热变为白色粉末 ③浓硫酸稀释 ④氯酸钾分解制氧气 ⑤生石灰和水反应生成熟石灰 A. ①④⑤ B.①②④ C.①②③④ D.②④ 3.根据以下热化学方程式: 2H2S(g)+3O2(g)=2SO2(g)+2H2O(l) △H=-Q1 kJ·mol-1 2H2S(g)+O2(g)=S(s)+2H2O(l) △H=-Q2kJ·mol-1 2H2S(g)+O2(g)=S(s)+2H2O(g) △H=-Q3kJ·mol-1 判断Q1 Q2 Q3三者关系正确的是() A.Q1 > Q2 >Q3 B.Q1 > Q3 >Q2 C.Q3 > Q2 > Q1 D Q2 > Q1 > Q3 4.下列说法不正确的是() A.在25℃、101kPa下,1molS和2molS的燃烧热相等 B.已知反应H2S(g)+aO2(g)=X+cH2O(l)△H,若△H表示H2S的燃烧热,则X为SO2(g) C.由2H2(g)+O2(g)=2H2O(g)△H=-483.6kJ·mol-1可知,H2(g)的燃烧热为241.8kJ·mol-1 D.若将含0.5mol的浓硫酸与含1molNaOH的溶液混合,放出的热量大于57.3kJ 5.取少量0.1mol/L的NaHSO4溶液滴加到过量的Ba(OH)2稀溶液中,产生2.33g白色沉淀,同时放热590.0J,若已知:Ba(OH)2(aq)+2HCl(aq)=BaCl2(aq)+2H2O(l)△H=-114.6kJ·mol-1,则Na2SO4(aq)+Ba(NO3)2(aq)=BaSO4(s)+2NaNO3(aq)△H=( ) A.-532.7kJ·mol-1 B.-475.4kJ·mol-1 C.-55.6kJ·mol-1 D-1.7kJ·mol-1 6.反应A+B→C(△H>0)分两步进行:①A+B→X(△H<0),②X→C(△H>0). 下列示意图中,能正确表示总反应过程中能量变化的是( ) A. B. C. D. 7.已知一定条件下断裂或生成某些化学键的能量关系如下表: 断裂或生成的化学键 能量数据 断裂1mol H2分子中的化学键 吸收能量 436kJ 断裂1mol Cl2分子中的化学键 吸收能量 243kJ 形成1mol HCl分子中的化学键 释放能量 431kJ 对于反应:H2(g)+Cl2(g)=2HCl (g),下列说法正确的是( ) A.该反应的反应热△H>0 B.生成1mol HCl时反应放热431kJ C.氢气分子中的化学键比氯气分子中的化学键更稳定 D.相同条件下,氢气分子具有的能量高于氯气分子具有的能量 8.可逆反应:A(g)⇌ B(g),其反应过程中能量变化如图所示,下列说法错误的是(Ea表示活化能,Ea(正)、Ea(逆)分别表示正、逆反应活化能)( ) A.该反应的△H=Ea(正)-Ea(逆) B.该反应的Ea(正)=E3-E2 C.只要温度升高,该可逆反应就会向逆反应方向进行 D.可逆反应B(g)⇌ A(g)的△H=E2-E1 9.反应4NH3(g)+5O2(g)⇌4NO(g)+6H2O(g)在体积为10L的密闭容器中进行,半分钟后,水蒸气的物质的量增加了0.45mol,则此反应的平均速率可表示为() A.v(NH3)=0.010mol.L-1.S-1 B.v(O2)=0.0010mol.L-1.S-1 C.v(NO)=0.0010mol.L-1.S-1 D.v(H2O)=0.045mol.L-1.S-1 10. I2在KI溶液中存在下列平衡:I2(aq)+I-(aq)I3-(aq)某I2、KI混合溶液中,I3-的物质的量浓度c(I3-)与温度T的关系如图所示(曲线上任何一点都表示平衡状态)。下列说法正确的是 A. 反应 I2(aq)+I-(aq)I3-(aq)的△H>0 B.若温度为T1、T2,反应的平衡常数分别为K1、K2则K2>K1 C.若反应进行到状态D时,一定有v正>v逆 D.状态A与状态B相比,状态A的c(I2)大 11. 下列说法正确的是 A. 焓变和熵变均可以单独作为反应自发性的判据 B. 反应NH4HCO3(s)=NH3(g)+ H2O(g)+CO2(g) ΔH=+185.57 kJ·mol-1能自发进行,原因是体系有自发地向混乱度增大的方向转变的倾向 C. 在常温下,放热反应一般能自发进行,吸热反应都不能自发进行 D. 在其他外界条件不变的情况下,使用催化剂,可以改变化学反应进行的方向 12.在气体参与的反应中,能使反应物中活化分子数和活化分子百分数同时增大的方法( ) ①增大反应物浓度 ②升高温度 ③增大压强 ④移去生成物 ⑤加入催化剂 A. ①②③ B.①②③⑤ C.①②③④⑤ D.②⑤ 13.在一定温度下,可逆反应X(g)+2Y(g)⇌2Z(g)达到平衡的标志是() A.Z的生成速率与Y的生成速率相等 B.单位时间生成nmolX,同时生成2nmolY C.X、Y、Z的浓度相等 D.X、Y、Z的分子数之比为1:2:2 14.某温度下,在恒容密闭容器中充入NO2,发生反应2NO2(g)⇌N2O4(g) △H<0,达到平衡后,下列说法不正确的是() A. 再充入少量NO2,达平衡后NO2的转化率升高 B.再充入少量NO2,达平衡后NO2的体积分数增大 C.再充入少量N2O4,达平衡后NO2的体积分数减少 D.升高温度,体系的颜色加深 15.2SO2(g)+O2(g)⇌2SO3(g)是工业制硫酸的主要反应之一。一定温度下,在甲、乙、丙三个容积均为2L的恒容密闭容器中投入SO2(g)和O2(g),其起始物质的量及SO2的平衡转化率如下表所示。 甲 乙 丙 起始物质的量 n(SO2)/mol 0.4 0.8 0.8 n(O2)/mol 0.24 0.24 0.48 SO2的平衡转化 率/% 80 α1 α2 下列判断中,正确的是( ) A.甲中反应的平衡常数小于乙 B.该温度下,平衡常数值为400 C.平衡时,丙中c(SO3)是甲中的2倍 D.平衡时,甲中O2的转化率大于乙中O2的转化率 16.下列叙述中,不能用勒夏特列原理解释的是( ) A.红棕色的,加压后颜色先变深后变浅 B.高压比常压更有利于合成SO3的反应 C.由H2、I2(g)、HI(g)气体组成的平衡体系压缩体积后颜色变深 D.实验室用排饱和食盐水的方法收集氯气 17.一定条件下存在反应:H2(g)+I2(g)=2HI(g) △H<0,现有三个相同的1L恒容密闭容器Ⅰ、Ⅱ、Ⅲ,在Ⅰ中充入1molH2和1molI2(g),在Ⅱ中充入2molHI(g),在Ⅲ中充入2molH2和2molI2(g),700℃条件下开始反应。达到平衡时,下列说法不正确的是() A.容器Ⅰ、Ⅱ中气体的总物质的量始终不变 B.容器Ⅰ、Ⅲ中反应的平衡常数相同 C.容器Ⅰ中的气体颜色比容器Ⅱ中的气体颜色相同 D.容器Ⅰ中H2的转化率与容器Ⅱ中HI的转化率之和大于1 18.在恒压密闭容器M(如图I)和恒容密闭容器N(如图II)中,分别加入1molA和1molB,起始时两容器的体积均为VL,发生如下反应并达到化学平衡状态:2A(?)+B(?)⇌xC(g) △H<0,平衡时M中A、B、C的物质的量之比为1:3:4 。下列判断正确的是( ) A.x=4 B.若N中气体的密度如图III所示,则A、B可能都是气态 C.若A、B均为气体,平衡时M中A的转化率小于N中的转化率 D.若A为气体,B为非气体,则平衡时M、N中C的物质的量相等 第Ⅱ卷(非选择题,共46分) 19.(10分) (1)1 mol C2H5OH(l)完全燃烧生成CO2(g)和H2O(l),放出1366.8 kJ热量,写出反应的热化学方程式: . (2)1.7 g NH3(g)发生催化氧化反应生成气态产物,放出22.67 kJ的热量,写出反应的热化学方程式:__________________________________________________ (3)将8.4g的气态高能燃料乙硼烷(B2H6)在氧气中燃烧,生成固态三氧化二硼和液态水,放出649.5 kJ热量,该反应的热化学方程式为 __________________________. 又已知:H2O(l)===H2O(g) ΔH=+44 kJ·mol-1,则11.2 L(标准状况)乙硼烷完全燃烧生成气态水时放出的热量是________kJ。 (4)利用如图所示装置测定中和热 ①图中明显有一处错误,请指出并改正___________. ②________(填“能”或“不能”)用Ba(OH)2 溶液和硫酸代替氢氧化钠溶液和盐酸进行中和热测定;测出的中和热数值 (填“偏大”或“偏小”). 20.(12分)工业合成氨反应为N2(g)+3H2(g) 2NH3(g),对其研究如下:在773 K时,分别将2 mol N2和6 mol H2充入一个固定容积为1L 的密闭容器中,随着反应的进行,气体混合物中n(H2)、n(NH3)与反应时间t的关系如下表; t/min 0 5 10 15 20 25 30 n(H2)/mol 6.00 4.50 3.60 3.30 3.03 3.00 3.00 n(NH3)/mol 0 1.00 1.60 1.80 1.98 2.00 2.00 (1) 前10min 中利用N2表示的反应速率为________ (2) 该温度下,此反应的平衡常数K=__________ (3)该温度下,若向同容积的另一容器中投入的N2、H2、NH3的浓度分别为 3 mol·L-1、3 mol·L-1、3 mol·L-1,则此时v逆_______v正(填“>”、“<”或“=”)。 (4) 该温度下,在上述平衡体系中再通入2molNH3,一段时间后,达到新的平衡。此时c(H2)____ 4.5mo1/L(填“>”、“<”或“=”)。 (5)由上表中的实验数据计算得到“浓度-时间”的关系可用下图中的曲线表示,表示c(N2)-t的曲线是______。在此温度下,若起始充入4 mol N2 和12 mol H2,则反应刚达到平衡时,表示c(H2)-t的曲线上相应的点为_______。 21. (12分)氮及其化合物在工农业生产、生活、航空航天等方面应用广泛。 (1)肼(N2H4)与O2反应的能量变化如图所示。 已知,N—H键、O=O键的键能分别为391kJ/mol、497kJ/mol,则E1=_______kJ/mol,N2H4(g)中N-N键的键能为____________。 (2)某温度下,在1L恒容密闭容器中投入2mol N2H4(g)和lmolN2O4(g),发生反应:2 N2H4(g)+ N2O4(g)3N2(g) +4H2O (g) △H=-1097kJ/mol,该反应中 N2以平均反应速率为0.06mol/(L·min)进行10min时达到平衡状态。 ①下列叙述能说明反应达到平衡状态的是________。 A.c(N2):c(H2O)=3:4 B.混合气体密度保持不变 C.混合气体平均相对分子质量保持不变 D.混合气体中N2体积分数保持不变 ②平衡时,为___________,混合气体的平均摩尔质量为___________(保留一位小数)。 ③甲、乙是体积相同的恒容密闭容器,起始投入N2H4(g)和N2O4(g)的量相同,甲在恒温条件下达到平衡,乙在绝热条件下达到平衡。平衡时,N2H4(g)的转化率较大的是_____(填 “甲”或“乙”) 22.(12分)向体积为2L的密闭容器中通入3mol X气体,在一定温度下发生反应: 2X(g)⇌Y(g)+3Z(g)。 (1)经5 min后反应达到平衡,此时测得容器内的压强为起始时的1.2倍, 则用Y表示的速率为_________________ mol/(L·min)。 (2)若向达到(1)的平衡体系中充入氦气使压强增大到原来的3倍,则平衡向____________ (填"左"或"右"或"不)移动。 (3)若在相同条件下向达到(1)所述的平衡体系中再充入0.5molX气体 , 则(1)的平衡中X的转化率______________________ (填“大于”或“等于”或“小于”)再充入0.5molX气体,平衡后X 的转化率。 (4)若保持温度和压强不变,起始时加入X、Y、Z 物质的量分别为a mol、b mol、c mol, 达到平衡时仍与(1)的平衡等效,则a 、b 、c 应该满足的关系为 . (5)若保持温度和体积不变,起始时加入X、Y、Z 物质的量分别为a mol、b mol、c mol, 达到平衡时仍与(1)的平衡等效,且起始时维持化学反应向逆反应方向进行,则c的取值范围应该为_________________________. (6)若向体积为2L的恒容密闭的绝热容器中通入3molX,发生上述反应,平衡后压强为原来的3倍,则可能的原因为 . 辉县市一中2018——2019学年上期第一次阶段性考试 高二化学试卷 参考答案 1—5BDACD 6—10ACCCC 11—15BDABB 16—18CDD 19.(1) (2) (3) 1016.5 (4)①使用铜制搅拌棒,应改用环形玻璃搅拌棒; ②不能 偏大 20.(1)V(N2)=0.08mol·L-1·min-1 (2) (3) < (4)< (5)乙 (6)B 【解析】(1)前10min中生成氨气是1.6mol,消耗氮气是0.8mol,浓度是0.8mol/L,则用N2表示的反应速率为0.8mol/L÷10min=0.08mol·L-1·min-1;(2)平衡时生成氨气是2mol,消耗氮气是1mol,剩余氮气是1mol,因此该温度下,此反应的平衡常数K=;(3)该温度下,若向同容积的另一容器中投入的N2、H2、NH3的浓度分别为3 mol·L-1、3 mol·L-1、3 mol·L-1,则此时浓度熵是<4/27,平衡向正反应方向进行,则v正>v逆。(4)如果平衡时氢气是4.5mo1/L,则又消耗氨气是1mol/L,氨气浓度是3mol/L,氮气的浓度是2.5mol/L,此时<4/27,所以平衡时氢气的浓度必须小于4.5mo1/L;(5)由反应方程式可知变化量之比等于对应物质的化学计量数之比,而△n甲:△n乙:△n丙=3:1:2,所以表示c(N2)~t的曲线是乙;在此温度下,若起始充入4molN2和12molH2,相当于在原来基础上增加压强,平衡正向移动,所以比原平衡的两倍小,而且达平衡的时间缩短,则应是点B. 21.(1)2218 157 (2)① C D ② 1 41.1 ③甲 22.(1)0.03 (2)不 (3)大于 (4) (5)0.9<c ≤ 4.5 (6)反应为放热反应,容器内温度升高 【解析】(1)压强之比等于气体的物质的量之比,则可一句三段式计算。设反应生成Y的物质的量为a 起始 3mol 0 0 转化 2a a 3a 平衡 3-2a a 3a 所以 则: (2)等温等容条件下通入一中惰性气体,反应体系中的各组分的浓度没有改变,平衡不移动; (3)若在等温等压条件下通入X气体,则与原平衡状态互为等效平衡,转化率不变,但此时相当于压缩平衡体系的体积平衡会逆向移动,故X的转化率减少;、 (4)温度和压强不变的等效平衡,满足物质的量成比例,即,对于只需要即可; (5)极限思想,将X全部转化至方程式右边,得到Z,即若要满足等温等体积的等效平衡,则C的最大值为4.5而(1)平衡时,Z的物质的量为,如果要求反应逆向进行,则C必须大于0.9。查看更多