- 2021-08-23 发布 |
- 37.5 KB |
- 48页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020届二轮复习水溶液中的离子平衡课件(48张)(广西专用)
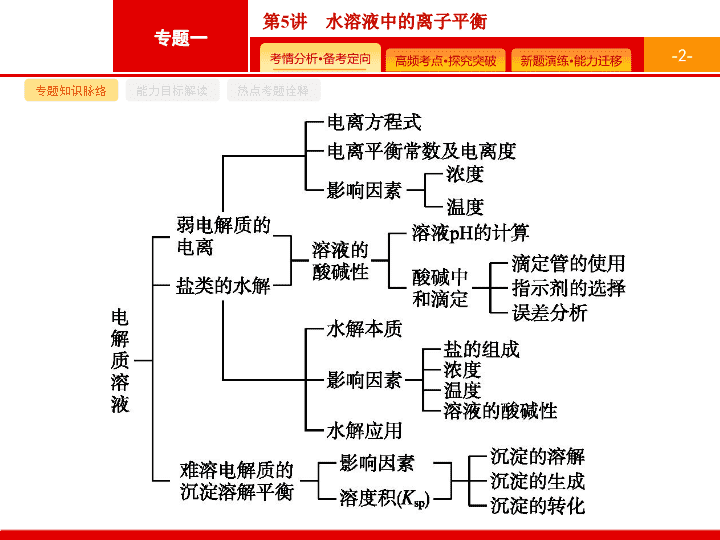
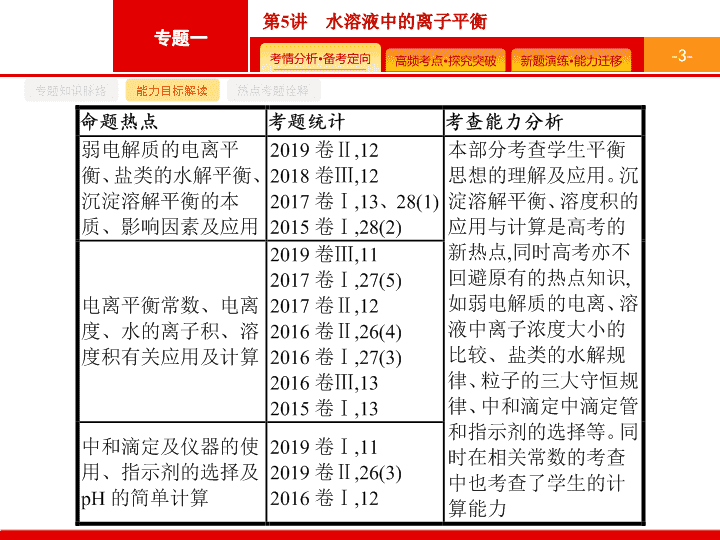
第 5 讲 水溶液中的离子平衡 - 2 - 专题知识脉络 能力目标解读 热点考题诠释 - 3 - 专题知识脉络 能力目标解读 热点考题诠释 - 4 - 专题知识脉络 能力目标解读 热点考题诠释 1 .(2019 全国 Ⅰ )NaOH 溶液滴定邻苯二甲酸氢钾 ( 邻苯二甲酸 H 2 A 的 K a1 =1.1×10 -3 , K a2 =3.9×10 -6 ) 溶液 , 混合溶液的相对导电能力变化曲线如图所示 , 其中 Q 点为反应终点。下列叙述错误的是 ( ) A. 混合溶液的导电能力与离子浓度和种类有关 B.Na + 与 A 2- 的导电能力之和大于 HA - 的 C. Q 点的混合溶液 pH=7 D. M 点的混合溶液中 , c (Na + )> c (K + )> c (OH - ) C - 5 - 专题知识脉络 能力目标解读 热点考题诠释 解题要领 随着 NaOH 溶液的加入 , 混合溶液中离子浓度和种类发生变化 , 因此混合溶液的导电能力与离子浓度和种类有关 ,A 项正确 ; P 点的混合溶液中能导电的离子主要为 HA - 和 K + , Q 点为反应终点 , 因此 Q 点的混合溶液中能导电的离子主要为 A 2- 、 K + 、 Na + , 故 Na + 与 A 2- 的导电能力之和大于 HA - 的 ,B 项正确 ; Q 点的混合溶液中含有的 A 2- 能发生水解反应而使溶液呈碱性 ,C 项错误 ; Q 点为反应终点 , 因此 Q 点的混合溶液中 c (Na + )= c (K + )> c (OH - ), 继续加入氢氧化钠溶液后 , M 点的混合溶液中 c (Na + )> c (K + )> c (OH - ),D 项正确。 - 6 - 专题知识脉络 能力目标解读 热点考题诠释 2 .(2018 全国 Ⅲ ) 用 0.100 mol·L -1 AgNO 3 溶液滴定 50.0 mL 0.050 0 mol·L -1 Cl - 溶液的滴定曲线如图所示。下列有关描述错误的是 ( ) A. 根据曲线数据计算可知 K sp (AgCl) 的数量级为 10 -10 B. 曲线上各点的溶液满足关系式 c (Ag + )· c (Cl - )= K sp (AgCl) C. 相同实验条件下 , 若改为 0.040 0 mol·L -1 Cl - 溶液 , 反应终点 C 移到 A D. 相同实验条件下 , 若改为 0.050 0 mol·L -1 Br - 溶液 , 反应终点 C 向 B 方向移动 C - 7 - 专题知识脉络 能力目标解读 热点考题诠释 解题要领 相同实验条件下 , 若改为 0.040 0 mol · L -1 Cl - 溶液 , 恰好反应时 ,0.040 0 mol · L -1 ×50.0 mL=0.100 mol · L -1 ·V , V =20 mL, 故反应终点横坐标应为 20,C 项描述错误 ; 相同实验条件下 , 若改为 0.050 0 mol · L -1 Br - 溶液 , 反应终点横坐标不变 , 由于 K sp (AgCl)> K sp (AgBr), 故反应终点纵坐标变大 , 故 D 项描述正确。 - 8 - 专题知识脉络 能力目标解读 热点考题诠释 3 .(2017 全国 Ⅱ ) 改变 0.1 mol·L -1 二元弱酸 H 2 A 溶液的 pH, 溶液中 H 2 A 、 HA - 、 A 2- 的物质的量分数 δ (X) 随 pH 的变化如图所示 [ 已知 下列叙述错误的是 ( ) A.pH=1.2 时 , c (H 2 A)= c (HA - ) B.lg[ K 2 (H 2 A)]=-4.2 C.pH=2.7 时 , c (HA - )> c (H 2 A)= c (A 2- ) D.pH=4.2 时 , c (HA - )= c (A 2- )= c (H + ) D - 9 - 专题知识脉络 能力目标解读 热点考题诠释 - 10 - 专题知识脉络 能力目标解读 热点考题诠释 4 .(2017 全国 Ⅲ ) 在湿法炼锌的电解循环溶液中 , 较高浓度的 Cl - 会腐蚀阳极板而增大电解能耗。可向溶液中同时加入 Cu 和 CuSO 4 , 生成 CuCl 沉淀从而除去 Cl - 。根据溶液中平衡时相关离子浓度的关系图 , 下列说法错误的是 ( ) C - 11 - 专题知识脉络 能力目标解读 热点考题诠释 - 12 - 命题热点一 命题热点二 命题热点三 命题热点四 弱电解质的电离平衡 有关弱电解质电离解题的思维路径 - 13 - 命题热点一 命题热点二 命题热点三 命题热点四 问题探究 1 . 如何判断一元强酸与一元弱酸 ? - 14 - 命题热点一 命题热点二 命题热点三 命题热点四 2 . 怎样设计实验证明 HA( 一元酸 ) 是否为弱电解质 ? (1) 设计的基本思路 : 判断 HA 是否为弱电解质 ( 或弱酸 ) 的基本思路有两种 : 一种是直接根据 HA 本身或其强碱盐的性质进行相应的实验设计 ( 简称直接设计 ), 二是选择一种已知的强酸进行对照性实验设计 ( 简称对照设计 ) 。 (2) 直接设计 ( 以 HA 溶液为例 ): ① 若已知 c (HA), 测定其 pH, 若 pH>-lg c (HA), 则 HA 是弱酸。 ② 向 HA 溶液中加入该酸对应的钠盐晶体 , 测定加入晶体后溶液的 pH 有无变化 , 若 pH 变大 , 则 HA 为弱酸。 ③ 若 c (HA) 未知 , 先测量 HA 溶液的 pH( 设其为 a ), 然后将该溶液稀释至原体积的 100 倍 , 再测定稀释后的 pH, 若 pH< a +2, 则 HA 为弱酸。 ④ 测 NaA 溶液的 pH, 若 pH>7, 或加入酚酞溶液后溶液变红 , 则 HA 是弱酸。 - 15 - 命题热点一 命题热点二 命题热点三 命题热点四 (3) 对照设计 : ① 选用相同物质的量浓度的盐酸作参照物质进行对照实验。 a. 比较两者导电性强弱 , 若 HA 溶液导电能力弱 , 则 HA 为弱酸。 b. 比较相同条件下与某种较活泼的金属单质的反应情况 , 若反应过程中产生气体速率 HA 的较慢 , 则为弱酸。 ② 选用 pH 相同的盐酸作参照物。 a. 将两种酸稀释至原体积的相同倍数 ( 不低于 100 倍 ) 后 , 比较溶液 pH 的相对大小 , 若 HA 的小 , 则为弱酸。 b. 取相同体积的两种酸用碱进行滴定 , 完全反应时 , 若 HA 消耗的碱较多 , 则为弱酸。 c. 比较两种酸与某种较活泼的金属单质的反应情况 , 若反应过程中产生气体速率 HA 较快 , 则为弱酸。 d. 将等体积的两种酸分别与足量的某种较活泼的金属单质反应 , 若 HA 最终生成的气体较多 , 则 HA 是弱酸。 - 16 - 命题热点一 命题热点二 命题热点三 命题热点四 例 1 25 ℃ 时 , 用浓度为 0.100 0 mol·L -1 的 NaOH 溶液滴定 20.00 mL 浓度均为 0.100 0 mol·L -1 的三种酸 HX 、 HY 、 HZ 的溶液 , 滴定曲线如图所示。下列说法正确的是 ( ) A. 在相同温度下 , 同浓度的三种酸溶液的导电能力顺序 : HZ查看更多