- 2021-08-23 发布 |
- 37.5 KB |
- 17页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
高考化学考点12 离子的检验与推断
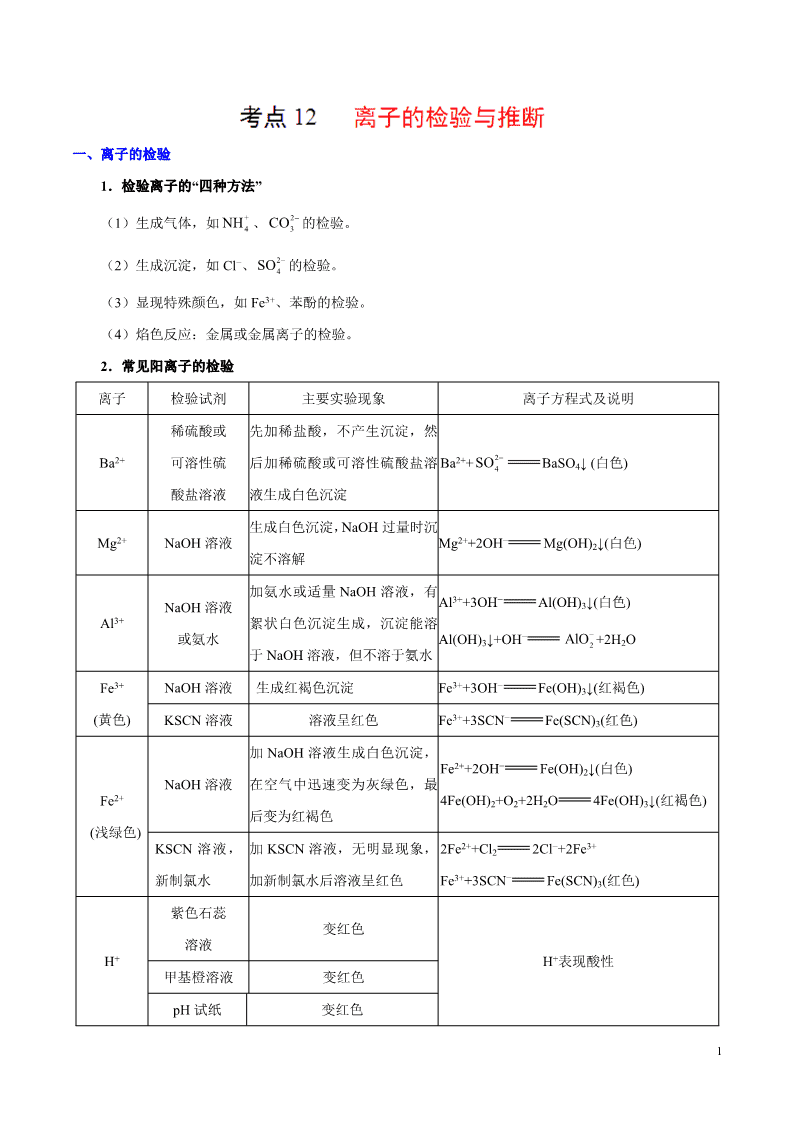
1 一、离子的检验 1.检验离子的“四种方法” (1)生成气体,如 、 的检验。 (2)生成沉淀,如 Cl−、 的检验。 (3)显现特殊颜色,如 Fe3+、苯酚的检验。 (4)焰色反应:金属或金属离子的检验。 2.常见阳离子的检验 离子 检验试剂 主要实验现象 离子方程式及说明 Ba2+ 稀硫酸或 可溶性硫 酸盐溶液 先加稀盐酸,不产生沉淀,然 后加稀硫酸或可溶性硫酸盐溶 液生成白色沉淀 Ba2++ BaSO4↓ (白色) Mg2+ NaOH 溶液 生成白色沉淀,NaOH 过量时沉 淀不溶解 Mg2++2OH− Mg(OH)2↓(白色) Al3+ NaOH 溶液 或氨水 加氨水或适量 NaOH 溶液,有 絮状白色沉淀生成,沉淀能溶 于 NaOH 溶液,但不溶于氨水 Al3++3OH− Al(OH)3↓(白色) Al(OH)3↓+OH− +2H2O NaOH 溶液 生成红褐色沉淀 Fe3++3OH− Fe(OH)3↓(红褐色)Fe3+ (黄色) KSCN 溶液 溶液呈红色 Fe3++3SCN− Fe(SCN)3(红色) NaOH 溶液 加 NaOH 溶液生成白色沉淀, 在空气中迅速变为灰绿色,最 后变为红褐色 Fe2++2OH− Fe(OH)2↓(白色) 4Fe(OH)2+O2+2H2O 4Fe(OH)3↓(红褐色)Fe2+ (浅绿色) KSCN 溶液, 新制氯水 加 KSCN 溶液,无明显现象, 加新制氯水后溶液呈红色 2Fe2++Cl2 2Cl−+2Fe3+ Fe3++3SCN− Fe(SCN)3(红色) 紫色石蕊 溶液 变红色 甲基橙溶液 变红色 H+ pH 试纸 变红色 H+表现酸性 + 4NH 2 3CO 2 4SO 2 4SO 2AlO 2 锌粒 生成无色气体 Zn+2H+ Zn2++H2↑ NaOH 溶液 加 NaOH 溶液,有蓝色沉淀生 成,若加热则沉淀变黑 Cu2++2OH− Cu(OH)2↓(蓝色) Cu(OH)2 CuO(黑色)+H2OCu2+ (蓝色) H2S( 或 Na2S 溶液) 生成黑色沉淀 Cu2++H2S 2H++CuS↓(黑色) Ag+ 稀盐酸或氯化 物溶液,稀硝 酸 生成白色沉淀,不溶于稀硝酸 Ag++Cl− AgCl↓ (白色) NaOH 溶液 加 NaOH 溶液,加热并用湿润 的红色石蕊试纸检验产生的气 体,试纸变蓝 +OH− NH3↑+H2O Na+ 火焰呈黄色 K+ 焰色反应 火焰呈紫色(透过蓝色钴玻璃 片) 焰色反应属于物理现象 3.常见阴离子的检验 离子 检验试剂或方法 实验现象 反应方程式及说明 OH− ①取少量试液于试管中,向其中滴 加紫色石蕊溶液(或酚酞试液); ②用玻璃棒蘸取少量试液滴于红色 石蕊试纸上 ①紫色石蕊溶液变蓝(或酚酞 试液变红); ②红色石蕊试纸变蓝 Cl− 取少量试液于试管中,向其中滴加 少量 AgNO3 溶液,再加入稀硝酸 生成白色沉淀,且不溶于稀硝 酸 Ag++Cl− AgCl↓ Br− 取少量试液于试管中,向其中滴加 少量 AgNO3 溶液,再加入稀硝酸 生成浅黄色沉淀,且不溶于稀 硝酸 Ag++Br− AgBr↓ I− ①取少量试液于试管中,向其中滴 加少量 AgNO3 溶液,再加入稀硝酸; ②滴入淀粉溶液后再滴入氯水 ①生成黄色沉淀,且不溶于稀 硝酸; ②溶液显蓝色 ①Ag++I− AgI↓ ②2I−+Cl2 2Cl−+I2,淀粉遇碘 变蓝色 + 4NH + 4NH 3 氯化钡溶液、稀硝酸 生成白色沉淀,加稀硝酸后白 色沉淀溶解,产生无色无味气 体 Ba2++ BaCO3↓ BaCO3+2H+ Ba2++ CO2↑+H2O 氯化钡溶液、稀盐酸 不生成沉淀,加稀盐酸,产生 无色无味气体 +H+ CO2↑+H2O 氯化钡溶液、盐酸、品红溶液 先生成白色沉淀,加盐酸后白 色沉淀溶解,将生成的气体通 入品红溶液中,溶液褪色 Ba2++ BaSO3↓ BaSO3+2H+ Ba2++ SO2↑+H2O 取少量试液于试管中,向其中加入 足量稀盐酸后,再加入 BaCl2 溶液 加入盐酸不产生沉淀,加入 BaCl2 溶液后生成白色沉淀 Ba2++ BaSO4↓ 加热浓缩溶液,加入浓硫酸和铜片 有红棕色的气体产生,溶液变 蓝色 Cu+4H++2 Cu2++2NO2↑+2H2O S2− ①稀硫酸或盐酸; ②Pb(NO3)2 溶液、稀硝酸 ①生成无色有臭鸡蛋气味的 气体; ②生成黑色沉淀,且不溶于稀 硝酸 ①S2−+2H+ H2S↑ ②S2−+Pb2+ PbS↓(黑色) 二、离子的推断 1.离子推断题的解题思路 该考点主要以选择题及填空题的形式出现,离子推断可以把实验操作、离子反应、离子共存、离子检 验、电荷守恒等知识综合起来考查,是综合性较强的题目。其一般解题思路为 必须注意两点:(1)所加试剂引入的离子对后续实验的影响;(2)用电荷守恒判断溶液中还可能含 有的离子时要将定性与定量的方法相结合。 2.离子推断题的解题原则 (1)互斥性原则。利用题给条件判断出一定存在某种离子时,可将不能与之共存的离子排除掉,从而 判断出一定没有哪种离子。 2 3CO 2 3CO 3HCO 3HCO 2 3SO 2 3SO 2 4SO 2 4SO 3NO 3NO 4 (2)电中性原则。任何溶液中,阴、阳离子所带电荷总数是守恒的,即溶液呈电中性。这个隐含条件 往往被忽略,从而造成漏选或错选。如题中各种阳离子一一被排除后,根据电中性原则,最后剩余的那种 阳离子肯定存在;反之,阴离子亦然。 (3)进出性原则。在进行离子检验时,往往要加入试剂,这样就会引入新的离子,原溶液中是否存在 该种离子就无法判断,如加入过量 BaCl2 溶液时,过量的 Ba2+、Cl−将影响对原溶液中是否有 Ba2+或 Cl−的判 断;还有一些离子会随实验过程的变化而消失(如原溶液中的 在酸性条件下转化为 Al3+),可能对后续 的检验产生影响。 (4)推断结果时应从三个方面考虑:肯定存在的离子,肯定不存在的离子,不能判定存在与否的离子。 并且这三个方面是相互独立的,任何一种离子只能出现一次,不能重复出现。 考向一 离子检验 典例 1 下列关于物质或离子检验的叙述正确的是 A.在溶液中加 KSCN,溶液显红色,证明原溶液中有 Fe3+,无 Fe2+ B.气体通过无水硫酸铜,粉末变蓝,证明原气体中含有水蒸气 C.灼烧白色粉末,火焰呈黄色,证明原粉末中有 Na+,无 K+ D.将气体通入澄清石灰水,溶液变浑浊,证明原气体是 CO2 【答案】B 2AlO 5 1.向四支试管中分别加入少量不同的无色溶液进行如下操作,结论正确的是 操作 现象 结论 A 滴加 BaCl2 溶液 生成白色沉淀 原溶液中有 B 滴加氯水和 CCl4,振荡、静置 下层溶液显紫色 原溶液中有 I− C 用洁净铂丝蘸取溶液进行焰色反应 火焰呈黄色 原溶液中有 Na+,无 K+ D 滴加稀 NaOH 溶液,将湿润红色石蕊试 纸置于试管口 试纸不变蓝 原溶液中无 离子检验简答题的答题模板 考向二 离子推断 典例 1 有一混合物的水溶液,可能含有以下离子中的若干种:K+、 、Cl−、Mg2+、Fe3+、 、 ,现取三份各 100 mL 溶液进行如下实验: ①向第一份中加入 AgNO3 溶液,有白色沉淀产生; ②向第二份中加入足量 NaOH 溶液后加热,收集到气体 0.896 L(标准状况); ③向第三份中加入足量 BaCl2 溶液,得到沉淀 6.27 g,沉淀经足量盐酸洗涤后,剩余 2.33 g。 试回答下列问题: (1)肯定存在的离子有 ,肯定不存在的离子有 。 (2)可能存在的离子是 ,为确定该离子是否存在,可取少许原溶液,然后 (填实验 2 4SO 4NH + 4NH 2 3CO 2 4SO 6 操作)。 (3)试分别确定肯定存在的离子在原溶液中各自的物质的量浓度 。 【思路分析】应思考题目给出 n( )、n( )和 n( )的具体数值,其用意是什么?为了弄清该数 据隐含的信息,我们应联想到“任何溶液都必须呈电中性”来加以验证。 【答案】(1) 、 、 、K+ Mg2+、Fe3+ (2)Cl− 加入足量的稀硝酸和硝酸钡溶液,过滤,向滤液中滴入 AgNO3 溶液,若有白色沉淀生成, 则证明有 Cl−存在,否则不存在 (3)c( )=0.1 mol/L,c( )=0.2 mol/L,c( )=0.4 mol/L,c(K+)≥0.2 mol/L &网 2.有一无色透明溶液,欲确定是否含有下列离子:K+、Mg2+、Al3+、Fe2+、Ba2+、 、 、Cl−、I−、 。取该溶液进行实验: 实验步骤 实验现象 ①取少量该溶液,测定溶液 pH pH=0 ②取少量该溶液加热浓缩,加 Cu 片和浓 H2SO4, 加热 有无色气体产生,气体遇空气变成红棕色 + 4NH 2 4SO 2 3CO + 4NH 2 3CO 2 4SO 2 4SO 2 3CO + 4NH 3NO 2 4SO 3HCO 7 ③取少量该溶液,加少量 BaCl2 溶液 有白色沉淀 ④取③中上层清液,加足量 AgNO3 溶液 有白色沉淀,且不溶于稀 HNO3 ⑤取少量该溶液,加 NaOH 溶液 有白色沉淀,NaOH 过量时沉淀部分溶解 由此判断: (1)溶液中肯定不存在的离子是 , 溶液中肯定存在的离子是 。 (2)请设计实验验证其中可能存在的阴离子的方法(写明操作、现象、结论): 。 离子推断的四项基本原则 1.下列离子在未知溶液中的检验方法正确的是 8 选项 离子 检验方法 A 向样品中加入足量盐酸,将生成的无色无味的气体通入澄清石灰水中,观 察溶液是否变浑浊 B 向样品中先加入稀硝酸酸化,再滴加氯化钡溶液,观察是否有白色沉淀生 成 C Fe2+ 取少量溶液于试管中,加入酸性高锰酸钾溶液,观察溶液紫色是否褪去 D I- 取少量溶液于试管中,加入新制氯水,再加入淀粉溶液,观察溶液是否变 蓝色 2.有一无色溶液,可能含有 K+、Al3+、Mg2+、 、Cl-、 、 、 中的几种。为确定其 成分,做如下实验:①取部分溶液,加入适量 Na2O2 固体,产生无色无味的气体和白色沉淀,再加入足 量的 NaOH 溶液后白色沉淀部分溶解;②另取部分溶液,加入 HNO3 酸化的 Ba(NO3)2 溶液,有白色沉淀 产生,无气体生成。下列推断正确的是 A.肯定有 Al3+、Mg2+、 B.肯定有 Al3+、Mg2+ C.肯定没有 、 、 、K+ D.能确定 K+、Cl-是否存在 3.根据下列实验内容得出的结论正确的是 选项 实验内容 结论 A 某物质的水溶液能使红色石蕊试纸变蓝 该物质中一定含有 OH-,而且一定是碱 B 向废液中加入少量的葡萄糖溶液,无砖红 色沉淀产生 废液中不含 Cu2+ C 向某物质的水溶液中加入盐酸能产生无 色无味气体 该溶液中一定含有 D 向某溶液中滴加 NaOH 溶液,先产生白 色沉淀,后沉淀溶解 该溶液中可能含有 Al3+ 4.某同学为检验溶液中是否含有常见的几种无机离子,进行了如图所示的实验操作,其中检验过程中产生 2 3CO 2 4SO + 4NH 2 4SO 3HCO 4MnO 3HCO 3HCO 4MnO + 4NH 2 3CO 9 的气体能使湿润的红色石蕊试纸变蓝。由该实验能得到的正确结论是 A.原溶液中一定含有 B.原溶液中一定含有 C.原溶液中一定含有 Cl- D.原溶液中一定含有 Fe3+ 5.某溶液只可能含有以下离子中的若干种:H+、 、K+、Mg2+、 、 、 ,现取两份 200 mL 溶液进行如下实验:(已知 HNO2 不稳定极易分解:2HNO2 H2O+NO2↑+NO↑) ①向第一份溶液中加足量 AgNO3 溶液后,有 11.68 g 白色沉淀产生,向沉淀中加入足量稀盐酸充分反应, 有棕色气体产生,沉淀颜色不变,但是质量减少 0.2 g;②将产生的气体全部通入过量的澄清石灰水,又 得到白色沉淀 2.0 g,该沉淀能溶于稀盐酸产生无色气体;③向第二份溶液中加入过量浓 NaOH 溶液,加 热使产生的气体全部放出,用 100 mL 0.5 mol·L−1 的稀硫酸恰好完全吸收,酸也无剩余。 根据上述实验,以下推测不正确的是 A.原溶液中一定不存在较大浓度的 H+、Mg2+ B.原溶液确定含 、 、 ,且物质的量之比为 5∶2∶1 C.不能确定原溶液是否含有 K+、 D.实验中产生的红棕色气体遇空气颜色会加深 6.某无色溶液中可能存在的离子如下:Na+、Ag+、Ba2+、Al3+、 、Fe3+、S2−、 、 、 , 现取该溶液进行有关实验,结果如图所示。 下列判断正确的是 A.气体甲、乙、丙都是纯净物 B.淡黄色沉淀甲是 S,白色沉淀乙是 Al(OH)3,白色沉淀丙是 BaCO3 或 BaCO3 与 BaSO4 组成的混合物 C.Na+、S2−、 、Al3+一定存在于此无色溶液中 D.Ag+、Ba2+、 、Fe3+一定不存在于此无色溶液中 2 4SO + 4NH 4NH 2NO 2 3CO 3NO 4NH 2NO 2 3CO 3NO 2AlO 2 3CO 2 3SO 2 4SO 2 3SO 2AlO 10 7.有一未知的无色溶液,只可能含有以下离子中的若干种(忽略由水电离产生的 H+、OH-):H+、 、K +、Mg2+、Cu2+、Al3+、 、 、 ,现取三份 100 mL 溶液进行如下实验: ①第一份加足量 AgNO3 溶液后,有白色沉淀产生。 ②第二份加足量 BaCl2 溶液后,有白色沉淀产生,经洗涤、干燥后,沉淀质量为 6.99 g。 ③第三份逐滴滴加 NaOH 溶液,测得沉淀与 NaOH 溶液的体积关系如图。根据上述实验,以下推测不正 确的是 A.原溶液一定不存在 H+、Cu2+、 B.不能确定原溶液是否含有 K+、 C.实验所加的 NaOH 的浓度为 2 mol·L-1 D.原溶液确定含 Mg2+、Al3+、 ,且 n(Mg2+)∶n(Al3+)∶n( )=1∶1∶2 8.在 Na+浓度为 0.5 mol·L-1 的某澄清溶液中,还可能含有下表中的若干种离子。 阳离子 K+ Ag+ Mg2+ Ba2+ 阴离子 现取该溶液 100 mL 进行如下实验(气体体积均在标准状况下测定)。 序号 实验内容 实验结果 Ⅰ 向该溶液中加入足量稀盐酸 产生白色沉淀并放出标准状况下 0.56 L 气体 Ⅱ 将Ⅰ的反应混合液过滤,对沉淀洗涤、 灼烧至恒重,称量所得固体质量 固体质量为 2.4 g Ⅲ 向Ⅱ的滤液中滴加 BaCl2 溶液 无明显现象 请回答下列问题。 (1)实验Ⅰ能确定一定不存在的离子是________。 (2)实验Ⅰ中生成沉淀的离子方程式为_______________________________________。 + 4NH 3NO 2 3CO 2 4SO 2 3CO 3NO + 4NH + 4NH 3NO 2 3CO 2 3SiO 2 4SO 11 (3)通过实验Ⅰ、Ⅱ、Ⅲ和必要计算,填写下表中阴离子的浓度(能计算出的,填写计算结果,一定不 存在的离子填“0”,不能确定是否存在的离子填“?”)。 阴离子 c/mol·L-1 (4)判断 K+是否存在,若存在求其最小浓度,若不存在说明理由:______________。 9.1 L 某混合溶液,可能含有的离子如下表: 可能大量含有的阳离子 H+、K+、Mg2+、Al3+、 、Fe2+、Fe3+ 可能大量含有的阴离子 Cl-、Br-、I-、 、 (1)往该溶液中逐滴加入 NaOH 溶液,产生沉淀的物质的量(n)与加入 NaOH 溶液的体积(V)的关系如图 所示。则该溶液中一定不含有的离子是______________。 (2)BC 段离子方程式为_________________________________________________。 (3)V1、V2、V3、V4 之间的关系为________________________________________。 (4)经检测,该溶液中还含有大量的 Cl-、Br-、I-,若向 1 L 该混合溶液中通入一定量的 Cl2,溶液中 Cl-、Br-、I-的物质的量与通入 Cl2 的体积(标准状况)的关系如下表所示,分析后回答下列问题: Cl2 的体积(标准状况) 2.8 L 5.6 L 11.2 L n(Cl-) 1.25 mol 1.5 mol 2 mol n(Br-) 1.5 mol 1.4 mol 0.9 mol n(I-) a mol 0 0 ①当通入 Cl2 的体积为 2.8 L 时,溶液中发生反应的离子方程式为______________。 ②原溶液中 Cl-、Br-、I-的物质的量浓度之比为____________________________。 1.[2015·天津]下列关于物质或离子检验的叙述正确的是 A.在溶液中加 KSCN,溶液显红色,证明原溶液中有 Fe3+,无 Fe2+ B.气体通过无水硫酸铜,粉末变蓝,证明原气体中含有水蒸气 C.灼烧白色粉末,火焰成黄色,证明原粉末中有 Na+,无 K+ 3NO 2 3CO 2 3SiO 2 4SO + 4NH 2 3CO 2AlO 12 D.将气体通入澄清石灰水,溶液变浑浊,证明原气体是 CO2 1.【答案】B 错误;检验 应加入浓 NaOH 溶液,且需要加热,D 错误。 2.【答案】(1)Fe2+、 、I−、Ba2+ 、 、Mg2+、Al3+ (2)取少量原溶液加足量的硝酸钡溶液,过滤后,向滤液中加硝酸银溶液,有白色沉淀生成,再加稀硝 酸,白色沉淀不溶解,说明有 Cl−,反之则没有(答案合理即可) &网 【解析】根据无色透明溶液,则原溶液中无 Fe2+;根据实验①pH=0,呈酸性,则原溶液中无 ;根 据实验②中的现象,原溶液中含有 ,由于 (H+)具有强氧化性,则原溶液中无 I−;根据实验③, 原溶液中含 ,根据离子共存原则,则无 Ba2+;由于在实验③中加入的是 BaCl2,引入了 Cl−,无法证 明原溶液中是否有 Cl−;根据实验⑤原溶液中含有 Mg2+和 Al3+。综上所述,溶液中一定不存在 Fe2+、 、 I−、Ba2+,肯定存在 、 、Mg2+、Al3+,可能存在 K+、Cl−。 1.【答案】D 【解析】A 项, 会产生干扰,错误;B 项, 会产生干扰,错误;C 项,使酸性高锰酸钾溶液 褪色的不一定是 Fe2+,如 等,错误;D 项,氯气能把 I-氧化成 I2,淀粉遇碘变蓝,因此可以检验 I -的存在,正确。 2.【答案】B 3.【答案】D 变式拓展 4NH 3HCO 3NO 2 4SO 3HCO 3NO 3NO 2 4SO 3HCO 3NO 2 4SO 考点冲关 3HCO 2 3SO 2 3SO 13 【解析】显碱性的盐溶液也能使红色石蕊试纸变蓝,如 Na2CO3 溶液,A 项错误;若废液呈酸性,即使 含 Cu2+,加入少量的葡萄糖溶液也无砖红色沉淀产生,B 项错误;若该溶液中含有 ,加入盐酸也 能产生无色无味气体,C 项错误。 4.【答案】B 【解析】原溶液中加入硝酸钡和盐酸生成白色沉淀,原溶液中可能存在 、 或 Ag+,A 项错误; 加硝酸银溶液产生白色沉淀,可能是加入的盐酸引起的,C 项错误;加入 KSCN 溶液得到红色溶液,Fe3 +可能是由原溶液中的 Fe2+被 、H+氧化而来的,故原溶液中不一定含有 Fe3+,D 项错误;因检验 过程中产生的气体能使湿润的红色石蕊试纸变蓝,说明原溶液中一定含有 ,B 项正确。&网 5.【答案】C 6.【答案】B 【解析】第一步,根据肯定性原则:无色溶液中肯定没有 Fe3+,加过量氢溴酸产生气体,可能存在的离 子中能与 H+反应生成气体的有 S2−、 、 。第二步,根据互斥性原则:原溶液中肯定没有 Ag+、 Ba2+、Al3+。溶液中没有 Ag+但却产生淡黄色沉淀,排除 AgBr 沉淀,则淡黄色沉淀只能是硫,它是由 S2− 与 在酸性条件下反应生成的:2S2−+ +6H+ 3S↓+3H2O。当 n(S2−)∶n( )≠2∶1 时,S2− 或 中有一种过量,此时在酸性条件下会产生 H2S 或 SO2 气体。溶液甲与过量 NH4HCO3 溶液反应生 成白色沉淀乙,说明溶液甲中必存在除 Na+外的金属离子,而原溶液中不存在 Ag+、Ba2+、Al3+,因此可 3HCO 2 4SO 2 3SO 3NO + 4NH 2 3CO 2 3SO 2 3SO 2 3SO 2 3SO 2 3SO 14 推断溶液甲中的金属离子必然是由加入氢溴酸后生成的,由此可知原溶液中存在 ,它与 HBr 反应 生成的 Al3+存在于溶液甲中,Al3+与 发生双水解反应:Al3++3 Al(OH)3↓+3CO2↑。第三 步,溶液乙中含有过量的 、 ,加入过量的 Ba(OH)2 溶液发生反应: + +Ba2++2OH− BaCO3↓+NH3↑+2H2O,而 无法确定,故白色沉淀丙中可能含有 BaSO4。第四步,根据溶液的电 中性原则:Na+是原溶液中唯一的阳离子,其一定存在。 7.【答案】B 沉淀是 Mg(OH)2,n[Mg(OH)2]=0.01 mol,根据原子守恒知,n(Mg2+)=0.01 mol,c(Mg2+)= = 0.1 mol·L-1,生成 0.01 mol Mg(OH)2 需要 n(NaOH)是 0.02 mol,Al(OH)3 和 NaOH 反应生成 NaAlO2 需 要 NaOH 溶液的体积是 5 mL,则铝离子和 NaOH 溶液反应生成 Al(OH)3 沉淀时需要 NaOH 溶液的体积是 15 mL,则生成氢氧化镁需要 NaOH 溶液的体积是 10 mL,所以 c(NaOH)= =2 mol·L-1,C 正确; 氢氧化铝和 NaOH 溶液反应生成 NaAlO2,结合原子守恒知,c(Al3+)=0.1 mol·L-1,c( )=0.2 mol·L -1,溶液中 c( )= =0.3 mol·L-1,3c(Al3+)+c( )+2c(Mg2+)>2c( ),根据溶液中 电荷守恒知,溶液中一定还存在硝酸根离子,B 错误;根据使用 NaOH 溶液体积知,n(Mg2+)∶n(Al3+)∶ n( )=1∶1∶2,D 正确。 8.【答案】(1)Ag+、Mg2+、Ba2+ (2) +2H+===H2SiO3↓&网 2AlO 3HCO 3HCO 4NH 3HCO 4NH 3HCO 2 4SO 0.01mol 0.1L 0.02mol 0.01L 4NH 2 4SO 0.03mol 0.1L 4NH 2 4SO 4NH 2 3SiO 15 (3) 阴离子 c/mol·L-1 ? 0.25 0.4 0 (4)存在,最小浓度为 0.8 mol·L-1 【解析】由题知溶液为透明澄清溶液,因此溶液中的离子必能大量共存。由实验Ⅰ可知,加入稀盐酸产 生气体,必有 ,其浓度为 0.56 L÷22.4 L/mol÷0.1 L=0.25 mol·L-1,则溶液中一定无 Ag+、Mg2+、Ba2 +;且能生成白色沉淀,因此有 ,发生的反应为 +2H+===H2SiO3↓,且 的浓度为 2.4 g÷60 g·mol-1÷0.1 L=0.4 mol·L-1;由实验Ⅲ可知溶液中不含 ;根据电荷守恒知 2c( )+2c( )= 2×0.25 mol·L-1+2×0.4 mol·L-1=1.3 mol·L-1>0.5 mol·L-1,因此必有 K+,至少为 0.8 mol·L-1,不能确 定有无 。&网 9.【答案】(1)Mg2+、Fe2+、Fe3+、 、 (2) +OH-===NH3·H2O (3)V2-V1=3(V4-V3) (4)①Cl2+2I-===I2+2Cl- ②10∶15∶4 3NO 2 3CO 2 3SiO 2 4SO 2 3CO 2 3SiO 2 3SiO 2 3SiO 2 4SO 2 3CO 2 3SiO 3NO 2 3CO 2AlO + 4NH 16 1.【答案】B 喷火的鱼 世界上存在一种性嗜群游的鱼,它们身体不大,只有 20 厘米左右。“喷火”是它们的一种微妙的护身武 器。它们平时能从食物中摄取含磷的有机物,并不断在体内积存起来,一旦碰到敌害或船只,数以百计的 直通高考 17 喷火鱼就会同时喷出这种含磷物质,由于这种物质中的白磷或磷化氢在空气中能自燃,因而会形成一束较 长的火焰,致使敌人害怕得转身就逃。查看更多