化学卷·2018届广东省湛江一中高二上学期第二次大考(2016
湛江一中2016-2017学年度第一学期“第二次大考”
高二级化学科试卷
考试时间:70分钟 满分:100分 命题老师:洪文彪相对原子质量: Na--23 S--32 O--16
一、单项选择题(15个选择题,每个选择题3分,共45分)
1、下列说法正确的是 ( )
A.电解精炼铜时,同一时间内阳极溶解的铜的质量比阴极析出的铜的质量大
B.在镀件上电镀锌,可以用锌做阳极,也可以用惰性材料做阳极
C.二次电池充电过程是化学能转化为电能的过程
D.二次电池充电时,电池上标有“+”的电极应与外接电源的负极相连
2、用惰性电极分别电解下列各物质的水溶液一段时间后,向剩余溶液中加入适量水能使溶液恢复到电解前浓度的是 ( )
A.AgNO3 B.NaCl C.CuCl2 D.H2SO4
3、在相同温度时,100 mL 0.01 mol·L-1的醋酸溶液与10 mL 0.1 mol·L-1的醋酸溶液相比较,下列数值中,前者大于后者的是 ( )
A.H+的物质的量 B.醋酸的电离常数
C.中和时所需NaOH的量 D.CH3COOH的物质的量
4、镍镉(Ni-Cd)可充电电池在现代生活中有广泛应用。已知某镍镉电池的电解质溶液为KOH溶液,其充、放电按下式进行:Cd + 2NiOOH + 2H2OCd(OH)2 + 2Ni(OH)2
有关该电池的说法正确的是( )
A.充电时阳极反应:Ni(OH)2 -e— + OH- == NiOOH + H2O
B.充电过程是化学能转化为电能的过程
C.放电时负极附近溶液的碱性不变 D.放电时电解质溶液中的OH-向正极移动
5、恒温下,反应aX(g) bY(g)+cZ(g)达到平衡状态,把容器体积压缩到原来的1/2,且达到新的平衡状态时,X的物质的量浓度从0.1 mol/L增大到0.19 mol/L,下列判断正确的是( )
A.a>b+c B.a
v(逆) ⑤加入催化剂,B的转化率提高
A.①② B.④ C.③ D.④⑤
8、下列浓度关系正确的是 ( )
A.氯水中:c(Cl2)=2[c(ClO-)+c(Cl-)+c(HClO)]
B.氯水中:c(Cl-)>c(H+)>c(OH-)>c(ClO-)
C.等体积等浓度的氢氧化钠与醋酸混合:c(Na+)=c(CH3COO-)
D.Na2CO3溶液中:c(Na+)>c(CO32-)>c(OH-)>c(HCO3-) >c(H+)
9、下列溶液中各微粒的浓度关系不正确的是 ( )
A.0.1 mol·L-1 HCOOH溶液中:c(HCOO-)+c(OH-)=c(H+)
B.1 L 0.l mol·L-1CuSO4·(NH4)2SO4·6H2O溶液中:
c(SO42-)>c(NH4+)>c(Cu2+)>c(H+)>c(OH-)
C.0.1 mol·L-1NaHCO3溶液中:c(Na+)+c(H+)+c(H2CO3) >c(HCO3-)+c(CO32-)+c(OH-)
D.等体积、等物质的量浓度的NaX和弱酸HX混合后的溶液中:
c(Na+)>c(HX)>c(X-)>c(H+)>c(OH-)
10、甲、乙两杯醋酸稀溶液,甲的pH=a,乙的pH=a+1,下列判断正确的是 ( )
A.甲中由水电离出来的H+的物质的量浓度是乙的倍
B.甲、乙两杯溶液物质的量浓度之间的关系为:c(甲)=10c(乙)
C.中和含有等物质的量NaOH的溶液,需甲、乙两杯酸的体积(V)之间关系为:10V(甲)>V(乙)
D.甲中的c(OH-)为乙中的c(OH-)的10倍
11、可用于电动汽车的铝—空气燃料电池,通常以NaCl溶液或NaOH
溶液为电解液,铝合金为负极,空气电极为正极。下列说法正确的是 ( )
A.以NaCl溶液或NaOH溶液为电解液时,正极反应都为:O2+2H2O+4e-==4OH-
B.以NaOH溶液为电解液时,负极反应为:Al+3OH--3e-==Al(OH)3↓
C.以NaOH溶液为电解液时,电池在工作过程中电解液的pH保持不变
D.电池工作时,电子通过外电路从正极流向负极
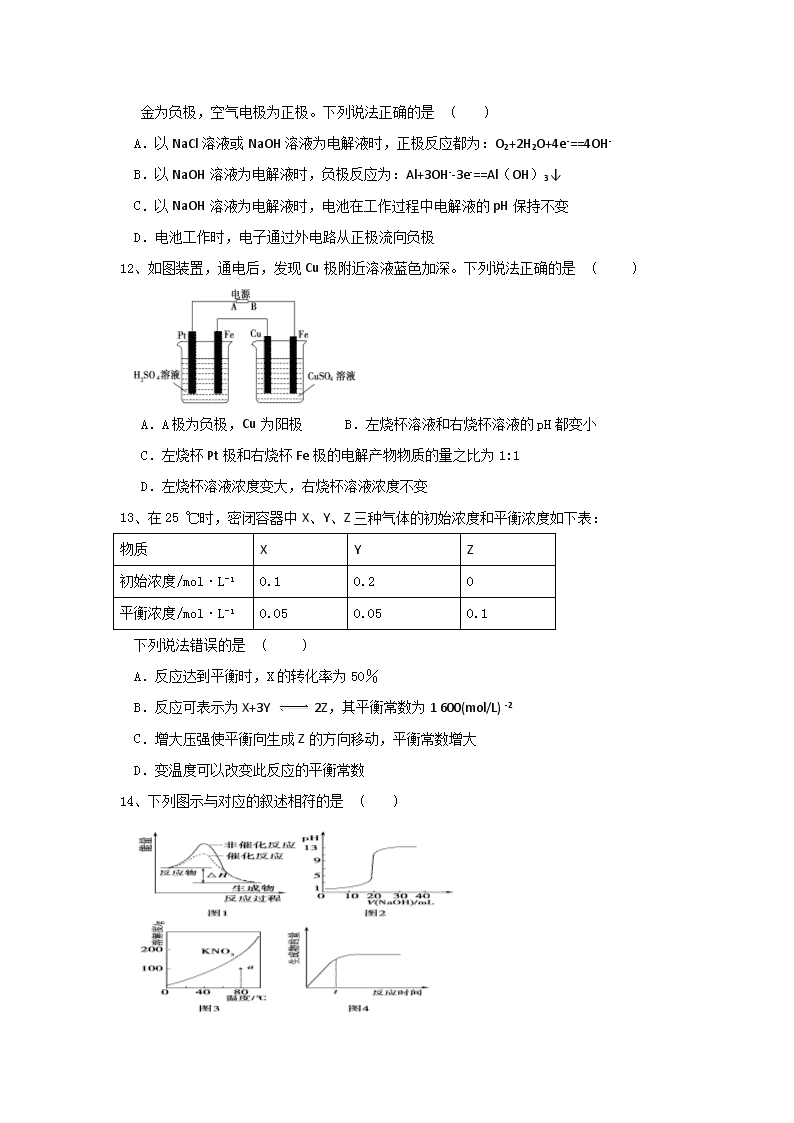
12、如图装置,通电后,发现Cu极附近溶液蓝色加深。下列说法正确的是 ( )
A.A极为负极,Cu为阳极 B.左烧杯溶液和右烧杯溶液的pH都变小
C.左烧杯Pt极和右烧杯Fe极的电解产物物质的量之比为1:1
D.左烧杯溶液浓度变大,右烧杯溶液浓度不变
13、在25 ℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:
物质
X
Y
Z
初始浓度/mol·L-1
0.1
0.2
0
平衡浓度/mol·L-1
0.05
0.05
0.1
下列说法错误的是 ( )
A.反应达到平衡时,X的转化率为50%
B.反应可表示为X+3Y 2Z,其平衡常数为1 600(mol/L) -2
C.增大压强使平衡向生成Z的方向移动,平衡常数增大
D.变温度可以改变此反应的平衡常数
14、下列图示与对应的叙述相符的是 ( )
A.图1表示某吸热反应分别在有、无催化剂的情况下反应过程中的能量变化
B.图2表示0.1000 mol·L-1NaOH溶液滴定20.00 mL 0.1000 mol·L-1CH3COOH溶液所得到的滴定曲线
C.图3表示KNO3的溶解度曲线,图中a点所示的溶液是80℃时KNO3的不饱和溶液
D.图4表示某可逆反应生成物的量随反应时间变化的曲线,由图知t时反应物转化率 最大
15、下列有关实验操作、现象和解释或结论都正确的是 ( )
选项
实验操作
现 象
解释或结论
A
过量的Fe粉中加入稀HNO3,充分反应后,滴入KSCN溶液
溶液呈红色
稀HNO3将Fe氧化为Fe3+
B
AgI沉淀中滴入稀KCl溶液
有白色沉淀出现
AgCl比AgI更难溶
C
Al箔插入稀HNO3中
无现象
Al箔表面被HNO3氧化,形成致密的氧化膜
D
用玻璃棒蘸取浓氨水点到红色石蕊试纸上
试纸变蓝色
浓氨水呈碱性
第二部分: 非选择题( 55分)
16、(15分)(1)测得一定温度下某溶液的pH=6.5,且溶液中氢离子与氢氧根离子物质的量相等,此溶液呈 性。测定温度 25℃(填“高于”、“低于”或“等于”)。
(2)将25℃下pH=12的NaOH溶液a L与pH=1的HCl溶液b L混合。若所得混合液为中性,则a:b= 。
(3)将等体积等物质的量浓度的醋酸和氢氧化钠溶液混合,溶液呈 (填“酸性”、“中性”或“碱性”,下同),溶液中c(Na+) c(CH3COO-)(填“>”、“<”或“=”)。
(4)pH=3的醋酸和pH=11的氢氧化钠溶液等体积混合后溶液呈 ,
溶液中c(Na+) c(CH3COO-)(填“>”、“<”或“=”,下同)。
(5)O3将I-氧化成I2的过程由3步反应组成:
①I-(aq) + O3(g)=IO-(aq)+O2(g) △H1
②IO-(aq)+H+(aq) HOI(aq) △H2
③HOI(aq) + I-(aq) + H+(aq) I2(aq) + H2O(l) △H3
总反应的化学方程式为______________________________,其反应△H=_________。
(6)已知: CH3COOHCH3COO-+ H+ Ka
H2OH+ + OH- Kw
则CH3COO-+ H2OCH3COOH + OH- 平衡常数K=___________________。
(7)常温下,如果要使c(Fe3+) < 10-5 mol/L,则应控制溶液pH的范围为_____________。已知:Ksp[Fe(OH)3] = 8.0×10-38;lg5 = 0.7
17、(15分) 某二元酸(化学式用H2A表示)在水中的电离方程式是:
H2A===H++HA-, HA- H++A2- 回答下列问题:
(1)Na2A溶液显________(填“酸性”“中性”或“碱性”),用离子方程式表示其原因_______________________________________________________。
(2)在0.1 mol·L-1的Na2A溶液中,下列微粒浓度关系式正确的是________。
A.c(A2-)+c(HA-)+c(H2A)=0.1 mol·L-1
B.c(OH-)=c(H+)+c(HA-)+2c(H2A)
C.c(Na+)+c(H+)=c(OH-)+c(HA-)+2c(A2-)
D.c(Na+)>c(A2-)>c(HA-)>c(OH-)>c(H+)
(3)常温下,已知0.1 mol·L-1NaHA溶液的pH=2,则0.1 mol·L-1H2A溶液中c(H+)可能______(填“>”、“<”或“=”)0.11 mol·L-1;理由是________________________________。
(4)比较①0.1 mol·L-1 Na2A溶液 ②0.1 mol·L-1 Na2SO4溶液,两种溶液中阴离子总浓度的大小①________②(填“>”、“<”或“=”)。
(5)O3可由臭氧发生器(原理如图)电解稀硫酸制得。
①图中阴极为________(填“A”或“B”),其电极反应式为_______________________。
②若C处通入O2,则A极的电极反应式为________。
③若C处不通入O2,D、E处分别收集到x L和y L气体(标准状况),则E处收集的气体中O3所占的体积分数为________(忽略O3的分解)。
18、(11分) 在一定条件下,二氧化硫和氧气发生如下反应:
2SO2 (g)+O2 (g) 2SO3 (g) ΔH<0
(1)写出该反应的化学平衡常数表达式K=________。
(2)降低温度,该反应K值_______,二氧化硫转化率_______,化学反应速率________(以上均填“增大”“减小”或“不变”)。
(3)600℃时,在一密闭容器中,将二氧化硫和氧气混合,反应过程中SO2、O2、SO3
物质的量变化如图,反应处于平衡状态的时间是____________________。
(4)据图判断,反应进行至20 min时,曲线发生变化的原因是________(用文字表达)。10 min~15 min的曲线变化的原因可能是________(填写编号)。
a.加了催化剂 b.缩小容器体积 c.降低温度 d.增加SO3的物质的量
19、(14分)I.某兴趣小组利用下图装置测定某硫酸工厂排放尾气中二氧化硫的含量,图中气体流量计B用于准确测量通过的尾气体积。将尾气通入一定体积已知浓度的碘水中测定SO2的含量。当洗气瓶C中溶液蓝色消失时,立即关闭活塞A。
(1) C中导管末端连接一个多孔球泡D,可以提高实验的准确度,其理由是___________________________________。
(2)C中发生反应的离子方程式 。
(3)C中溶液蓝色消失后,没有及时关闭活塞A,测得的SO2含量 (填“偏高”、“偏低”或“无影响”)。
II.实验室常用Na2SO3固体与浓硫酸反应制取SO2 :
(4) 现有已制得SO2的饱和溶液,请利用此溶液(其他试剂任选),设计一个简单实验,比较SO2与Fe2+ 还原性的强弱(要求:写出实验步骤、现象和结论)
。
(5)某研究小组测定部分变质的Na2SO3固体样品中Na2SO3的含量:
① 取a克Na2SO3固体样品配制成100mL溶液,取10.00mL该溶液于锥形瓶中,加入几滴淀粉溶液作指示剂,0.0100mol/L碘水进行滴定,滴定终点现象为 ,记录数据,重复滴定2次,平均消耗碘水20.00mL。
② 计算:样品中亚硫酸钠的质量分数为 。
湛江一中2016-2017学年度第一学期“第二次大考”
高二级化学科试卷答案
一、单项选择题(15个选择题,每个选择题3分,共45分)
1-15、 B D A A A B B D D A A D C C D
二、第二部分: 非选择题( 55分)
16、(15分,除标注外其余每空1分)
(1)中(1分) 高于(1分) (2)10:1(2分)
(3)碱性(1分) >(1分) (4)酸性(1分) <(1分)
(5) O3 (g)+ 2I-(aq) + 2H+ (aq)== O2(g) +I2(aq) +H2O(l) (2分),
ΔH =ΔH 1+ΔH 2 +ΔH 3 (1分)
(6)Kw/ Ka (2分) (7)pH >3.3 (2分)
17、(15分,除标注外其余每空2分)
(1) 碱性(1分) A2-+H2OHA-+OH- (2分) (2)C(2分)
(3) < (1分)
H2A一级电离出H+,对HA-电离起抑制作用,而NaHA中不存在抑制作用(2分)
(4) >(2分)
(5) ①A(1分) 2H++2e-===H2↑(1分)
②O2+4H++4e-===2H2O(1分) ③(x-2y)/y(2分)
18、(11分,除标注外其余每空2分)
(1) (2)增大(1分) 增大(1分) 减小(1分)
(3)15 min~20 min和25 min~30 min (4)增加了O2的量 a、b
19、(14分,除标注外其余每空2分)
(1) 增大气体与溶液的接触面积,有利于SO2与碘水反应(或被碘水充分吸收)(2分)
(2) SO2 + I2 +2H2O = SO42—+ 2I— + 4H+ (2分,没有配平扣1分)
(3)偏低(2分)
(4)取约2mLSO2的饱和溶液于试管中,滴加3~5滴氯化铁溶液,摇匀,滴加2~3滴KSCN溶液,溶液不变红,再滴加几滴BaCl2溶液,产生白色沉淀,说明还原性 SO2>Fe2+。(3分,只答到氯化铁溶液颜色变化得1分。)其他合理答案也给分(注意“简单实验”)。
(5) ①当最后一滴碘水滴下时,锥形瓶溶液颜色恰好由无色变蓝色,且30秒蓝色不褪去(2分)。
② (3分)