- 2021-08-23 发布 |
- 37.5 KB |
- 6页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
【化学】广东省揭阳市第三中学2019-2020学年高一下学期第一次阶段考试试题
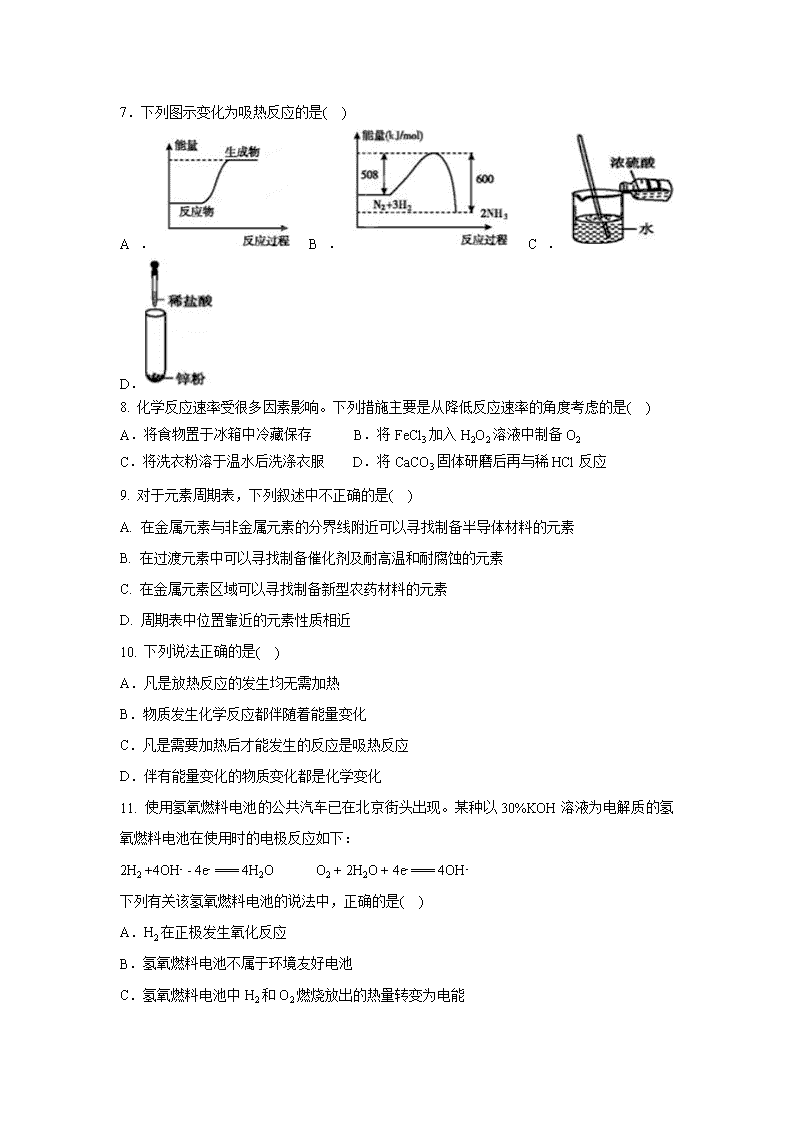
广东省揭阳市第三中学2019-2020学年高一下学期第一次阶段考试试题 注意事项: 1.本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分,共100分,测试时间为75分钟。 2.将答案全部填在答题卷的相应位置,否则无效。 可能用到的相对原子质量:H:1 C :12 N:14 O:16 Na:23 Al:27 Cl:35.5 Cu:64 第一部分 选择题(共48分) 一、单项选择题(共16小题,每小题3分,共48分,每道题只有一个答案正确.) 1. 对于元素周期表和元素周期律的发现有突出贡献的科学家是( ) A.拉瓦锡 B.阿伏加德罗 C.门捷列夫 D.道尔顿 2. 下列各组中属于同素异形体的是( ) A.与 B.T2O与H2O C.与 D.金刚石与石墨 3. 下列有关化学用语表达不正确的是( ) A.Na的原子结构示意图: B.含有6个质子和7个中子的碳元素的核素符号:C C.氮气的电子式:∶N∶∶∶N∶ D.用电子式表示氧化钠的形成过程: 4. 下列关于3 2He的说法正确的是( ) A.3 2He原子核内含有2个中子 B.3 2He原子核内含有3个质子 C.3 2He原子核外有3个电子 D.3 2He的质量数为3 5. As 的原子结构示意图为 ,下列关于 As 的描述不正确的是( ) A.位于第四周期,第ⅤA 族 B.属于非金属元素 C.酸性:H3As O4﹥H3P O4 D.稳定性:AsH3﹤PH3 6. 下列递变规律正确的是( ) A. 密度:Cs>Rb>K>Na>Li B.还原性:Mg>Na>Al C.碱性:KOH>NaOH>LiOH D.还原性:Cl->Br->I- 7.下列图示变化为吸热反应的是( ) A. B. C. D. 8. 化学反应速率受很多因素影响。下列措施主要是从降低反应速率的角度考虑的是( ) A.将食物置于冰箱中冷藏保存 B.将FeCl3加入H2O2溶液中制备O2 C.将洗衣粉溶于温水后洗涤衣服 D.将CaCO3固体研磨后再与稀HCl反应 9. 对于元素周期表,下列叙述中不正确的是( ) A. 在金属元素与非金属元素的分界线附近可以寻找制备半导体材料的元素 B. 在过渡元素中可以寻找制备催化剂及耐高温和耐腐蚀的元素 C. 在金属元素区域可以寻找制备新型农药材料的元素 D. 周期表中位置靠近的元素性质相近 10. 下列说法正确的是( ) A.凡是放热反应的发生均无需加热 B.物质发生化学反应都伴随着能量变化 C.凡是需要加热后才能发生的反应是吸热反应 D.伴有能量变化的物质变化都是化学变化 11. 使用氢氧燃料电池的公共汽车已在北京街头出现。某种以30%KOH溶液为电解质的氢氧燃料电池在使用时的电极反应如下: 2H2 +4OH- - 4e- === 4H2O O2 + 2H2O + 4e- === 4OH- 下列有关该氢氧燃料电池的说法中,正确的是( ) A.H2在正极发生氧化反应 B.氢氧燃料电池不属于环境友好电池 C.氢氧燃料电池中H2和O2燃烧放出的热量转变为电能 D.供电时的总反应为:2H2 + O2 === 2H2O 12. 关于化学键的下列叙述中, 正确的是 ( ) A.离子化合物中可能含共价键 B.共价化合物中可能含离子键 C.离子化合物中只含离子键 D.共价化合物中可能含离子键 13.下列递变规律不正确的是( ) A.N a、Mg、Al原子的失电子能力逐渐减弱 B.Si、P、S元素的最高正化合价依次降低 C.C、N、O的原子半径依次减小 D.Cl、Br、I的气态氢化物的稳定性依次减弱 14. 下列有关230Th和232Th的说法正确的是( ) A.230Th和232Th的核外电子数不同 B.230Th和232Th的化学性质不同 C.230Th和232Th互为同位素 D.230Th和232Th是同一种核素 15. 下列四种溶液,均能跟锌片反应,其中最初反应速率最快的是( ) A.10℃ 20mL 3mol/L的盐酸溶液 B.20℃ 30mL 2mol/L的盐酸溶液 C.20℃ 20mL 2mol/L的盐酸溶液 D.20℃ 10mL 2mol/L的硫酸溶液 16. 下列有关电池的说法不正确的是( ) A.手机用的锂离子电池属于二次电池 B.锌锰干电池中锌电极是负极 C.甲醇燃料电池可把化学能转化为电能 D.汽车所用的铅蓄电池可以无限次的反复放电、充电 第二部分 非选择题(共52分) 17. (13分)下表是元素周期表的一部分,用元素符号或化学式填空回答以下问题: (1)在这些元素中,最活泼的非金属元素是 ,化学性质最不活泼的元素是 。 (2)表中金属性最强的元素是 ,其原子结构示意图为 。 (3)表中元素的最高价氧化物对应的水化物中酸性最强的是 ,呈两性的氢氧化物是 。 (4)元素⑩的元素符号为 ,元素⑦的原子序数为 。 (5)在①~③元素中,原子半径最大的是 ,原子半径最小的是 。 (6)十种元素中有一种元素的氢化物水溶液呈碱性,该氢化物的电子式为 。 18. (10分)利用所学化学知识解答问题: (1)微粒Na+中的质子数是 ,中子数是 ,核外电子数是 。 (2)写出氯离子的原子结构示意图 ,写出氯化钠的电子式 , 用电子式表示HCl的形成过程_______________________________________。 (3) NH4NO3是 化合物(填“离子”或“共价”),NaOH所含化学键类型为 。 19.(14分)原电池原理的发现是储能和供能技术的巨大进步,是化学对人类的一项重大贡献。 (1)现有如下两个反应:A.NaOH+HCl=NaCl+H2O;B.Zn+H2SO4=ZnSO4+H2↑ 判断能否设计成原电池A. ,B. 。(填“能”或“不能”) (2)将纯锌片和纯铜片按图方式插入100 mL相同浓度的稀硫酸中一段时间,回答下列问题: ①下列说法正确的是____________。 A.甲、乙均为化学能转变为电能的装置 B.乙中铜片上没有明显变化 C.甲中铜片质量减少、乙中锌片质量减少 D.两烧杯中溶液的pH均增大 ②在相同时间内,两烧杯中产生气泡的速度:甲________乙(填“>”、“<“或“=” ) ③请写出图中构成原电池的负极电极反应式_________________________。 (3)燃料电池的工作原理是将燃料和氧化剂(如O2)反应所放出的化学能直接转化为电能。现设计一燃料电池,以电极a为正极,电极b为负极,氢气为燃料,采用氢氧化钠溶液为电解液;则氢气应通入 极(填a或b),电子从 (填a或b)极流出。 20.(15分)(1)对于反应2SO2 (g)+ O2 (g) 2SO3(g),当其他条件不变时,只改变一个反应条件,将生成的SO3的反应速率的变化填入下表空格内(填“增大”、“减少”、“不变”)。 编号 改变的条件 生成SO3的反应速率 ① 升高温度 ② 降低温度 ③ 增大氧气的浓度 ④ 使用催化剂 ⑤ 压缩体积 (2)某温度时,在5 L的容器中,X、Y、Z三种气体的物质的量随时间的变化曲线如下图所示。请回答下列问题。 ①计算反应开始至2 min,Y的平均反应速率 。 ②分析有关数据,写出X、Y、Z的反应方程式 。 ③由图中看出: 分钟后,A、B、C各物质的 物质的量不再随时间而变化,说明在这个条件下, 该反应已达到了平衡状态。 【参考答案】 一、 单项选择题(共16小题,每小题3分,共48分。) 题号 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 答案 C D C D C C A A C B D A B C D D 17. (13分)(1)F(1分),Ar(1分)(2)K(1分),(2分) (3)HClO4(1分),Al(OH)3 (1分) (4)Br(1分),17(1分)(5)C(1分),F(1分)(6)(2分) 18. (10分) (1)11, 12, 10 (各1分,共3分) (2) (1分) (1分) (2分) (3) 离子 (1分) 离子键、(极性)共价键(2分) 19. .(共14分) (1) 不能 (1分) 能 (1分) (2) ① BD (2分,选1个且对给1分,有错不给分。) ② > (2分) ③ Zn - 2e- = Zn2+ (2分) ④ 1mol·L-1 (2分,数错0分,不写单位、单位错扣1分) (3) b (2分) b (2分) 20.(15分) (1)①增大;②减少;③增大;④增大;⑤增大(各2分) (2)①0.03mol·(L ·min) -1 (2分)② (2分)③2(1分) 考试范围:必修2第一、二章 查看更多