- 2021-08-23 发布 |
- 37.5 KB |
- 10页
申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
四川省遂宁市射洪中学2019-2020学年高二下学期入学考试化学试题
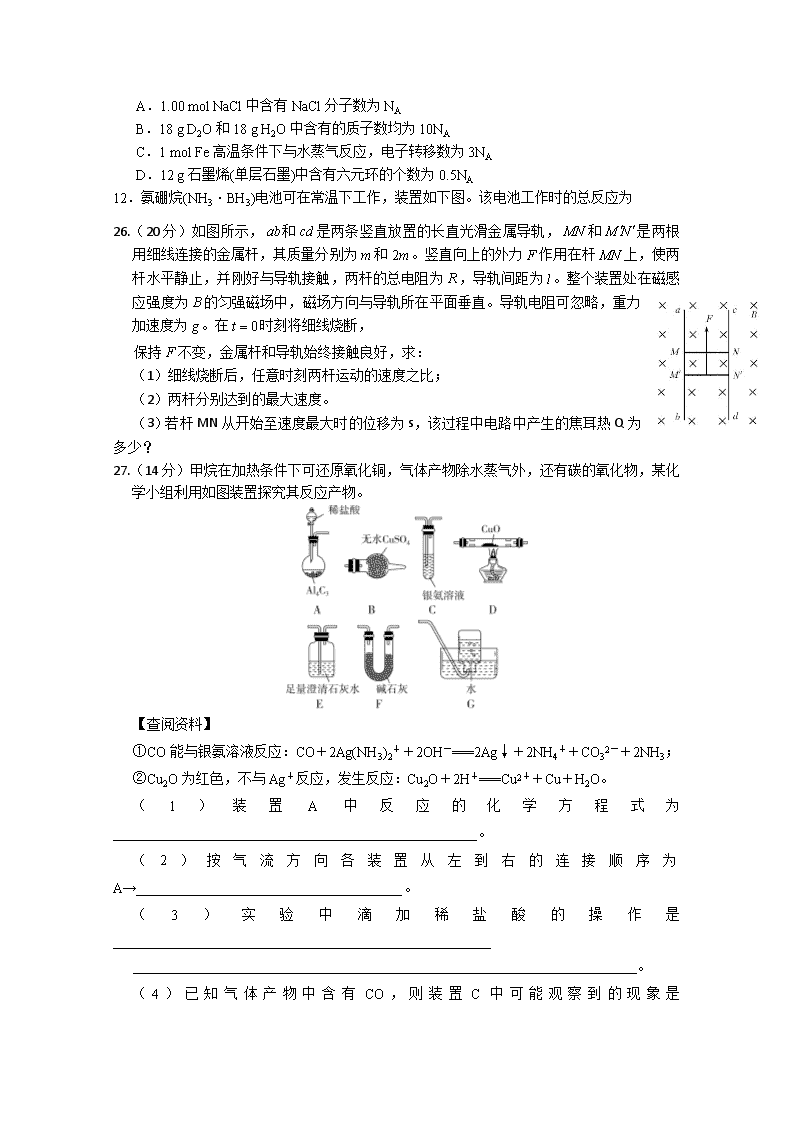
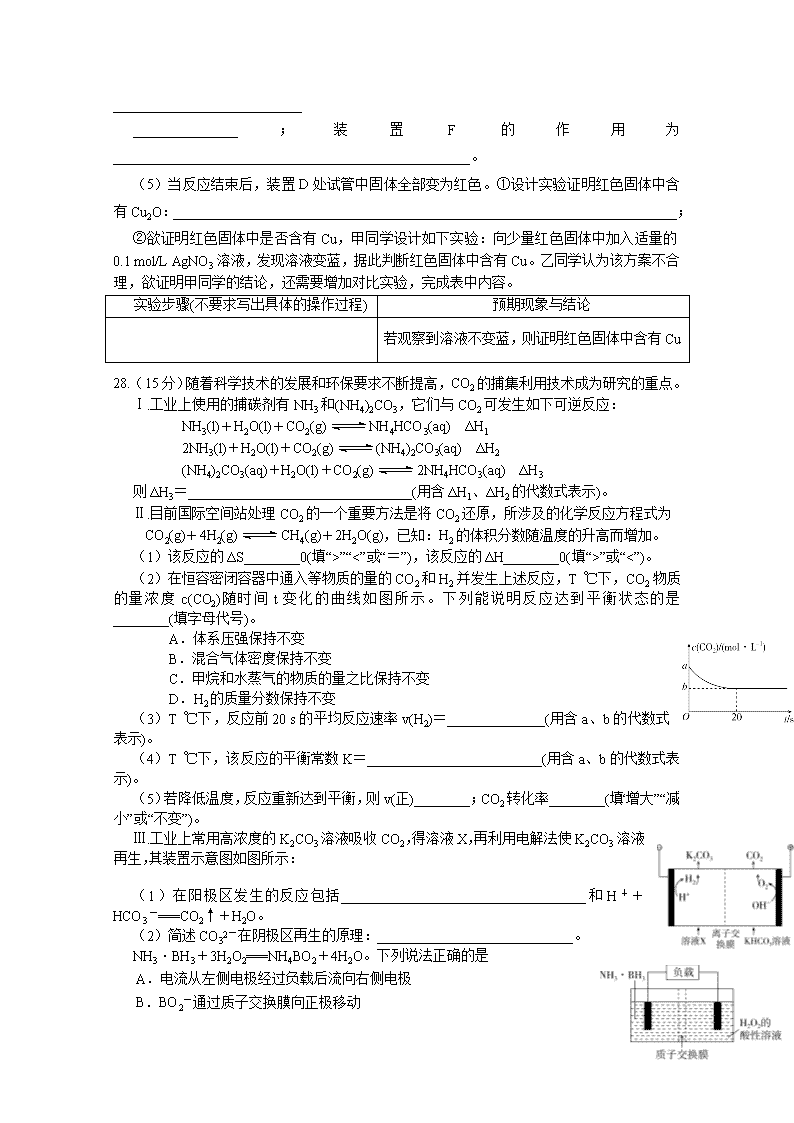
射洪中学2019-2020学年高二下学期入学考试 化学试题 7.化学与生活密切相关。下列说法正确的是 A.海水制盐后可以利用氯碱工业,电解饱和食盐水制备金属钠 B.海带中的碘是以I-形式存在,向浸泡过海带灰的水中滴加淀粉,有蓝色出现 C.电热水器用镁棒防止内胆腐蚀,原理是牺牲阳极的阴极保护法 D.工业上对煤进行干馏、液化和气化等物理方法处理,目的是降低污染和获得更多化工原料 8.我国自主研发的对二甲苯绿色合成项目取得新进展,其合成过程如图所示。 下列说法不正确的是 A. 异戊二烯最多有11个原子共平面 B.可用溴水鉴别M和对二甲苯 C.对二甲苯的一氯代物有2种 D.M的某种同分异构体含有苯环且能与钠反应放出氢气 9.氢化钙(CaH2)固体是一种储氢材料,遇水反应生成氢氧化钙和氢气,是登山运动员常用的能源提供剂。某化学兴趣小组设计制取氢化钙的装置如下(固定装置已略去)。下列说法不正确的是 A.装置A:制取H2,离子方程式为Zn+2H+===Zn2++H2↑ B.装置B:用于除去H2中杂质,①中盛有NaOH溶液,②中盛有浓硫酸 C.装置C:制取CaH2,先点燃C处酒精灯,后打开A中分液漏斗的活塞 D.装置D:竖直导管的作用是平衡压强,观察H2流速以调节反应的进行 10.4种短周期元素W、X、Y、Z的原子序数依次增大,其原子的最外层电子数之和为19,W和X元素原子内质子数之比为1∶2,X2+和Z-的电子数之差为8,下列说法不正确的是 A.与W相邻的同主族元素可制成重要的半导体材料 B.X单质不可能置换出W单质 C.元素原子半径从大到小的顺序是X、Y、Z D.W、Y、Z元素最高价氧化物对应的水化物中酸性最强的是HZO4 11.用NA表示阿伏加德罗常数的值。下列叙述中正确的是 A.1.00 mol NaCl中含有NaCl分子数为NA B.18 g D2O和18 g H2O中含有的质子数均为10NA C.1 mol Fe高温条件下与水蒸气反应,电子转移数为3NA D.12 g石墨烯(单层石墨)中含有六元环的个数为0.5NA 12.氨硼烷(NH3·BH3)电池可在常温下工作,装置如下图。该电池工作时的总反应为 26.(20分)如图所示,和是两条竖直放置的长直光滑金属导轨,和是两根用细线连接的金属杆,其质量分别为和。竖直向上的外力作用在杆上,使两杆水平静止,并刚好与导轨接触,两杆的总电阻为,导轨间距为。整个装置处在磁感应强度为的匀强磁场中,磁场方向与导轨所在平面垂直。导轨电阻可忽略,重力加速度为。在时刻将细线烧断, 保持不变,金属杆和导轨始终接触良好,求: (1)细线烧断后,任意时刻两杆运动的速度之比; (2)两杆分别达到的最大速度。 (3)若杆MN从开始至速度最大时的位移为s,该过程中电路中产生的焦耳热Q为多少? 27.(14分)甲烷在加热条件下可还原氧化铜,气体产物除水蒸气外,还有碳的氧化物,某化学小组利用如图装置探究其反应产物。 【查阅资料】 ①CO能与银氨溶液反应:CO+2Ag(NH3)2++2OH-===2Ag↓+2NH4++CO32-+2NH3; ②Cu2O为红色,不与Ag+反应,发生反应:Cu2O+2H+===Cu2++Cu+H2O。 (1)装置A中反应的化学方程式为____________________________________________________。 (2)按气流方向各装置从左到右的连接顺序为A→______________________________________。 (3)实验中滴加稀盐酸的操作是______________________________________________________ ________________________________________________________________________。 (4)已知气体产物中含有CO,则装置C中可能观察到的现象是 ___________________________ _______________;装置F的作用为___________________________________________________。 (5)当反应结束后,装置D处试管中固体全部变为红色。①设计实验证明红色固体中含有Cu2O:________________________________________________________________________; ②欲证明红色固体中是否含有Cu,甲同学设计如下实验:向少量红色固体中加入适量的0.1 mol/L AgNO3溶液,发现溶液变蓝,据此判断红色固体中含有Cu。乙同学认为该方案不合理,欲证明甲同学的结论,还需要增加对比实验,完成表中内容。 实验步骤(不要求写出具体的操作过程) 预期现象与结论 若观察到溶液不变蓝,则证明红色固体中含有Cu 28.(15分)随着科学技术的发展和环保要求不断提高,CO2的捕集利用技术成为研究的重点。 Ⅰ.工业上使用的捕碳剂有NH3和(NH4)2CO3,它们与CO2可发生如下可逆反应: NH3(l)+H2O(l)+CO2(g)NH4HCO3(aq) ΔH1 2NH3(l)+H2O(l)+CO2(g)(NH4)2CO3(aq) ΔH2 (NH4)2CO3(aq)+H2O(l)+CO2(g)2NH4HCO3(aq) ΔH3 则ΔH3=________________________________(用含ΔH1、ΔH2的代数式表示)。 Ⅱ.目前国际空间站处理CO2的一个重要方法是将CO2还原,所涉及的化学反应方程式为 CO2(g)+4H2(g)CH4(g)+2H2O(g),已知:H2的体积分数随温度的升高而增加。 (1)该反应的ΔS________0(填“>”“<”或“=”),该反应的ΔH________0(填“>”或“<”)。 (2)在恒容密闭容器中通入等物质的量的CO2和H2并发生上述反应,T ℃下,CO2物质的量浓度c(CO2)随时间t变化的曲线如图所示。下列能说明反应达到平衡状态的是________(填字母代号)。 A.体系压强保持不变 B.混合气体密度保持不变 C.甲烷和水蒸气的物质的量之比保持不变 D.H2的质量分数保持不变 (3)T ℃下,反应前20 s的平均反应速率v(H2)=______________(用含a、b的代数式表示)。 (4)T ℃下,该反应的平衡常数K=_________________________(用含a、b的代数式表示)。 (5)若降低温度,反应重新达到平衡,则v(正)________;CO2转化率________(填“增大”“减小”或“不变”)。 Ⅲ.工业上常用高浓度的K2CO3溶液吸收CO2,得溶液X,再利用电解法使K2CO3溶液再生,其装置示意图如图所示: (1)在阳极区发生的反应包括___________________________________和H++HCO3-===CO2↑+H2O。 (2)简述CO32-在阴极区再生的原理:____________________________。 NH3·BH3+3H2O2===NH4BO2+4H2O。下列说法正确的是 A.电流从左侧电极经过负载后流向右侧电极 B.BO2-通过质子交换膜向正极移动 C.负极附近溶液pH增大 D.正极的反应式为3H2O2+6H++6e-===6H2O 13.一定条件下,CH4与H2O(g)发生反应:CH4(g)+H2O(g)CO(g)+3H2(g)。设起始=Z,在恒压下,平衡时CH4的体积分数φ(CH4)与Z和T (温度)的关系如图所示。下列说法正确的是 A.该反应的焓变ΔH<0 B.图中Z的大小为a<3 Ga-P > Ga-As,故熔点降低(2分) (5)12(1分) (3分) 35.(15分)【答案】(1)甲苯(1分) 羧基(1分) (2)加成反应(1分) (2分) (2分) (3)酸性高锰酸钾溶液(1分) 4 (2分) (4)+CH3COOH+H2O(2分) (5) (3分) 26题 解析 (1)装置A用于制取CH4,Al4C3与稀盐酸反应生成AlCl3和CH4,化学方程式为Al4C3+12HCl===3CH4↑+4AlCl3。 (2)装置B中无水CuSO4用于检验生成的水蒸气;银氨溶液与CO反应生成Ag;装置C用于检验生成的CO;装置D中CH4与CuO反应;装置E用于检验生成的CO2;装置F用于干燥生成的CH4,除去HCl气体,得到的干燥CH4与CuO反应;装置G用排水法收集尾气,考虑产物的检验顺序,要先检验水蒸气,故仪器连接顺序为A→F→D→B→E→C→G。 (4)CO能与银氨溶液反应生成Ag,气体产物中含有CO,则装置C中可能观察到的现象是试管中有黑色固体生成。装置A中制取的CH4含有水蒸气和挥发出的HCl气体,通过装置F除去水蒸气和HCl,得到干燥、纯净的CH4。 (5)①资料显示:“Cu2O为红色,不与Ag+反应,发生反应:Cu2O+2H+===Cu2++Cu+H2O”,而Cu不与稀盐酸、稀硫酸等发生反应,故可向红色固体中滴加稀盐酸(或稀硫酸),若溶液变成蓝色,则含有Cu2O。 ②由于红色固体中含有Cu2O,加入0.1 mol/L AgNO3溶液后,可能发生反应生成Cu2+而使溶液变蓝,为排除Cu2O的干扰,要增加对比实验检验二者是否发生反应:向Cu2O固体中加入适量0.1 mol/L AgNO3溶液,观察溶液是否变蓝,若不变蓝,则可排除Cu2O的干扰。 27题解析 Ⅰ.根据盖斯定律,可知ΔH3=2ΔH1-ΔH2。 Ⅱ.(1)这是一个气体体积减小的反应,所以ΔS<0。因为温度升高时,H2的体积分数增大,即平衡逆向移动,所以正反应为放热反应,ΔH<0。 (2)A 项,反应正向进行时,气体物质的量减小,反应逆向进行时,气体物质的量增大,当容器体积不变时,二者都会导致体系内压强改变,所以体系压强不变的状态一定是化学平衡状态,正确;B项,由于反应进行过程中气体的质量始终保持不变,容器体积不变时,混合气体密度始终不变,所以混合气体密度不变时不一定是化学平衡状态,错误;C项,反应开始时只有CO2和H2,所以生成的CH4与H2O物质的量之比始终为1∶2,则CH4与H2O物质的量之比保持不变时不一定是化学平衡状态,错误;D项,反应正向进行时H2质量分数减小,反应逆向进行时H2质量分数增大,所以H2质量分数不变时,一定是化学平衡状态,正确。 (3)前20 s Δc(CO2)=(a-b)mol/L,则v(CO2)=,v(H2)=×4= mol/(L·s)。 (4)平衡建立过程中,反应消耗CO2为(a-b)mol/L,则参加反应的H2为4(a-b)mol/L,生成CH4为(a-b)mol/L、H2O为2(a-b)mol/L,所以反应达到平衡时,CO2为b mol/L,H2为[a-4(a-b)]mol/L=(4b-3a)mol/L,CH4为(a-b)mol/L,H2O为2(a-b)mol/L,K=。 (5)温度降低时,化学反应速率减小,重新建立平衡后,v(正)也减小。由于该反应是放热反应,降低温度后平衡正向移动,所以CO2的转化率增大。 Ⅲ.(1)电解时还原性最强的OH-在阳极放电生成O2,反应原理为4OH--4e-===2H2O+O2↑或2H2O-4e-===4H++O2↑,反应的OH-来源于水,所以电解时阳极产生H+,H++HCO3-===CO2↑+H2O。 (2)阴极区氧化性最强的H+放电生成H2,H+主要来源于水,故电解时阴极产生OH-,OH-+HCO3-===H2O+CO32-,使CO32-得到再生。 28题【解析】(1)题给生产流程中有三步用到了同一种分离方法是过滤,胶体分散质粒子能通过滤纸,所以不能用过滤法来分离液态胶体中的分散质;(2)绿矾是一种良好的还原剂,易被氧化,所以保存绿矾时必须密封保存,防止被空气中的氧气氧化;相同温度下,硫酸亚铁铵在水中的溶解度比FeSO4和(NH4)2SO4的溶解度小,所以在溶液B中加入适量(NH4)2SO4固体,加热浓缩时,可以得到(NH4)2Fe(SO4)2·6H2O;(3)溶液A中的Fe3+、Cu2+都能与铁屑反应生成Fe2+,所以加入足量铁粉后溶液中一定含有的金属阳离子是Fe2+;氧化性Fe3+>Cu2+,加入少量铁屑只发生Fe和Fe3+的反应,平衡常数的表达式为K=;(4)CuS•FeS在氧化亚铁硫杆菌作用下被空气中的氧气氧化生成Fe3+、Cu2+和SO42-,反应的离子方程式为4CuS·FeS+17O2+4H+4Cu2++4Fe3++8SO42-+2H2O;(5)根据反应2Cu+H2OCu2O+H2↑,铜失电子发生氧化反应,可用电解法制备氧化亚铜,铜作阳极,因此可设计工业生产氧化亚铜的装置图是 34题【解析】(1) Se是34号元素,处于第四周期第ⅥA族,核外电子排布式为: [Ar]3d104s24p4 ;同一周期中,元素的第一电离能随着原子序数增大而呈增大趋势,但第ⅤA族元素第一电离能大于相邻元素,因此同一周期p区元素第一电离能大于硒的元素有3种,分别为As、Br、Kr; 气态SeO3分子Se原子孤电子对数==0,价层电子对数=3+0=3,为平面三角形; (2)根据元素周期律,Ga与As位于同一周期,Ga原子序数小于As,故半径Ga大于As,同周期第一电离能从左到右,逐渐增大,故第一电离能Ga小于As; (3) 水晶晶体中1个硅原子结合4个氧原子,同时每个氧原子结合2个硅原子,以[SiO4]四面体结构向空间延伸的立体网站结构,水晶的晶体中硅原子的配位数为4;均属于分子晶体,相对分子质量越大,分子间作用力越强,沸点越高,故沸点:SiBr4>SiCl4>Si2H6>SiH4;丁硅烯(Si4H8)与丁烯结构类似,分子中有8个Si-H键,1个Si=Si双键、2个Si-Si键,单键为σ键,双键含有1个σ键、1个π键,分子中σ键与π键个数之比为11:1; (4)原子半径N< P< As,键长Ga-N < Ga-P < Ga-As,键能Ga-N > Ga-P > Ga-As,故熔点降低;(5)从六方晶胞的面心原子分析,上、中、下层分别有3、6、3个配位原子,故配位数为12;六方晶胞中原子的数目往往采用均摊法:①位于晶胞顶点的原子为6个晶胞共用,对一个晶胞的贡献为1/6;②位于晶胞面心的原子为2个晶胞共用,对一个晶胞的贡献为1/2;③位于晶胞侧棱的原子为3个晶胞共用,对一个晶胞的贡献为1/3;④位于晶胞底面上的棱棱心的原子为4个晶胞共用,对一个晶胞的贡献为1/4;⑤位于晶胞体心的原子为1个晶胞共用,对一个晶胞的贡献为1, GaN晶胞中Ga原子个数为6,晶胞中N原子个数为,所以该结构为Ga6N6,质量为6×84/NA g,该六棱柱的底面为正六边形,边长为a cm,底面的面积为6个边长为acm的正三角形面积之和,根据正三角形面积的计算公式,该底面的面积为cm2,如图所示可知高为2倍的正四面体高,cm,所以体积为,密度为=。 35题【解析】由C→及反应条件可知C为苯甲醇,B为,A为甲苯。在相同条件下,D的蒸气相对于氢气的密度为39,则D的相对分子质量为39×2=78,D与A互为同系物,由此知D为芳香烃,设1个D分子中含有n个碳原子,则有14n-6=78,解得n=6,故D为苯;与乙醛反应得到E,结合信息①,E为,E 与溴发生加成反应得到的F为,F发生氧化反应生成的G为。(1)根据分析可知,A为甲苯,G为,则G中含氧官能团为羧基;(2)反应②为苯甲醛与氯仿发生加成反应生成,根据上述分析,B和F的结构简式分别为、; (3)甲苯能使酸性高锰酸钾溶液褪色,而苯不能;C为苯甲醇属于芳香族化合物的苯甲醇的同分异构体有邻甲基苯酚、间甲基苯酚、对甲基苯酚和苯甲醚(),共4种;(4)反应①为乙酸和发生酯化反应,化学方程式为+CH3COOH+H2O; (5)苯乙醛与甲醛反应生成,再与溴发生加成反应生成,最后发生催化氧化反应生成,故合成路线为。查看更多