- 2021-08-23 发布 |
- 37.5 KB |
- 7页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2018-2019学年黑龙江省哈尔滨师范大学附属中学高二上学期第一次月考化学试题(Word版)
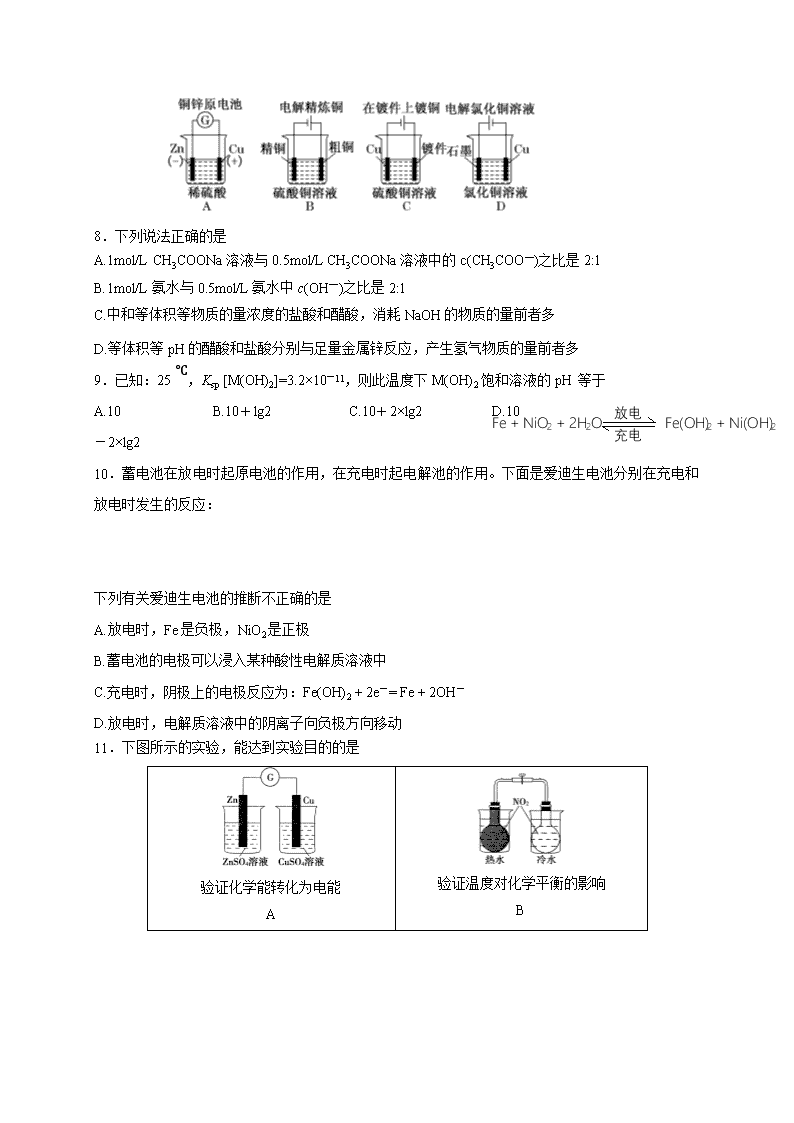
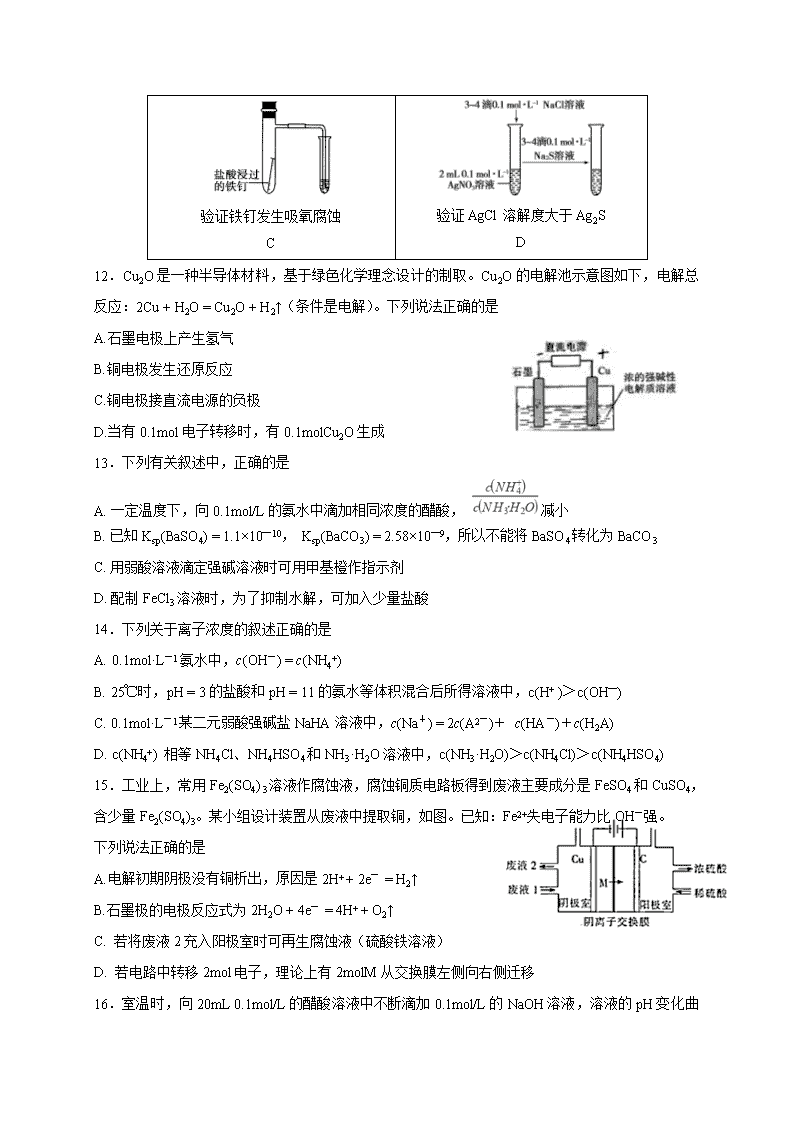
2018-2019学年黑龙江省哈尔滨师范大学附属中学高二上学期第一次月考化学试题 可能用到的相对原子质量: H 1 C 12 O 16 Cu 64 一、选择题(共有18小题,每小题只有一个选项符合题意) 1.下列有关混合物、纯净物、电解质、非电解质的正确组合为 纯净物 混合物 电解质 非电解质 A 纯盐酸 水煤气 硫酸 干冰 B 蒸馏水 蔗糖溶液 氧化铝 二氧化硫 C 胆矾 氢氧化铁胶体 铁 碳酸钙 D 水银 澄清石灰水 氯化铜 碳酸钠 2.下列离子方程式中,属于水解反应的是 A.HCOOH + H2OHCOO—+ H3O+ B.CO2 + H2O HCO3—+ H+ C.CO32—+ H2OHCO3—+ OH— D.HS—+ H2OS2—+ H3O+ 3.下列叙述不正确的是 A.明矾能水解生成Al(OH)3胶体,可用作净水剂 B.除去MgCl2酸性溶液中的Fe3+,可加入MgCO3固体 C.SO2具有氧化性,可用于漂白纸浆 D.Zn具有还原性和导电性,可用作锌锰干电池的负极材料 4.下列将化学能转化为电能的是 A.燃气灶 B.硅太阳能电池 C.锂电池 D.风力发电机 5.用惰性电极电解下列溶液,电解一段时间后,阴极质量增加,电解液的pH下降的是 A.CuCl2 B.AgNO3 C.NaCl D.H2SO4 6.物质的量浓度相同的下列各溶液,由水电离出的OH—离子浓度由大到小的顺序正确的是 ①NaHSO4;②NaHCO3;③Na2CO3;④Na2SO4。 A.④③②① B.①②③④ C.③②④① D.③④②① 7.下列图示中关于铜电极的连接不正确的是 8.下列说法正确的是 A.1mol/L CH3COONa溶液与0.5mol/L CH3COONa溶液中的c(CH3COO—)之比是2:1 B.1mol/L氨水与0.5mol/L氨水中c(OH—)之比是2:1 C.中和等体积等物质的量浓度的盐酸和醋酸,消耗NaOH的物质的量前者多 D.等体积等pH的醋酸和盐酸分别与足量金属锌反应,产生氢气物质的量前者多 9.已知:25 ℃,Ksp [M(OH)2]=3.2×10-11,则此温度下M(OH)2饱和溶液的pH 等于 A.10 B.10+lg2 C.10+2×lg2 D.10-2×lg2 放电 充电 Fe + NiO2 + 2H2O Fe(OH)2 + Ni(OH)2 10.蓄电池在放电时起原电池的作用,在充电时起电解池的作用。下面是爱迪生电池分别在充电和放电时发生的反应: 下列有关爱迪生电池的推断不正确的是 A.放电时,Fe是负极,NiO2是正极 B.蓄电池的电极可以浸入某种酸性电解质溶液中 C.充电时,阴极上的电极反应为:Fe(OH)2 + 2e-= Fe + 2OH- D.放电时,电解质溶液中的阴离子向负极方向移动 11.下图所示的实验,能达到实验目的的是 验证化学能转化为电能 A 验证温度对化学平衡的影响 B 验证铁钉发生吸氧腐蚀 C 验证AgCl溶解度大于Ag2S D 12.Cu2O是一种半导体材料,基于绿色化学理念设计的制取。Cu2O的电解池示意图如下,电解总反应:2Cu + H2O = Cu2O + H2↑(条件是电解)。下列说法正确的是 A.石墨电极上产生氢气 B.铜电极发生还原反应 C.铜电极接直流电源的负极 D.当有0.1mol电子转移时,有0.1molCu2O生成 13.下列有关叙述中,正确的是 A. 一定温度下,向0.1mol/L的氨水中滴加相同浓度的醋酸, 减小 B. 已知Ksp(BaSO4) = 1.1×10—10, Ksp(BaCO3) = 2.58×10—9,所以不能将BaSO4转化为BaCO3 C. 用弱酸溶液滴定强碱溶液时可用甲基橙作指示剂 D. 配制FeCl3溶液时,为了抑制水解,可加入少量盐酸 14.下列关于离子浓度的叙述正确的是 A. 0.1mol·L-1氨水中,c(OH-) = c(NH4+) B. 25℃时,pH = 3的盐酸和pH = 11的氨水等体积混合后所得溶液中,c(H+ )>c(OH—) C. 0.1mol·L-1某二元弱酸强碱盐NaHA溶液中,c(Na+) = 2c(A2-)+ c(HA-)+c(H2A) D. c(NH4+) 相等NH4Cl、NH4HSO4和NH3·H2O溶液中,c(NH3·H2O)>c(NH4Cl)>c(NH4HSO4) 15.工业上,常用Fe2(SO4) 3溶液作腐蚀液,腐蚀铜质电路板得到废液主要成分是FeSO4和CuSO4, 含少量Fe2(SO4)3。某小组设计装置从废液中提取铜,如图。已知:Fe2+失电子能力比OH-强。 下列说法正确的是 A.电解初期阴极没有铜析出,原因是2H+ + 2e- = H2↑ B.石墨极的电极反应式为2H2O + 4e- = 4H+ + O2↑ C. 若将废液2充入阳极室时可再生腐蚀液(硫酸铁溶液) D. 若电路中转移2mol电子,理论上有2molM从交换膜左侧向右侧迁移 16.室温时,向20mL 0.1mol/L的醋酸溶液中不断滴加0.1mol/L的NaOH溶液,溶液的pH变化曲线如图所示,在滴定过程中,下列关于溶液中离子浓度大小关系的描述不正确的是 A. a点时:c(CH3COO-)>c(Na+)>c(CH3COOH)>c(H+)>c(OH-) B. b点时:c(Na+) = c(CH3COO-) C. c点时:c(OH-) =c(CH3COOH) + c(H+) D. d点时:c(Na+)>c(CH3COO-)>c(OH-)>c(H+) 17.常温下,在一定体积pH=12的Ba(OH)2溶液中,逐滴加入一定 物质的量浓度的NaHSO4溶液,当溶液中Ba2+恰好完全沉淀时,溶液pH=11。若反应后溶液体积等于 Ba(OH)2溶液与NaHSO4溶液体积之和,则Ba(OH)2溶液与NaHSO4溶液体积比是 A. 1:9 B. 1:1 C. 1:2 D. 1:4 18.如图装置电解一段时间,当某极析出0.32gCu时,I、Ⅱ、Ⅲ中溶液pH分别为(溶液足量,体 积均为100mL且电解前后溶液体积变化及气体的溶解忽略不计) A.13、7、1 B.12、7、2 C.1、7、13 D.7、13、1 二、填空题 19.已知室温时,0.1 mol·L-1的某一元酸HA在水中有 0.1% 发生电离,回答下列各问题: (1)该溶液的pH=________。 (2)HA的电离平衡常数K=________。 (3)升高温度时,K将______(填“增大”、“减小”或“不变”),pH将______(填“增大”、“减小”或“不变”)。 (4)由HA电离出的c(H+)约为水电离出的c(H+)的________倍。 20.如下图设计的串联电池装置,R为变阻器,以调节电路电流。 (1) 写出b、c电极的电极反应式:b______________________,c__________________________; (2)写出f电极的电极反应式____________________,向此电极区域滴入酚酞的现象为: ______________________________________________________________________________; 该电极区域水的电离平衡被_________________(填“促进”、“抑制”或“无影响”)。 (3)闭合K一段时间后,丙装置的电解质溶液pH__________(填“变大”、“变小”或“不变”),原因是_____________________________________________________________________________。 (4)电解一段时间后丙装置析出芒硝(Na2SO4·10H2O),若此时通入CH4的体积为22.4L(标准状况下),则向丙装置中加入______g H2O就可以将析出沉淀溶解并恢复到原有浓度。 21.某学生用0.200 0 mol·L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作如下: ①用蒸馏水洗涤碱式滴定管,并立即注入NaOH溶液至“0”刻度线以上; ②固定好滴定管并使滴定管尖嘴处充满液体; ③调节液面至“0”或“0”刻度线以下,并记下读数; ④移取20. 00 mL待测液注入洁净的还存有少量蒸馏水的锥形瓶中,并加入3滴酚酞溶液; ⑤用标准液滴定至终点,记下滴定管液面读数。 请回答下列问题: (1)以上步骤有错误的是______(填编号)。若测定结果偏高,其原因可能是________(填字母)。 A.配制标准溶液的固体NaOH中混有KOH杂质 B.滴定终点读数时,仰视滴定管的刻度,其他操作正确 C.盛装未知液的锥形瓶用蒸馏水洗过后再用未知液润洗 D.滴定到终点读数时,发现滴定管尖嘴处悬挂一滴溶液 (2)判断滴定终点的现象是_____________________________________。 (3)如图是某次滴定时的滴定管中的液面,其读数为________mL。 (4)根据下列数据,请计算待测盐酸的浓度:________mol·L-1。 滴定次数 待测体积(mL) 标准烧碱溶液体积(mL) 滴定前读数 滴定后读数 第一次 20.00 0.40 20.40 第二次 20.00 2.00 24.10 第三次 20.00 4.00 24.00 22.已知多元弱酸在水溶液中的电离是分步进行的,且第一步的电离程度大于第二步的电离程度,第二步的电离程度远大于第三步的电离程度……今有HA、H2B、H3C三种弱酸,根据“较强酸 + 较弱酸盐 = 较强酸盐 + 较弱酸”的反应规律,它们之间能发生下列反应: ①HA + HC2—(少量) = A—+ H2C— ②H2B(少量) + 2A— = B2— + 2HA ③H2B(少量) + H2C— = HB— + H3C 回答下列问题: (1)相同条件下,HA、H2B、H3C三种酸中,酸性最强的是_____________。 (2)A—、B2—、C3—、HB—、H2C—、HC2—六种离子中,最易结合质子(H+)的是_________,最难结合质子的是____________。 (3)下列反应的离子方程式正确的是____________。 A.H3C +3A— = 3HA + C3— B.HB— +A— = HA + B2— (4)完成下列反应的离子方程式: ①H3C + OH—(过量)——__________________;②HA(过量) + C3— ——_____________________。 2017级高二上10月月考化学答案 选择题(每个3分,共54分) 题号 1 2 3 4 5 6 7 8 9 选项 B C C C B C C D C 题号 10 11 12 13 14 15 16 17 18 选项 B B A D D C D D A 以下除特殊标注外,每空2分。 19.4,1×10-7,增大,减小,106 20.(1)O2+4H++4e-=2H2O CH4+10OH--8e-=CO32-+7H2O (2)2H++2e-=H2↑,溶液变红,促进(1分) (3)不变(1分), 硫酸钠为强酸强碱盐,用惰性电极电解,实质是电解水,所以pH不变 (4)72 21.(1)① ABCD (2)滴入最后一滴NaOH溶液时,溶液刚好由无色变为粉红色,且半分钟内不变色 (3)22.60 (4)0.200 0 22.(1)H 2B (2)C 3- HB – (3)B (4)H3C+3OH -(过量)= C 3-+3H 2O 2HA(过量)+C 3- = 2A—,+H 2C -查看更多