江苏省南通市泰州市2020届高三上学期期末考试 化学
2020届高三模拟考试试卷
化 学2020.1
本试卷包括第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分。满分120分,考试时间100分钟。
可能用到的相对原子质量:H—1 C—12 N—14 O—16 F—19 Na—23 V—51
第Ⅰ卷(选择题 共40分)
单项选择题:本题包括10小题,每小题2分,共20分。每小题只有一个选项符合题意。
1. 化妆品中添加甘油可以起到保湿作用。甘油中一定含有的元素有( )
A. 氯 B. 氧 C. 硫 D. 磷
2. 反应CO2+2NH3CO(NH2)2+H2O可应用于工业合成尿素。下列表示反应中相关微粒的化学用语正确的是( )
A. 中子数为8的碳原子:C B. NH3的电子式:
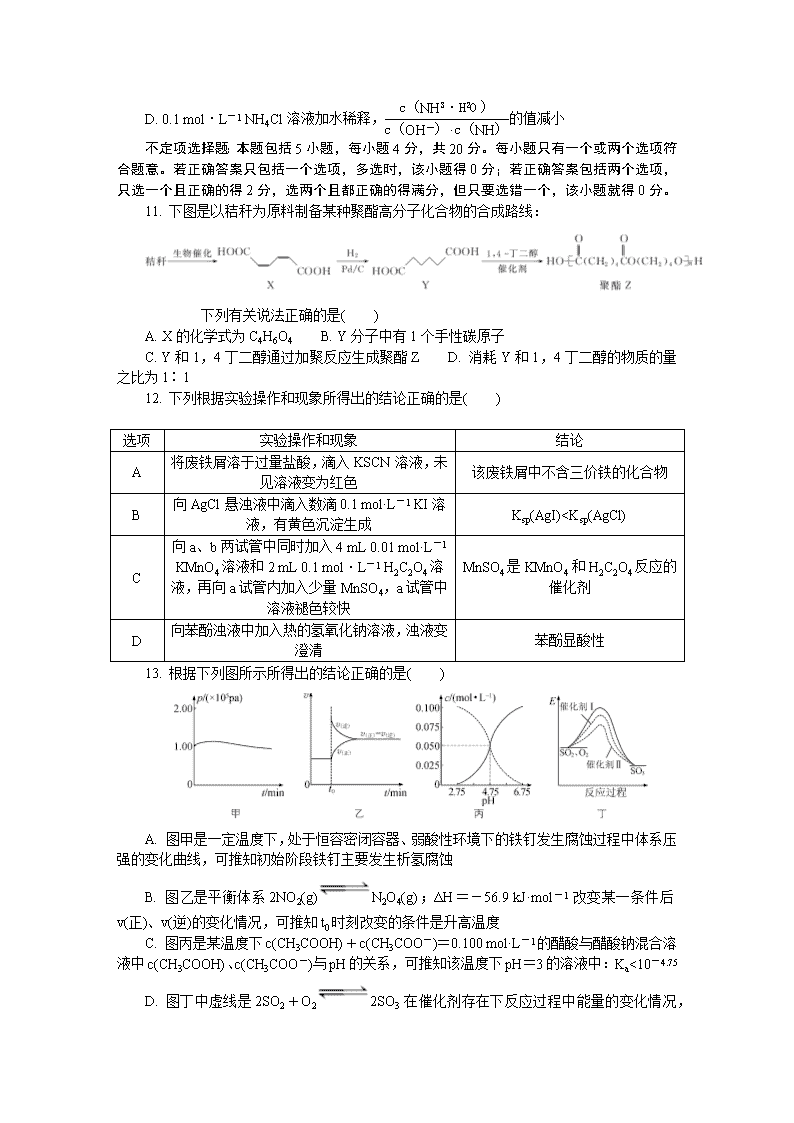
C. 氧原子的结构示意图: D. CO(NH2)2的结构简式:
3. 下列有关物质的性质与用途具有对应关系的是( )
A. Al2O3熔点高,可用作耐高温材料 B. SO2有氧化性,可用作葡萄酒抗氧化剂
C. 小苏打能与碱反应,可用作抗酸药 D. NH4Cl受热易分解,可用作化肥
4. 室温下,下列各组离子在指定溶液中能大量共存的是( )
A. 0.1 mol·L-1 HCl溶液:NH、Na+、NO、SO
B. 0.1 mol·L-1 KOH溶液:Na+、Ca2+、AlO、SiO
C. 0.1 mol·L-1 NaHCO3溶液:K+、Cu2+、OH-、MnO
D. 0.1 mol·L-1 NaClO溶液:Mg2+、Fe2+、I-、S2-
5. 下列指定反应的离子方程式正确的是( )
A. 将Cl2通入热的NaOH溶液:Cl2+6OH-Cl-+ClO+3H2O
B. 用醋酸除水垢:2CH3COOH+CO===2CH3COO-+H2O+CO2↑
C. 酸性FeSO4溶液长期放置发生变质:4Fe2++O2+4H+===4Fe3++2H2O
D. 向NH4HCO3溶液中加入过量NaOH溶液并加热:NH+OH-NH3↑+H2O
6. 下列图示装置和原理能达到实验目的的是( )
A. 用装置甲制取并收集氨气 B. 用装置乙制取无水氯化镁
C. 用装置丙除去氯气中的氯化氢 D. 用装置丁分离苯和四氯化碳
7. 在给定条件下,下列选项所示的物质间转化均能实现的是( )
A. CaCl2(aq)CaCO3CaO
B. NaNa2ONaOH
C. (C6H10O5)n(淀粉)C6H12O6(葡萄糖)C2H5OH
D. Cu2SCuCuSO4
8. 右图是一种电解质溶液可以循环流动的新型电池。下列说法正确的是( )
A. Cu电极为正极
B. PbO2电极反应式为PbO2+2e-+4H+===Pb2++2H2O
C. 放电后循环液中H2SO4与CuSO4物质的量之比变小
D. 若将Cu换成Pb,则电路中电子转移方向改变
9. 短周期主族元素X、Y、Z、W原子序数依次增大,X是非金属性最强的元素,Y是地壳中含量最高的金属元素,Y、Z处于同一周期且相邻,W原子最外层电子比内层电子少3个。下列说法正确的是( )
A. 原子半径:r(X)
c(H+)>c(HCN)>c(CN-)
B. 向0.1 mol·L-1 NaHC2O4溶液中加入NaOH溶液至pH=7:
c(Na+)<2[c(HC2O)+c(C2O)+c(H2C2O4)]
C. 0.1 mol·L-1 NaCN溶液与0.1 mol·L-1 NaHC2O4溶液的比较:
c(CN-)v(正)
第Ⅱ卷(非选择题 共80分)
16. (12分)铁红(Fe2O3)常用于油漆、油墨及橡胶工业。工业上以一定质量的硫铁矿烧渣(主要成分为Fe2O3、Fe3O4,另含少量难溶杂质)为主要原料制备铁红的一种工艺流程如下:
已知:某些过渡元素(如Cu、Fe、Ag等)的离子能与NH3、H2O、OH-、SCN-等形成可溶性配合物。
(1) 工业常将硫铁矿烧渣经过粉碎后再进行“酸浸”,其目的是________。
(2) “酸浸”时加入的硫酸不宜过量太多的原因是________。
(3) “过滤1”所得滤液中含有的阳离子有________。
(4) “沉淀”过程中,控制NH4HCO3用量不变,铁的沉淀率随氨水用量变化如右图所示。当氨水用量超过一定体积时,铁的沉淀率下降。其可能的原因是________。
(5) “过滤2”所得滤渣的主要成分为FeOOH和FeCO3,所得滤液中的主要溶质是________(填化学式)。
(6) 写出FeCO3在空气中焙烧生成铁红的化学方程式:________。
17. (15分)化合物G对白色念珠菌具有较强的抑制作用。G可经下图所示合成路线制备:
请回答下列问题:
(1) A→B的反应类型是________。
(2) E中含氧官能团的名称为________和________。
(3) C与B互为同分异构体,能与小苏打反应放出CO2,且能与SOCl2发生取代反应生成D。写出C的结构简式:________。
(4) 写出同时满足下列条件的D的一种同分异构体的结构简式:________。(不考虑立体异构)
①含有—SH结构;
②能在酸性条件下发生水解反应,两种水解产物均含有三种不同环境的H原子。其中一种水解产物既能遇FeCl3溶液显色,又能与Br2的CCl4溶液发生加成反应。
(5) 写出以甲苯和乙醇为原料制备的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)。
18. (12分)某十钒酸铵[(NH4)xH6-xV10O28·yH2O(其中钒为+5价)]常用来制造高端钒铝合金。
Ⅰ. (NH4)xH6-xV10O28·yH2O的制备
将NH4VO3溶于pH为4的弱酸性介质后,加入乙醇,过滤得到(NH4)xH6-xV10O28·yH2O晶体。乙醇的作用是____________________________________。
Ⅱ. (NH4)xH6-xV10O28·yH2O的组成测定
(1) NH含量测定
准确称取0.363 6 g该十钒酸铵晶体,加入蒸馏水和NaOH溶液,加热煮沸,生成的氨气用20.00 mL 0.100 0 mol·L-1盐酸标准溶液吸收。用等浓度的NaOH标准溶液滴定过量盐酸,消耗NaOH标准溶液8.00 mL。
(2) V10O(M=958 g·mol-1)含量测定
步骤1:准确称取0.363 6 g该十钒酸铵晶体,加入适量稀硫酸,微热使之溶解。
步骤2:加入蒸馏水和NaHSO3,充分搅拌,使V10O完全转化为VO2+。
步骤3:加适量稀硫酸酸化,加热煮沸,除去溶液中+4价硫。
步骤4:用0.020 00 mol·L-1 KMnO4标准溶液滴定,终点时消耗30.00 mL KMnO4标准溶液(该过程中钒被氧化至+5价,锰被还原至+2价)。
①写出步骤2反应的离子方程式:____________________________________。
②若未进行步骤3操作,则数值y将________(填“偏大”“偏小”或“无影响”)。
③通过计算确定该十钒酸铵晶体的化学式(写出计算过程)。
19. (15分)氟铝酸钠(Na3AlF6)是工业炼铝中重要的含氟添加剂。实验室以氟石(CaF2)、石英和纯碱为原料模拟工业制备氟铝酸钠的流程如下:
(1) “煅烧”时,固体药品混合后应置于________(填仪器名称)中加热。
(2) 通过控制分液漏斗的活塞可以调节添加液体的速率。调溶液pH接近5时,滴加稀硫酸的分液漏斗的活塞应如下图中的________(填序号)所示。
(3) 在酸性废水中加入Al2(SO4)3Na2SO4混合溶液,可将废水中F-转换为氟铝酸钠沉淀。
① 该混合溶液中,Al2(SO4)3与Na2SO4的物质的量之比应≥________(填数值)。
②在不改变其他条件的情况下,加入NaOH调节溶液pH。实验测得溶液中残留氟浓度和氟去除率随溶液pH的变化关系如右图所示。pH>5时,溶液中残留氟浓度增大的原因是________。
(4) 若用CaCl2作为沉淀剂除去F-,欲使F-浓度不超过0.95 mg·L-1,c(Ca2+)至少为________mol·L-1。[Ksp(CaF2)=2.7×10-11]
(5) 工业废铝屑(主要成分为铝,少量氧化铁、氧化铝)可用于制取硫酸铝晶体[Al2(SO4)3·18H2O]。
①请补充完整由废铝屑为原料制备硫酸铝晶体的实验方案:取一定量废铝屑,放入烧杯中,____________________________________________________________,得硫酸铝晶体。
[已知:pH=5时,Al(OH)3沉淀完全;pH=8.5时,Al(OH)3沉淀开始溶解。须使用的试剂:3 mol·L-1 H2SO4溶液、2 mol·L-1 NaOH溶液、冰水]
②实验操作过程中,应保持强制通风,原因是________。
20. (14分)烟气中通常含有高浓度SO2、氮氧化物及粉尘颗粒等有害物质,在排放前必须进行脱硫脱硝处理。
(1) 利用甲烷可将氮氧化物还原为氮气除去。已知:
2NO(g)+O2(g)===2NO2(g);ΔH=a kJ·mol-1
CH4(g)+2O2(g)===CO2(g)+2H2O(g);ΔH=b kJ·mol-1
CH4(g)+2NO2(g)===N2(g)+CO2(g)+2H2O(g);ΔH=c kJ·mol-1
反应CH4(g)+4NO(g)===2N2(g)+CO2(g)+2H2O(g);ΔH=________ kJ·mol-1。
(2) H2O2在催化剂αFeOOH的表面上,分解产生·OH。·OH较H2O2和O2更易与烟气中的NO、SO2发生反应。反应后所得产物的离子色谱如图1所示。
①写出·OH氧化NO的化学反应方程式:________。
②当H2O2浓度一定时,NO的脱除效率与温度的关系如图2所示。升温至80 ℃以上,大量汽化的H2O2能使NO的脱除效率显著提高的原因是______________________________,温度高于180 ℃,NO的脱除效率降低的原因是________。
(3) 工业可采用亚硫酸钠作吸收液脱除烟气中的二氧化硫。应用双阳离子交换膜电解技术可使该吸收液再生,同时得到高浓度SO2,其工作原理如图3所示。
① SO2气体在________(填“Ⅰ”“Ⅱ”或“Ⅲ”)室生成。
②用离子方程式表示吸收液再生的原理:________。
(4) 新型纳米材料氧缺位铁酸盐(ZnFe2Ox)能将烟气中SO2分解除去,若1 mol ZnFe2Ox与足量SO2生成1 mol ZnFe2O4和0.5 mol S,则x=________。
21. (12分)【选做题】本题包括A、B两小题,请选定其中一小题作答。若多做,则按A小题评分。
A. [物质结构与性质]
由硝酸锰[Mn(NO3)2]制备的一种含锰催化剂,常温下能去除甲醛、氢氰酸(HCN)等有毒气体。
(1) Mn2+基态核外电子排布式是________________。NO的空间构型为__________________(用文字描述)
(2) 甲醛分子中,碳原子的杂化方式为________。
(3) HCN分子中σ键与π键的数目比为________。H、C、N三种元素的电负性由大到小的顺序为________。
(4) 硝酸锰受热可分解生成NO2和某种锰的氧化物。该氧化物晶胞结构如右图所示。写出硝酸锰受热分解的化学方程式:__________________________。
B. [实验化学]
实验室用氧化锌作催化剂、以乙二醇和碳酸氢钠为复合解聚剂常压下快速、彻底解聚聚对苯二甲酸乙二醇酯,同时回收对苯二甲酸和乙二醇。反应原理如下:
实验步骤如下:
步骤1:在题图1所示装置的四颈烧瓶内依次加入洗净的矿泉水瓶碎片、氧化锌、碳酸氢钠和乙二醇,缓慢搅拌,油浴加热至180 ℃,反应0.5 h。
步骤2:降下油浴,冷却至160 ℃,将搅拌回流装置改为图2所示的搅拌蒸馏装置,水泵减压,油浴加热蒸馏。
步骤3:蒸馏完毕,向四颈烧瓶内加入沸水,搅拌。维持温度在60 ℃左右,抽滤。
步骤4:将滤液转移至烧杯中加热煮沸后,趁热边搅拌边加入盐酸酸化至pH为1~2。用砂芯漏斗抽滤,洗涤滤饼数次直至洗涤滤液pH=6,将滤饼摊开置于微波炉中微波干燥。
请回答下列问题:
(1) 步骤1中将矿泉水瓶剪成碎片的目的是______________________________。
(2) 步骤2中减压蒸馏的目的是____________________,蒸馏出的物质是________。
(3) 抽滤结束后停止抽滤正确的操作方法是________。若滤液有色,可采取的措施是________。
(4) 该实验中,不采用水浴加热的原因是________。
2020届高三模拟考试试卷(南通、泰州)
化学参考答案及评分标准
1. B 2. D 3. A 4. A 5. C 6. C 7. C 8. C 9. D 10. B 11. D 12. BC 13. A 14. BC 15. AD
16. (12分,每空2分)
(1) 增大反应物接触面积,加快反应速率,提高烧渣浸出率
(2) 过量太多会增加沉淀过程氨水的用量
(3) Fe2+、Fe3+、H+
(4) 氨水与铁的氢氧化物反应生成可溶性配合物
(5) (NH4)2SO4 (6) 4FeCO3+O22Fe2O3+4CO2
17. (15分)
(1) 加成反应(2分) (2) 羰基(2分) 酯基(2分)
(3) (2分)
(5)(5分)
18. (12分)
Ⅰ. 促进十钒酸铵晶体的析出(2分)
Ⅱ. ① 5HSO+V10O+21H+===10VO2++5SO+13H2O(2分) ② 偏小(2分)
③ n(NH)==1.2×10-3 mol
n(V10O)=×=3.0×10-4 mol
x==4(2分)
n(H2O)==3.0×10-3 mol
y==10(2分)
该十钒酸铵晶体的化学式为(NH4)4H2V10O28·10H2O(2分)
19. (15分)
(1) 铁坩埚(2分) (2) ②(2分)
(3) ①(2分) ② OH-与Al3+结合能力强于F-与Al3+结合能力(2分)
(4) 0.010 8(2分)
(5) ① 加入2 mol·L-1 NaOH溶液反应至不再有气泡生成,过滤;(1分)
向滤液中加入3 mol·L-1 H2SO4,调pH至5~8.5,过滤,洗涤滤渣2~3次;(1分)
将滤渣转移至烧杯中,加入3 mol·L-1 H2SO4至恰好完全溶解;(1分)
将溶液蒸发浓缩,冷却结晶,过滤,用少量冰水洗涤,干燥(1分)
②防止H2与O2混合爆炸(1分)
20. (14分,每空2分)
(1) 2a+2c-b
(2) ① 3·OH+NO===HNO3+H2O
② H2O2与催化剂的接触更好,产生更多的·OH,·OH浓度增大,与NO混合更充分
180 ℃以后,·OH分解成O2和H2O,NO的脱出效率下降
(3) ①Ⅱ ② OH-+HSO===SO+H2O
(4) 3
21A. (12分,每空2分)
(1) [Ar]3d5 平面正三角形
(2) sp2
(3) 1∶1 N>C>H
(4) Mn(NO3)2MnO2+2NO2↑
21B. (12分,每空2分)
(1) 增大接触面积,加快解聚速率,且有利于搅拌
(2) 降低蒸馏温度,防止引起副反应 乙二醇
(3) 拔下抽气泵与吸滤瓶间的橡皮管,再关闭抽气泵 加入活性炭脱色
(4) 水浴温度不能超过100 ℃