- 2021-08-07 发布 |
- 37.5 KB |
- 13页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2017-2018学年宁夏石嘴山市第三中学高二下学期期中考试化学试题 Word版
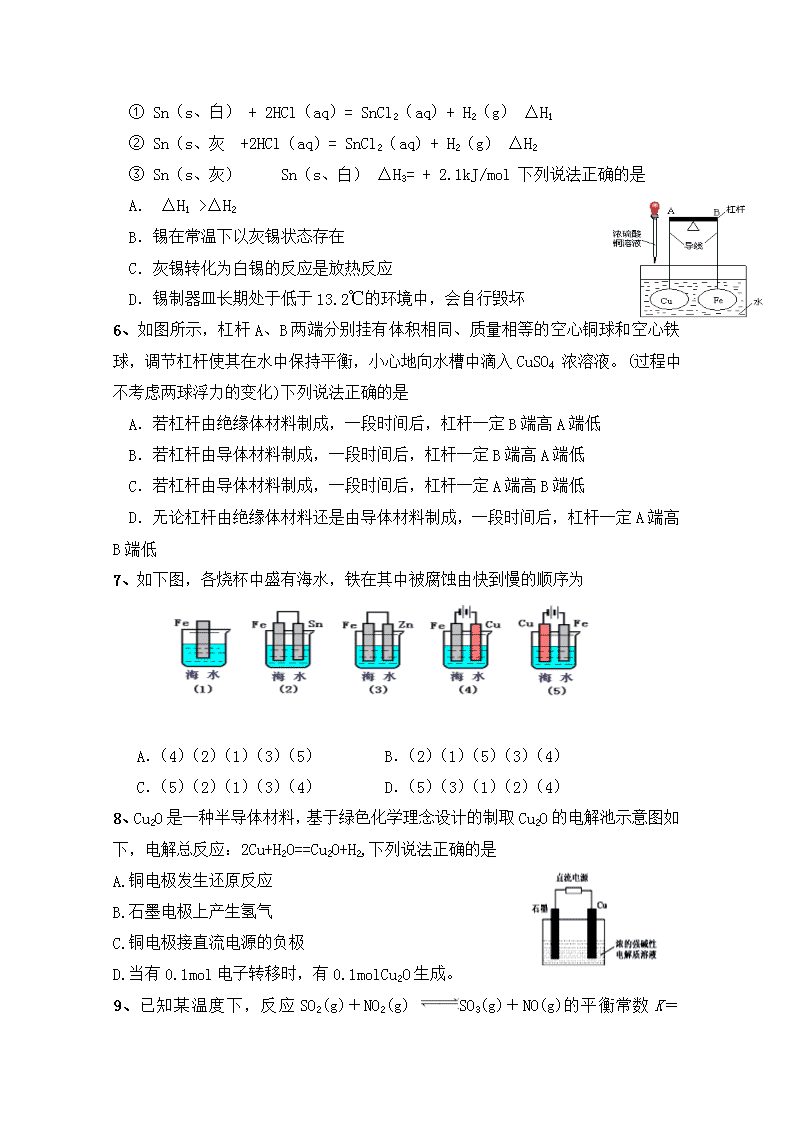
2017-2018学年宁夏石嘴山市第三中学高二下学期期中考试化学试卷 2018. 5 可能用到的相对原子质量有:C-12 Cl-35.5 Cu-64 Ag-108 一、选择题(每小题只有一个选项符合题意,每小题2分,共50分) 1、下列反应均为吸热反应,其中一定不能自发进行的是 A.(NH4)2CO3(s)=NH4HCO3(s)+NH3(g) B.2N2O5(g)=4NO2(g)+O2(g) C.MgCO3(s)=MgO(s)+CO2(g) D.2CO(g)=2C(s)+O2(g) 2、 某反应过程中能量变化如下图所示(图中E1表示正反应的活化能,E2表示逆反应的活化能)。下列有关叙述正确的是 A.该反应为放热反应 B.催化剂能改变反应的焓变 C.活化分子间发生的碰撞都为有效碰撞 D.正反应的焓变为E1-E2 3、在测定中和热的实验中,下列说法正确的是 A.可以使用不同的温度计,温度计的水银球放在液面上方,快速读出最高温度 B.为了准确测定反应混合液的温度,温度计水银球应与小烧杯底部接触 C.用0.5 mol·L-1 Ba(OH)2溶液分别与0.5 mol·L-1的盐酸、硫酸溶液反应,如所取的溶液体积相等,则测得的中和热数值相同 D.在实验过程中,通常氢氧化钠溶液过量以保证盐酸完全中和,减小实验误差 4、下列各组热化学方程式中,化学反应的ΔH前者大于后者的是 ①C(s)+O2(g)===CO2(g) ΔH1 C(s)+ O2(g)===CO (g) ΔH2 ②S(s)+O2(g)===SO2(g) ΔH3 S(g)+O2(g)===SO2(g) ΔH4 ③H2(g)+ O2(g)===H2O(l) ΔH5 2H2(g)+O2(g)===2H2O(l) ΔH6 ④CaCO3(s)===CaO(s)+CO2(g)ΔH7 CaO(s)+H2O(l)===Ca(OH)2(s) ΔH8 A.①② B.②③ C.②③④ D.①②③ 5、灰锡(以粉末状存在)和白锡是锡的两种同素异形体,已知: ① Sn(s、白) + 2HCl(aq)= SnCl2(aq)+ H2(g) △H1 ② Sn(s、灰 +2HCl(aq)= SnCl2(aq)+ H2(g) △H2 ③ Sn(s、灰) Sn(s、白) △H3= + 2.1kJ/mol 下列说法正确的是 A. △H1 >△H2 B.锡在常温下以灰锡状态存在 C.灰锡转化为白锡的反应是放热反应 D.锡制器皿长期处于低于13.2℃的环境中,会自行毁坏 6、如图所示,杠杆A、B两端分别挂有体积相同、质量相等的空心铜球和空心铁球,调节杠杆使其在水中保持平衡,小心地向水槽中滴入CuSO4 浓溶液。(过程中不考虑两球浮力的变化)下列说法正确的是 A.若杠杆由绝缘体材料制成,一段时间后,杠杆一定B端高A端低 B.若杠杆由导体材料制成,一段时间后,杠杆一定B端高A端低 C.若杠杆由导体材料制成,一段时间后,杠杆一定A端高B端低 D.无论杠杆由绝缘体材料还是由导体材料制成,一段时间后,杠杆一定A端高B端低 7、如下图,各烧杯中盛有海水,铁在其中被腐蚀由快到慢的顺序为 A.(4)(2)(1)(3)(5) B.(2)(1)(5)(3)(4) C.(5)(2)(1)(3)(4) D.(5)(3)(1)(2)(4) 8、Cu2O是一种半导体材料,基于绿色化学理念设计的制取Cu2O的电解池示意图如下,电解总反应:2Cu+H2O==Cu2O+H2,下列说法正确的是 A.铜电极发生还原反应 B.石墨电极上产生氢气 C.铜电极接直流电源的负极 D.当有0.1mol电子转移时,有0.1molCu2O生成。 9、已知某温度下,反应SO2(g)+NO2(g) SO3(g)+NO(g)的平衡常数K =0.24,下列说法正确的是 A.该温度下反应2SO2(g)+2NO2(g) 2SO3(g)+2NO(g)的平衡常数为0.48 B.若该反应ΔH<0,则升高温度化学平衡常数K减小 C.若升高温度,逆反应速率减小 D. 改变条件使平衡正向移动,则平衡时n(NO2)/n(NO)一定比原平衡小 10、有一处于平衡状态的反应X(g) +3Y(g)2Z(g) (正反应是放热反应) 。为了使平衡向生成Z的方向移动, 应选择的条件是 ①升高温度 ②降低温度 ③增大压强 ④降低压强 ⑤加入正催化剂 ⑥分离出Z A.①③⑤ B.②③⑤ C.②③⑥ D.②④⑥ 11、 在4 L密闭容器中充入6 mol A气体和5 mol B气体,在一定条件下发生反应:3A(g)+B(g) 2C(g)+xD(g),达到平衡时,生成了2 mol C,D的浓度为0.5 mol·L -1 ,下列判断正确的是 A.x=1 B.B的转化率为20% C.平衡时A的浓度为1.50 mol·L -1 D.达到平衡时,在相同温度下容器内混合气体的压强是反应前的85% 12、一定温度下,可逆反应2NO2 2NO+O2在体积固定的密闭容器中反应,达到平衡状态的标志的是 ①单位时间内生成n mol O2,同时生成2n mol NO2、 ②混合气体的压强不再改变 ③混合气体的平均相对分子质量不再改变 ④单位时间内生成n mol O2,同时生成2n mol NO ⑤混合气体的密度不再改变 ⑥用NO2、NO、O2的物质的量浓度变化表示的反应速率的比为2:2:1 A.①④⑤ B.①②③ C.①③⑤ D.②③⑥ 13、如图所示,下列说法错误的是 A.从E口逸出的气体是H2 B.从B口加入含少量NaOH的水溶液以增强导电性 C.标准状况下每生成22. 4 L Cl2,同时产生2 mol NaOH D.粗盐水中含Ca2+、Mg2+、Fe3+、SO42-等,精制时先加Na2CO3溶液 14、用惰性电极实现电解,下列说法正确的是 A.电解稀硫酸溶液,实质上是电解水,故溶液pH不变 B. 电解稀氢氧化钠溶液,要消耗OH-,故溶液pH减小 C.电解硫酸钠溶液,在阴极上和阳极上析出产物的物质的量之比为1:2 D.电解氯化铜溶液,在阴极上和阳极上析出产物的物质的量之比为1:1 15、用惰性电极电解一定浓度的硫酸铜溶液,通电一段时间,向所得溶液中加入0.1mol Cu2(OH)2CO3后恰好恢复到电解前的浓度和pH(不考虑氧气溶解).则电解过程中共转移的电子数为 A.0.4mol B.0.5mol C.0.6mol D.0.8mol 16、金属镍有广泛的用途.粗镍中含有少量Fe、Zn、Cu、Pt等杂质,可用电解法制备高纯度的镍,下列叙述正确的是(已知:氧化性Fe2+<Ni2+<Cu2+) A.阳极发生还原反应,其电极反应式:Ni2++2e-===Ni B.电解过程中,阳极质量的减少与阴极质量的增加相等 C.电解后,溶液中存在的金属阳离子只有Fe2+和Zn2+ D.电解后,电解槽底部的阳极泥中只有Cu和Pt 17、实验室用铅蓄电池作电源电解饱和食盐水制取氯气,已知铅蓄电池放电时发生如下反应:负极Pb+-2e-===PbSO4,正极PbO2+4H+++2e-===PbSO4+2H2O。今若制得Cl2 0.050 mol,这时电池内消耗的H2SO4的物质的量至少是 A.0.025 mol B.0.050 mol C.0.10 mol D.0.20 mol 18、化学反应A+B→C(△H<0)分两步进行:①A+B→X(△H>0),②X→C(△H<0)。下列示意图中,能正确表示总反应过程中能量变化的是 19、已知H2(g)、C2H4(g)和C2H5OH(l)的燃烧热分别是-285.8kJ·mol-1、-1411.0kJ·mol-1和-1366.8kJ·mol-1,则由C2H4(g)和H2O(l)反应生成C2H5OH(l)的△H为是 A.-44.2kJ·mol-1 B.-55.4 kJ·mol- C.-33.0kJ·mol-1 D.-69.8kJ·mol-1 20、高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为:3Zn+2K2FeO4+8H2O3Zn(OH)2+2Fe(OH)3+4KOH 下列叙述不正确的是 A.放电时负极反应为:Zn-2e-+2OH-===Zn(OH)2 B.充电时阳极反应为:Fe(OH)3-3e-+5OH-===FeO+4H2O C.放电时每转移3 mol电子,正极有1 mol K2FeO4被氧化 D.放电时正极附近溶液的碱性增强 21、对于可逆反应A(g)+2B(g)2C(g)(正反应吸热),下列图象中正确的是 22、某密闭容器中发生如下反应:X(g)+3Y(g) 2Z(g) ΔH<0。下图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量。下列说法中正确的是 A.t2时加入催化剂 B.t3时降低了温度 C.t5时增大了压强 D.t4~t5时间内转化率一定最低 23、向某恒容密闭容器中充入一定量CO2和H2,发生反应:CO2(g)+H2(g)HCOOH(g),测得平衡体系中CO2的百分含量(CO2%)与反应温度变化的关系如图所示.下列物理量中,a点大于b点的是 ①.正反应速率 ②.逆反应速率 ③.HCOOH(g)的浓度 ④.对应温度时的平衡常数 A.①② B.①③ C.②④ D.③④ 24、一种新型燃料电池,一极通入空气,另一极通入丁烷气体;电解质是掺杂氧化钇(Y2O3)的氧化锆(ZrO2)晶体,在熔融状态下能传导O2- 。下列对该燃料电池的说法正确的是 A.电池反应为2C4H10+13O2===8CO2+10H2O B.在熔融电解质中,O2-由负极移向正极 C.通入空气的一极是正极,电极反应为O2+4e-===2O2- D.通入丁烷的一极是正极,电极反应为C4H10+26e-+13O2-===4CO2+5H2O 25.在10L恒容密闭容器中充入X(g)和Y(g),发生反应X(g)+Y(g)M(g)+N(g),所得实验数据如下表: 实验 编号 温度/℃ 起始时物质的量/mol 平衡时物质的量/mol n(X) n(Y) n(M) ① 700 0.40 0.10 0.090 ② 800 0.10 0.40 0.080 ③ 800 0.20 0.30 a ④ 900 0.10 0.15 b 下列说法正确的是 A.实验①中,若5min时测得n(M)=0.050mol,则0至5min时间内,用N表示的平均反应速率υ(N)=1.0×10-2mol/(L·min) B.实验②中,该反应的平衡常数K=2.0 C.实验③中,达到平衡是,X的转化率为60% D.实验④中,达到平衡时,b>0.06 二 填空题(70分) 26.(14分)(1)在一密闭容器里,通入x mol H2(g)和y mol I2(g),发生反应:H2(g)+I2(g)⇌2HI(g)△H<0.改变下列条件,反应速率将如何改变(选填“增大”“减小”或“不变”) ①升高温度_______②保持容器中压强不变,充入氖气________ ③保持压强不变,充入2x mol H2(g)和2y mol I2(g)________. (2)在400℃,1.01X105Pa时,将SO2和14molO2 压入一个装有催化剂的2L密闭反应器中,发生2SO2+O22SO3的反应,并且在10min后达到平衡,测得容器内有2molSO2和12molO2 。 ①SO2的转化率为________,O2的平均反应速率为________; ②平衡时SO3(气)占总体积的百分数为______,此时体系压强为反应起始时体系压强的_______倍 (3)现有反应:mA(g)+nB(g)pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数也减小,则: ①该反应的逆反应为_________热反应,且m+n_______p(填“>”“=”“<”)。 ②减压时,A的质量分数_________。(填“增大”“减小”或“不变”,下同) ③若加入B(保持体系体积不变),则A的转化率_________,B的转化率______ ④若B是有色物质,A、C均无色,则加入C(体积不变)时混合物颜色_______,而维持容器内压强不变,充入氖气时混合物颜色_______(填“变深”“变浅”或“不变”) 27.(12分)(1)电子工业中清洗硅片上SiO2(s)的反应是: SiO2(s)+4HF(g)=SiF4(g)+2H2O(g) ΔH(298K)=-94.0kJ・mol-1 ΔS(298K)=-75.8J・mol-1・K-1 设ΔH和ΔS不随温度而改变则此反应可自发进行的温度条件是____________ (2) 家用液化石油气的主要成分之一是丁烷(C4H10),当10 g丁烷完全燃烧并生成二氧化碳气体和液态水时,放出的热量为500 kJ。写出丁烷燃烧的热化学方程式 。 (3)已知拆开1 mol H-H键,1 molN-H键,1 molN≡N键分别需要的能量是akJ、bkJ、ckJ,则N2与H2反应生成NH3的热化学方程式 (4)利用右图装置,可以模拟铁的电化学防护 ①开关K断开时,且若为生铁,则铁件主要发生 腐蚀,其正极电极反应式为 若X为碳棒,为减缓铁件的腐蚀,开关K应置于 处。 ②若X为锌,开关K置于M处,该电化学防护法称为 。 ③右图中若X为粗铜(含锌等杂质),容器中海水替换为硫酸铜溶液,开关K置于N处,一段时间后,当铁件质量增加127 g时,X电极溶解的铜的质量 127 g(填“<”“>”或“=” )。铁件表面镀铜可有效防止铁被腐蚀,如果铁件部分未镀上铜,或镀层破损,镀铜铁比镀锌铁反而更易被腐蚀,请简要说明原因: 28.(12分)某兴趣小组的同学用下图所示装置研究有关电化学的问题。当闭合该装置的电键时,观察到电流表的指针发生了偏转。请回答下列问题: (1)写出电极反应:Cu极 ;C极 (2)当甲中产生0.1 mol气体时,乙中析出铜的质量应为 乙中产生气体在标准状况下的体积应为 (3)若乙中溶液不变,将其电极都换成铜电极,电键闭合一段时间后,乙中溶液的颜色_____(填“变深”、“变浅”或“无变化”)。 (4)若乙中电极不变,将其溶液换成NaCl溶液,电键闭合一段时间后,甲中溶液的pH将 (填“增大”、“减小”或“不变”,下同);乙中溶液的pH将________。 (5)有如下图电解装置,图中B装置盛1 L 2 mol·L-1 Na2SO4溶液,A装置中盛1 L 2 mol·L-1 AgNO3溶液。通电后,湿润的KI淀粉试纸的C端变蓝色,电解一段时间后,试回答: ①A中发生反应的化学方程式为 ②在B中观察到的现象是 ③室温下,若从电解开始到时间为t时,A、B装置中共收集到气体0.168 L(标准状况),若电解过程中无其他副反应发生,且溶液体积变化忽略不计,则在t时,A溶液中酸的浓度为 29.(8分)(1)工业制氢气的一个重要反应是:CO(g)+ H2O(g) == CO2(g) + H2(g) 已知25℃时:C(石墨) +O2 (g) == CO2(g) △H1 =-394 kJ·mol-1 C(石墨) +1/2O2 (g) == CO (g) △H2 =-111 kJ·mol-1 H2(g) +1/2O2 (g)== H2O(g) △H3=-242kJ·mol-1 试计算25℃时CO(g)+ H2O(g) == CO2(g) + H2(g)的反应热______kJ·mol-1; (2)830K时,在密闭容器中发生下列可逆反应:CO(g)+H2O(g) CO2(g)+H2(g);△H<0 试回答下列问题: ①若起始时c(CO)=2 mol·L-1,c(H2O)=3 mol·L-1 ,达到平衡时CO的转化率为60%,则在该温度下,该反应的平衡常数K= ; ②在相同温度下,若起始时c(CO)=1 mol·L-1,c(H2O)=2 mol·L-1,反应进行一段时间后,测得H2的浓度为0.5 mol·L-1,则此时该反应是否达到平衡状态 (填“是”与“否”),此时v(正) v(逆)(填“大于”“小于”或“等于”),你判断的依据是 ; ③若降低温度,该反应的K值将 ,该反应的化学反应速率将 (均填“增大”“减小”或“不变”) 温度 K1 K2 973 K 1.47 2.38 1 173 K 2.15 1.67 30.(8分)已知化学反应①:Fe(s)+CO2(g)FeO(s)+CO(g),其平衡常数为K1;化学反应②:Fe(s)+H2O(g)FeO(s)+H2(g),其平衡常数为K2, 在温度973 K和1 173 K情况下,K1、K2的值分别如图: (1)通过表格中的数值可以推断:反应①是________(填“吸热” 或“放热”)反应。 (2)现有反应③:CO2(g)+H2(g)CO(g)+H2O(g),请你写出该反应的平衡常数K3的数学表达式:K3=________。 (3)根据反应①与②可推导出K1、K2与K3之间的关系式________,据此关系式及上表数据,也能推断出反应③是________(填“吸热”或“放热”)反应。 (4)要使反应③在一定条件下建立的平衡向正反应方向移动,可采取的措施有________(填写字母序号)。 A.缩小反应容器的容积 B.扩大反应容器的容积 C.升高温度 D.使用合适的催化剂 E.设法减小平衡体系中的CO的浓度 (5)图甲、乙分别表示反应③在t1时刻达到平衡,在t2时刻因改变某个条件而发生变化的情况: ①图甲t2时刻改变的条件是______________________。 ②图乙t2时刻改变的条件是________________________。 31.(16分)利用氧化还原反应可以解决很多实际问题: (1)2KMnO4+10FeSO4+8H2SO4=2MnSO4+5Fe2(SO4)3+K2SO4+8H2O设计如下原电池,其中甲、乙两烧杯中各物质的物质的量浓度均为1 mol·L-1,盐桥中装有饱和K2SO4溶液。回答下列问题: ①发生氧化反应的烧杯是________(填“甲”或“乙”)。 ②外电路的电流方向为:从________到________。(填“a”或“b”) ③电池工作时,盐桥中的SO42—移向________(填“甲”或“乙”)烧杯。 ④)甲烧杯中发生的电极反应______________________________。 (2)工业上处理含Cr2O72-的酸性工业废水常用以下方法:①往工业废水里加入适量的NaCl,搅拌均匀;②用Fe为电极进行电解,经过一段时间有Cr(OH)3和Fe(OH)3沉淀产生;③过滤回收沉淀,废水达到排放标准. ①电解时的电极反应:阳极______,阴极______ . ②Cr2O72-转变成Cr3+的离子反应方程式:______. (3)据报道,最近摩托罗拉公司研发了一种由甲醇和氧气以及强碱做电解质溶液的新型手机电池,电量可达现在使用的镍氢电池或锂电池的十倍,可连续使用一个月才充一次电. ①放电时负极的电极反应为: ; 放电时电解质溶液的pH逐渐 ;(填“增大”或“减小”) ②充电时有CH3OH生成的电极为 极;(填“阴极”或阳极) 充电时每生成1 mol CH3OH转移 mol电子查看更多