- 2021-08-07 发布 |
- 37.5 KB |
- 9页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
【化学】辽宁省沈阳市郊联体2019-2020学年高一下学期期末考试试题
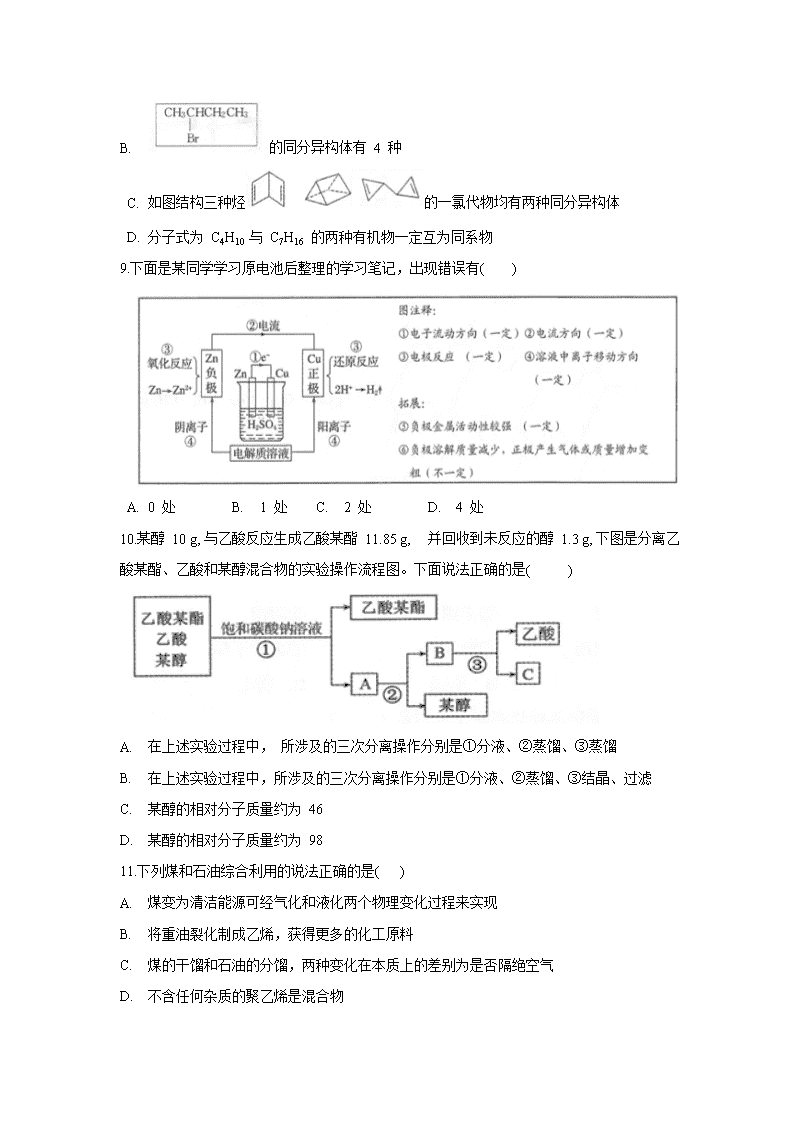
辽宁省沈阳市郊联体2019-2020学年高一下学期期末考试试题 考试时间 70 分钟 试卷总分: 100分 注意事项: 本试卷由第 I 卷和第II卷两部分组成。第 I 卷选择题部分,一律用 2B 铅笔按题号依次填涂在答题卡上.第II 卷非选择题部分,按要求答在答题卡相应位置上。 可能用到的元素相对原子质量: H 1 C l2 N l4 O16 Na23 S32 Zn65 Cu64 第 I 卷 选择题 (48 分) 一、选择题(每小题3 分,共48 分。每小题只有一个选项符合题目要求) 1.下列各组物质,不需要经过化学变化就能够从海水中获得的是( ) A.氯、溴、碘 B. 钠、镁、铝 C. 烧碱、氢气 D 食盐、淡水 2.下列对单质硅的有关叙述正确的是( ) A 晶体硅和金刚石的物理性质相似 B. 晶体硅常温下不与任何物质发生反应 C. 晶体硅是一种良好的半导体材料,但是它的提炼工艺复杂,价格昂贵 D. 硅的化学性质不活泼,在自然界中既有游离态又有化合态 3. 反应 4A(s) + 3 B(g)=2C(g) + D(g) 经 2 min 后, B 的浓度减少了 0.6 mo l • L-1。下列说法正确的是( ) A. 用A 表示的化学反应速率是 0. 4mol• L-1• min-1 B 分别用 B、C、D 表示化学反应速率,其比是3 : 2 : 1 C. 在 2 min 末的反应速率用 B 表示是 0 . 3 mol • L-1• min-1 D 若改变条件 2 min 内 v(D)= 0.2mol • L-1 • min 1, 则反应速率减慢 4.有关金属矿物的开发和利用说法正确的是( ) A. 金属的冶炼肯定发生的是置换反应 B. 金属被人类开发利用的有先后,主要取决于在地壳中的含量多少 C .Ca、Mg、Al 均不能用通常的化学还原剂制得 D. 铝用来焊接钢轨是利用其与氧气反应生成稳定的保护层 5.下列说法正确的是( ) A. 右图实验记录说明淀粉已完全水解 B 蛋白质在浓硝酸的作用下可发生水解反应 C. 含 l mol 葡萄糖的水溶液与足量钠反应, 产生 2.5mol 氢气 D. 植物油与H2加成可以制作人造奶油以及在空气中变质的性质,与其含有的不饱和键有关 6.各种环境污染已成为人类社会所面临的重大威胁。下列七个名词中与环境污染无关的是() ① 温室效应 ②赤潮 ③酸雨 ④光化学烟雾 ⑤臭氧层空洞 ⑥潮汐 ⑦大脖子病 A. ①③ B. ⑥⑦ C . ②⑦ D . ④⑤ 7.下列有关含硫物质转化判断正确的是( ) A.0.1 molCu 与足量的硫充分反应, 生成物的质量比该单质的质量增加了 1.6 g B. 如图是铜与浓硫酸反应的实验装置。B 中盛装的是浓硫酸, 作用是干燥 SO2 C. Cu 投入稀硫酸中加热, 没有明显变化,加入一定量的 H2O2 溶液,金属 Cu 逐渐溶解, 反应中H2O2起催化作用 D . 25.0 mL 0.100 mol• L-1的 Na2S2O3溶液恰好把 224 mL(标况)Cl2 转化为 Cl- , 则 S2O32-将转化为 S 8.下列对有机物结构判断正确的是( ) A. CH3CH=CHC= CCH3 分子中所有碳原子在同一平面, 5 个 碳原子在同一直线上 B. 的同分异构体有 4 种 C. 如图结构三种烃的一氯代物均有两种同分异构体 D. 分子式为 C4H10 与 C7H16 的两种有机物一定互为同系物 9.下面是某同学学习原电池后整理的学习笔记,出现错误有( ) A. 0 处 B. 1 处 C. 2 处 D. 4 处 10.某醇 10 g, 与乙酸反应生成乙酸某酯 11.85 g, 并回收到未反应的醇 1.3 g, 下图是分离乙酸某酯、乙酸和某醇混合物的实验操作流程图。下面说法正确的是( ) A. 在上述实验过程中, 所涉及的三次分离操作分别是①分液、②蒸馏、③蒸馏 B. 在上述实验过程中,所涉及的三次分离操作分别是①分液、②蒸馏、③结晶、过滤 C. 某醇的相对分子质量约为 46 D. 某醇的相对分子质量约为 98 11.下列煤和石油综合利用的说法正确的是( ) A. 煤变为清洁能源可经气化和液化两个物理变化过程来实现 B. 将重油裂化制成乙烯,获得更多的化工原料 C. 煤的干馏和石油的分馏,两种变化在本质上的差别为是否隔绝空气 D. 不含任何杂质的聚乙烯是混合物 12.图示分析是有机化合物学习中的重要方法, 经常用于分子结构和实验的分析。以下 图示判断正确的是( ) 与溴水混合的试剂 四氯化碳 已烯 酒精 现象 A. 图 1 将溴水分别与四氯化碳、已烯、酒精三种试剂混合, 充分振荡后静置,所加试剂与现象均合理 B. 图 2 实验碎瓷片的作用是防止暴沸 C. 一种拉伸强度比钢丝还高的芳纶纤维, 结构片段如图 3, 合成芳纶纤维的小分子化合物为两种 D. 图 4 高分子由乙烯和丙烯加聚生成 13.如图所示,把试管放入盛有 25 °C饱和石灰水的烧杯中,试管中开始放入几小块镁片, 再滴入 5 mL 稀盐酸。该实验的现象记录及结论错误的是( ) A. 试管中观察到的现象是镁片上有大量气泡产生, 镁片逐渐溶解 B.随反应进行烧杯中溶液逐渐变浑浊 C. 有关反应的离子方程式Mg+ 2H+=Mg 2+ +H2 ↑ 、 Ca 2++2OH-=Ca(OH)2 ↓ D. MgCl2 和H2的总键能小于镁片和盐酸的总键能。 14.下列有关化学品合理适用的说法正确的是( ) A. 过多的含磷洗涤剂、尿素进入水体会导致“赤潮”和“水华”现象 B. “胃溃疡”较重患者可服用“小苏打片”或“氢氧化铝片”治疗胃酸过多病症 C. 亚硝酸钠是一种防腐剂和护色剂, 有一定毒性和致癌性, 不能用于食品添加剂 D. 为使头馒色泽白晳, 提高卖相, 商贩可以用硫黄熏蒸 15.Cu2S 和Cu2O混合物共 0.2mol 与 HNO3 溶液恰好完全反应, 生成Cu(NO3)2、H2SO4、NO 和 H2O, 则未被还原的 HNO3 的物质的量是( ) A. 1.0 mol B. 0.8 mol C. 0.4 mol D. 0.2 mol 16.分子中含有羟基的物质都能与钠反应产生氢气。用下图 A、B 组成实验装置测定产生氢气体积,可确定反应的醇的物质的量、生成氢气物质的量与醇分子中羟基数量关系。若用乙醇、乙二醇 ( )、丙三醇 ( )分别与足量金属钠作用, 产 生氢气在相同条件下体积之比为 6 : 2 : 3。则下列判断不正确的是 ( ) A. 装置 A 的分液漏斗与蒸馏烧瓶之间连接的导管可减少测量实验误差 B. 装置 A 的分液漏斗与蒸馏烧瓶之间连接的导管可使钠分液漏斗中的醇顺利滴下 C. 装置B 测定氢气排除水的体积,首先使广口瓶与量筒中液面持平 D. 乙醇、乙二醇、丙三醇的物质的量之比为 3 : 2 : 6 第II 卷 非选择题 ( 52 分) 17. 积极主动学习化学知识,培养提高学科核心素养,发挥化学学科的重要作用,科学、 安全、有效和合理地开发自然资源和使用各种化学品,实现人类可持续发展。以“陆、 海、空”即物质的固 、液 、气三种状态为线索, 理解和记忆一些常识性化学知识是有效的学习方式之一。 ( 1 ) 工业上所说的“三废”是指 。 ( 2 ) 石油经常压蒸馏和减压蒸馏可得到 、 、 三种状态的产品。 ( 3 ) 正常雨水的 pH 约为 5.6, 是因为空气中含有 气体的缘故; 海水中的镁元素处于 (填“游离态”或“化合态”)从海水中提取氯化镁的反应 (填“是”或“不是”)氧化还原反应;无论海水资源还是陆上矿物资源,工业上冶炼镁、钾和钠的常用方法是 。 ( 4) 以乙烯制环氧乙烷, 有两种方法( 环氧乙烷沸点 10 .4, ℃ 与水任意比互溶) 方法 一: 总反应为 CH2=CH 2+Cl2+Ca(OH)2 →+ CaCl2+ H2O 方法二 : 2CH2=CH2+ O2 相对方法一, 方法二通常条件反应混合物状态单 一 , 产物易液化分离, 除此之外的突出优点是: 。 18.某研究性学习小组为探究 SO2 的性质 ,设计如图所示实验装置(装置中的固定仪器和酒精灯均未画出): 请回答下列问题: (l) D、E 两装置中四氯化碳(CCl4)的作用是 。 (2) C 装置中的现象证明 SO2 具有 性。 (3 ) 若将C装置中的试剂换成酸性 KMnO4溶液 ,溶液褪色证明SO2 具有 性。若将 C 装置中的试剂换成 Na2S 溶液 , 有淡黄色沉淀生成证明SO2 具有 性 。 ( 4 ) 对装置 A 中的浓H2SO4和铜片进行加热, 装置 D 中澄清石灰水出现浑浊, 证明 SO2表现了 性质 。 ( 5 ) 实验结束后 ,为了减少环境污染 ,将各装置中的SO2除尽 ,可采取的操作是 。 19.学习有机化学基础, 初步建立“ 组成、结构决定性质”的基本观念, 形成基与官能团、化学键与反应类型认识有机化合物的一般思路, 培养化学学科核心素养。两种无色液体有机物甲和乙, 结构如下图, 根据其结构回答下列问题: (甲: 、 乙: ) ( 1) 有机物甲和乙分子结构中 (填 “是”或“否”)含有同一种官能团。 ( 2 ) 有机物甲的分子式为 , 具有的官能团的名称是 。 ( 3) 如下反应类型①酯化反应 ②加成反应 ③与酸性 KMnO4溶液反应 ④水解反应 ⑤银镜反应 ⑥中和反应,其中有机物甲能发生 ;(填序号,下同) 有机物乙能发生 。 ( 4 ) 甲、乙两种有机物中, 的水溶性较好; 与碳酸氢钠溶液反应生成气体的是 。 20.某兴趣小组依据反应 Zn+ CuSO4=ZnSO4+ Cu 探究原电池设计及工作原理,将质量相等的锌片和铜片用导线相连浸入硫酸铜溶液中构成如图 1 的装置: ( 1 ) 该反应的能量变化可用图 2 ( 填“甲 ” 或“乙”)表示。 ( 2 ) 图 1 连接 K,锌片上的电极反应式为 。 2 min后测得锌片和铜片之间的质量差为 1.29 g, 则导线中流过的电子的物质的量 为 mol。 ( 3 ) 若K 断开, 锌片上 氧化还原反应发生,导线 电流产生(均填“有” 或“无”) (4) 操作一段时间后测得铜片增加了 3.2 g, 同时锌片减少了 3.3 g ,计算这段时间内该装置消耗的化学能转化为电能的百分比为 。 ( 5 ) 将图 l 装置改为图 3 所示的装置, 能达到相同的作用且提高化学能转化为电能的效率。其中 KCl溶液起连通两边溶液形成闭合回路的作用, 同时又能阻止反应物直接接触。则硫酸铜溶液应该注入 (填“左侧”“右侧” 或“两侧”)烧杯中。 【参考答案】 D A B C D B A D C A D C D A B D 主观题除标注外,每空2分 17 . (1)废气、废水、废渣 【少答一个给1分;只答对一个、错一个均不得分】 (2)石油气、多种燃油、石蜡和沥青【答出每种状态中的一种成分也给分,给分标准(1)】 (3) CO2 化合态 不是 电解法 (4) 原子利用率100% 18. (1) 防倒吸 (2) 漂白 (3)还原 氧化 (4) 酸性氧化物【酸性也给分】 (5)打开弹簧夹,向其中通入空气,然后在装置B中加入NaOH溶液,塞上塞子,振荡即可 【得分点为通空气和B中加氢氧化钠溶液,各1分】 19. (1)否 (2) C11H18O2 碳碳双键、酯基 (3) ②③④⑤ ①③⑥ (4) 乙 乙 20. (1)甲 (2)Zn-2e-=Zn2+ 0.02 (3) 有 【1分】 无 【1分】 (4)50% (5)右侧查看更多