- 2021-08-07 发布 |
- 37.5 KB |
- 7页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020高考化学冲刺核心素养微专题7有关水溶液中曲线的解题策略练习含解析
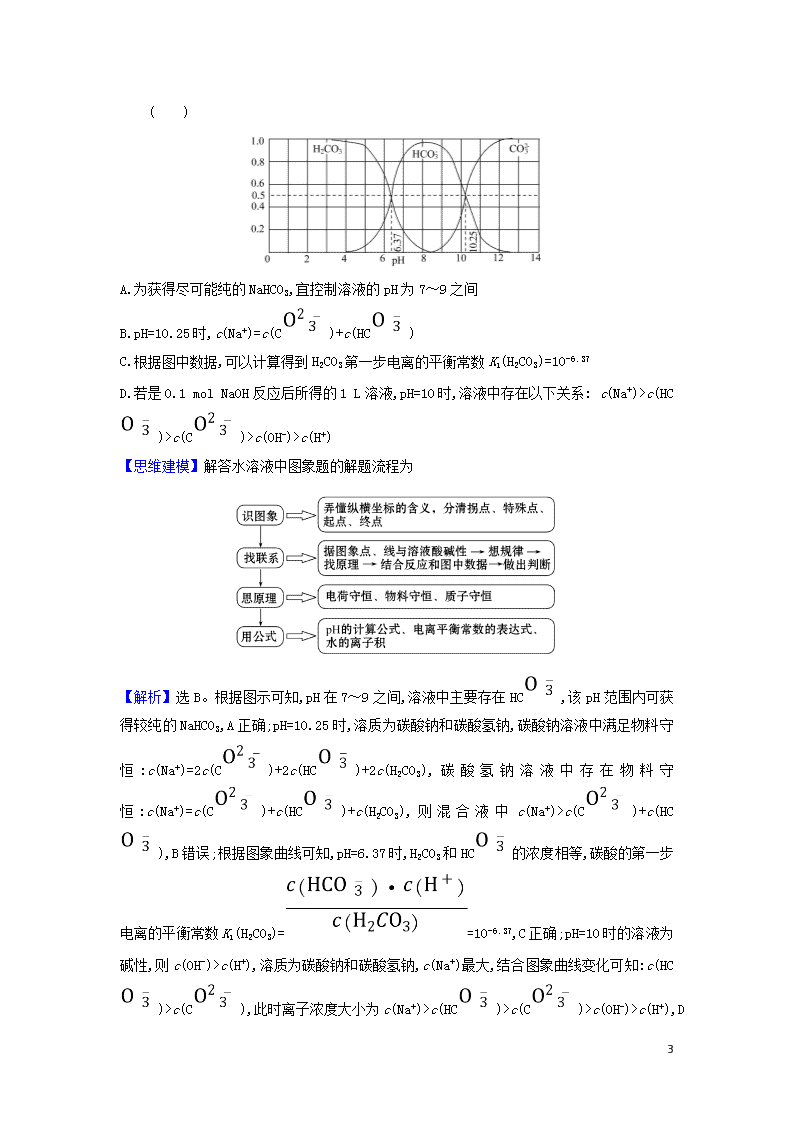
有关水溶液中曲线的解题策略 1.分析解答水溶液中曲线图象问题要注意几点 (1)读图, 弄清图象含义,通过观察弄清横坐标、纵坐标的含义及单位:搞清特殊点的意义,如坐标轴的原点,曲线的起点、终点、交叉点、极值点、转折点等;分析曲线的变化趋势如斜率的大小及升降。 (2)识图,进行信息提取,挖掘隐含信息、排除干扰信息、提炼有用信息,在统摄信息的基础上进行逻辑推理或运用数据计算。 (3)用图,联想化学原理解答问题。 2.三种常见类型 (1)强、弱电解质溶液加水稀释的变化曲线 (2)中和滴定曲线 7 (3)溶解平衡曲线 3.对数图象的解决办法 (1)破解对数图象的数据 ①运算法则:lgab= lga+lgb、lg=lga-lgb、lg1=0,若 K=·(K只与温度有关) ,得lgK= mlgc1 + nlgc2。 ②运算突破点:如lg=0的点有c(A)=c(B);lgc(D)=0的点有c(D)=1 mol·L-1。 ③巧用pH与电离平衡常数相互运算:pH=- lgc(H+)中的c(H+)可用含电离平衡常数的表达式换算。 (2)破解对数图象的规律 ①选点:两线的交点、零点等。 ②借助图中曲线:用物料守恒或电荷守恒解答。 【典例】(2019·长春模拟)常温下含碳各微粒H2CO3、HC和C存在于CO2和NaOH溶液反应后的溶液中,它们的物质的量分数与溶液pH的关系如图所示,下列说法错误的是 7 ( ) A.为获得尽可能纯的NaHCO3,宜控制溶液的pH为7~9之间 B.pH=10.25时,c(Na+)=c(C)+c(HC) C.根据图中数据,可以计算得到H2CO3第一步电离的平衡常数K1(H2CO3)=10-6.37 D.若是0.1 mol NaOH反应后所得的1 L溶液,pH=10时,溶液中存在以下关系: c(Na+)>c(HC)>c(C)>c(OH-)>c(H+) 【思维建模】解答水溶液中图象题的解题流程为 【解析】选B。根据图示可知,pH在7~9之间,溶液中主要存在HC,该pH范围内可获得较纯的NaHCO3,A正确;pH=10.25时,溶质为碳酸钠和碳酸氢钠,碳酸钠溶液中满足物料守恒:c(Na+)=2c(C)+2c(HC)+2c(H2CO3),碳酸氢钠溶液中存在物料守恒:c(Na+)=c(C)+c(HC)+c(H2CO3),则混合液中c(Na+)>c(C)+c(HC),B错误;根据图象曲线可知,pH=6.37时,H2CO3和HC的浓度相等,碳酸的第一步电离的平衡常数K1(H2CO3)==10-6.37,C正确;pH=10时的溶液为碱性,则c(OH-)>c(H+),溶质为碳酸钠和碳酸氢钠,c(Na+)最大,结合图象曲线变化可知:c(HC)>c(C),此时离子浓度大小为c(Na+)>c(HC)>c(C)>c(OH-)>c(H+),D 7 正确。 【延伸探究】(1)K2(H2CO3)=________。 提示:由图知,pH=10.25时c(HC)=c(C) K2(H2CO3)==c(H+)=10-10.25。 (2)由图知pH>8之后的主要反应的离子方程式为________________。 提示:HC+OH-C+H2O 1.(中和滴定曲线)室温下,用相同浓度的NaOH溶液,分别滴定浓度均为 0.1 mol·L-1的三种酸(HA、HB和HD)溶液,滴定曲线如图所示,下列判断错误的是 ( ) A.三种酸的电离常数关系:KHA>KHB>KHD B.滴定至P点时,溶液中:c(B-)>c(Na+)>c(HB)>c(H+)>c(OH-) C.pH=7时,三种溶液中:c(A-)=c(B-)=c(D-) D.当中和百分数达100%时,将三种溶液混合后:c(HA)+c(HB)+c(HD)=c(OH-)-c(H+) 【解析】选C。浓度相同的三种酸,HA的pH最小,HD的pH最大,酸性越强电离常数越大,三种酸的电离常数HA的最大,HD的最小,A正确;P点时,中和百分数为50%,此时溶液中含等物质的量浓度的HB和NaB,由于溶液显酸性,所以HB电离大于B-的水解,则c(B-)>c(Na+)>c(HB)>c(H+)>c(OH-),B正确;pH=7时,由于三种酸的电离常数不等,A-、B-、D-的水解程度不同,加入氢氧化钠的体积不同,虽然三种离子的浓度分别等于钠离子的浓度,但三种溶液中的钠离子的浓度不等,则c(A-)、c(B-)、c(D-)不等,C错误;当中和百分数为100%时,其中酸HA中的溶质是NaA,根据质子守恒得:c(OH-)=c(H+)+c(HA),另外两种酸中存在 7 c(OH-)=c(H+)+c(HB),c(OH-)=c(H+)+c(HD),将三种溶液混合有c(HA)+c(HB)+c(HD)=c(OH-)-c(H+),D正确。 2.(溶解平衡曲线)溴酸银(AgBrO3)溶解度随温度变化曲线如图所示,下列说法错误的是 ( ) A.溴酸银的溶解是放热过程 B.温度升高时溴酸银溶解速度加快 C.60 ℃时溴酸银的Ksp约等于6×10-4 D.若硝酸钾中含有少量溴酸银,可用重结晶方法提纯 【解析】选A。由溶解度随温度的变化关系可知:温度升高,该物质的溶解度增大,可见溴酸银(AgBrO3)溶解是吸热过程,A错误;温度升高,溴酸银溶解在水中的微粒运动速度加快,扩散得更快,因此升高温度使其溶解速度加快,B正确;60 ℃溴酸银的溶解度大约是0.6 g,则c(AgBrO3)=(0.6 g÷236 g·mol-1)÷0.1 L= 0.025 mol·L-1,Ksp=c(Ag+)·c(Br)=0.025×0.025≈6×10-4,C正确;由于硝酸钾的溶解度比较大,而溴酸银的溶解度较小,所以若硝酸钾中含有少量溴酸银,可用重结晶方法提纯,D正确。 3.25 ℃时,Fe(OH)2和Cu(OH)2的饱和溶液中,金属阳离子的物质的量浓度的负对数-lg c(M2+)与溶液pH的变化关系如图所示,已知:该温度下,Ksp[Cu(OH)2]< Ksp[Fe(OH)2]。下列说法正确的是 ( ) A.b线表示Fe(OH)2饱和溶液中的变化关系,且Ksp[Fe(OH)2]=10-15.1 7 B.当Fe(OH)2和Cu(OH)2沉淀共存时,溶液中c(Fe2+)∶c(Cu2+)=1∶104.6 C.向X点对应的饱和溶液中加入少量NaOH,可转化为Y点对应的溶液 D.除去CuSO4溶液中含有的少量Fe2+,可加入适量CuO 【解析】选A。A项,因Ksp[Cu(OH)2]查看更多