化学卷·2018届四川省成都石室中学高二下学期期中考试(2017
成都石室中学高 2018 届 2016—2017 学年度下期半期考试
化 学 试 题
考试时间:100 分钟 总分:100 分
可能用到的相对原子质量:H—1 C—12 N—14 O—16 Ca-40 Si-28 Na-23
I 卷(选择题,共 48 分)
一、选择题(每题仅有一个选项符合题意,每小题 2 分,共 48 分)
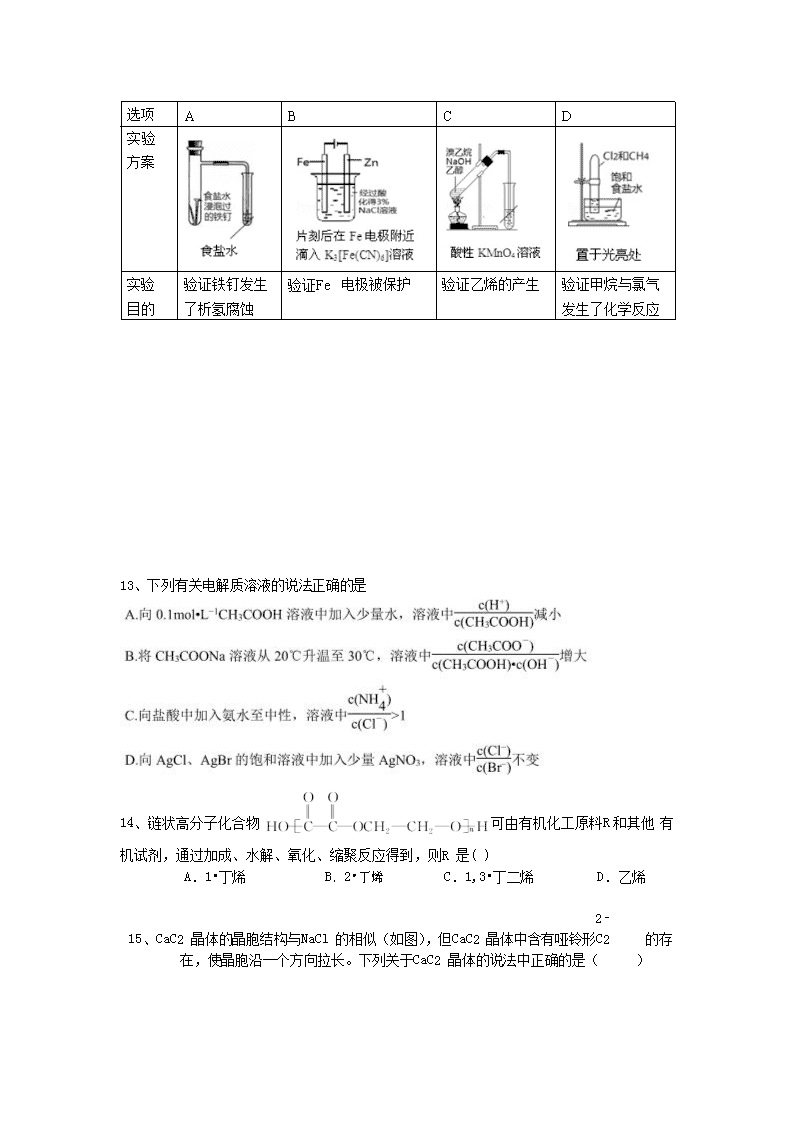
1、食品保鲜膜按材质分为聚乙烯(PE)、聚氯乙烯(PVC)等种类,PE 保鲜膜可直接接 触食品,PVC 保鲜膜则不能直接接触食品,它对人体有潜在危害。下列有关叙述不正 确的是( )
A.PE、PVC 都属于高分子化合物
B.质量相同的乙烯和聚乙烯完全燃烧耗氧量相同
C.乙烯和氯乙烯都是不饱和烃,二者都能使溴水褪色,而 PE、PVC 不能使溴水褪色 D.回利用废弃的 PE 和 PVC 可减少白色污染,焚烧 PVC 膜会放出有毒气体如 HCl
2、下列各项表述正确的是:( )
A.丙烯的键线式: B.CH2F2 的电子式:
C.醛基官能团符号:—COH D.-OH 与都表示羟基
3、下列物质熔点比较错误的( )
A. Na
0.68 时,氧化性:I2>AsO3
-4
第 II 卷(非选择题共 52 分)
25、(12 分)根据要求完成下列问题:
(1)已知 X、Y、Z 为第三周期元素,其原子的第一至第四电离能如下表:
电离能/kJ·mol-1
X Y Z
I
I
I
I
1
2
3
4
578
738
496
1 817
1 451
4 562
2 745
7 733
6 912
11 578
10 540
9 543
X、Y、Z 的电负性从大到小的顺序为 _(用元素符号表示),元素 Y 的第一电 离能大于 X 的第一电离能原因是 。
(2)Ni 是元素周期表中第 28 号元素,回答下列问题:
①第二周期基态原子未成对电子数与 Ni 相同且电负性 最小的元素是 (填元素名称)。
②据报道,某种含有镁、镍和碳三种元素的晶体具有 超导性,该新型超导晶体的一个晶胞的结构如图 2 所示,则该晶体的化学式为 。
(3)目前国际空间站处理 CO2 的一个重要方法是将 CO2 还原,所涉及的反应方程式为:
CO2(g)+4H2(g)
Ru CH4(g)+2H2O(g)
已知 H2 的体积分数随温度的升高而增加。
平衡常数 K
转化率 α
v 正
v 逆
若温度从 300℃升至 400℃,重新达到平衡,判断下列表格中各物理量的变化。(选填“增 大”、“减小”或“不变”)
(4)相同温度时,上述反应在不同起始浓度下分别达到平衡,各物质的平衡浓度如下表:
[CO2]/mol·L-1
a m
[H2]/mol·L-1
b n
[CH4]/mol·L-1
c x
[H2O]/mol·L-1
d y
平衡Ⅰ
平衡Ⅱ
a、b、c、d 与 m、n、x、y 之间的关系式为 。
26、(12 分)工业上制取 CuCl2 的生产流程如下:
请结合下表数据,回答下列问题:
物质
溶度积(25 ℃) 完全沉淀时的 pH 范围
Fe(OH)2 8.0×10-16
≥9.6
Cu(OH)2 2.2×10-20
≥6.4
Fe(OH)3 4.0×10-38
3~4
(1)在溶液 A 中加入 NaClO 的目的是 ,对应的离子方程式为:
。
(2)在溶液 B 中加入 CuO 的作用是 。沉淀 C 的化学式 。
(3)操作 a 的目的是 ,用到的主要玻璃仪器为 。
(4)在 Cu(OH)2 中加入盐酸使 Cu(OH)2 转化为 CuCl2,采用稍过量盐酸和低温蒸干的目的
是 。
27、(18 分)氰基丙烯酸酯在碱性条件下能快速聚合为 ,从而具有胶黏性, 某种氰基丙烯酸酯(G)的合成路线如下:
C (C4H5N)
HCN(水溶液) NaOH(微量)
浓H2SO4
△
Cl2
光照
A
B
D
NaOH H2O
E
GCH3OH F O2
催化剂 (C4H5NO)
浓H2SO4/△
已知:①A 的相对分子量为 58,氧元素质量分数为 0.276,核磁共振氢谱显示为单峰
O
OH
HCN(水溶液)
②R C
R′ NaOH(微量) R
C R′ CN
回答下列问题:
(1)A 的化学名称为 。
(2)B 的结构简式为 ,其核磁共振氢谱显示为 组峰,峰面积比为 。
(3)由 C 生成 D 的反应类型为 。由 A 生成 B 的反应类型为 。
(4)由 D 生成 E 的化学方程式为 。
(5)G 中的官能团有 、 、 。(填官能团名称)
(6)G 的同分异构体中,与 G 具有相同官能团且能发生银镜反应的共有 种。
(不含立体异构)
(7)由 F 生成 G 的化学方程式为 。
(8)聚氰基丙烯酸甲酯的结构简式为 。
28、(10 分)燃料电池具有广阔的发展前途,科学家近年研制出一种微型的燃料电池,采用 甲醇取代氢气做燃料可以简化电池设计,该电池有望取代传统电池.某学生在实验室利用碱
性甲醇燃料电池电解 Na2SO4 溶液.
请根据图示回答下列问题:
(1)图中 a 电极是 (填“正极”、“负极”、“阴极”或“阳极”).该电极上发生的 电极反应式为 .
(2)碱性条件下,通入甲醇的一极发生的电极反应式为 .
(3)当消耗 3.36 L 氧气时(已折合为标准状况),理论上电解 Na2SO4 溶液生成气体的总物质 的量是 mol.
(4)若 a、b 电极材料分别为铜和石墨,则电解总反应化学方程式为
成都石室中学高 2018 届 2016—2017 学年度下期半期考试 化 学 参考答案
1-5 CDBDD 6-10DBDCC 11-15 DDDDC 16-20ADCBC 21-24 CCCC
25、(12 分)
(1)Al>Mg>Na(2 分)Mg 原子 3s 上为全满不易失去,Al 原子 3p 上有 1 个电子,容易 失去,所以 Mg 的第一电离能大于 Al 的第一电离能。(1 分)
(2)碳 (2 分) MgNi3C(1 分)
(3) ( 共 4 分)
v 正
v 逆
平衡常数 K
转化率 α
增大
增大
减小
减小
cd2
(4)ab4 =
xy2
mn4 (2 分)
26、(12 分)
2
(1)将 Fe2+氧化为 Fe3+ (2 分) 2H++2Fe2++ClO--=2Fe3++Cl-+H O(2 分)
3
(2)调节溶液的 pH 为 3~4,使 Fe3+完全转化为 Fe(OH)
沉淀 (2 分) Fe(OH)3(1 分)
(3)洗涤 Cu(OH)2 表面的可溶性杂质(2 分) 漏斗(1 分)
(4)抑制 Cu2+的水解 (2 分)
27、(18 分)
(1)丙酮 (2 分)
(2) (2 分) 2 (1 分) 6:1 或 1:6 (1 分)
(3)取代反应(1 分) 加成反应(1 分)
(4) (2 分)
(5)碳碳双键 酯基 氰基(各 1 分,共 3 分) (6)8 (1 分)
(7)略(2 分)
(8)略(2 分)
28、(10 分)
(1)阳极(2 分)4OH--4e-=O2+2H2O(2 分)
2-
(2)CH3OH-6e-+8OH-=CO3
+6H2O(2 分)
电解
(3)0.45(2 分)(4)2Cu+2H2O Cu(OH)2+H2↑(2 分)