2017-2018学年吉林省汪清县第六中学高二上学期期中考试化学试题
2017---2018学年度第一学期
汪清六中高二化学期中试题
总分:100分 时量:90分钟 出题人:李红光 李锦娟
班级 姓名
一、单项选择题(25×2=50分)
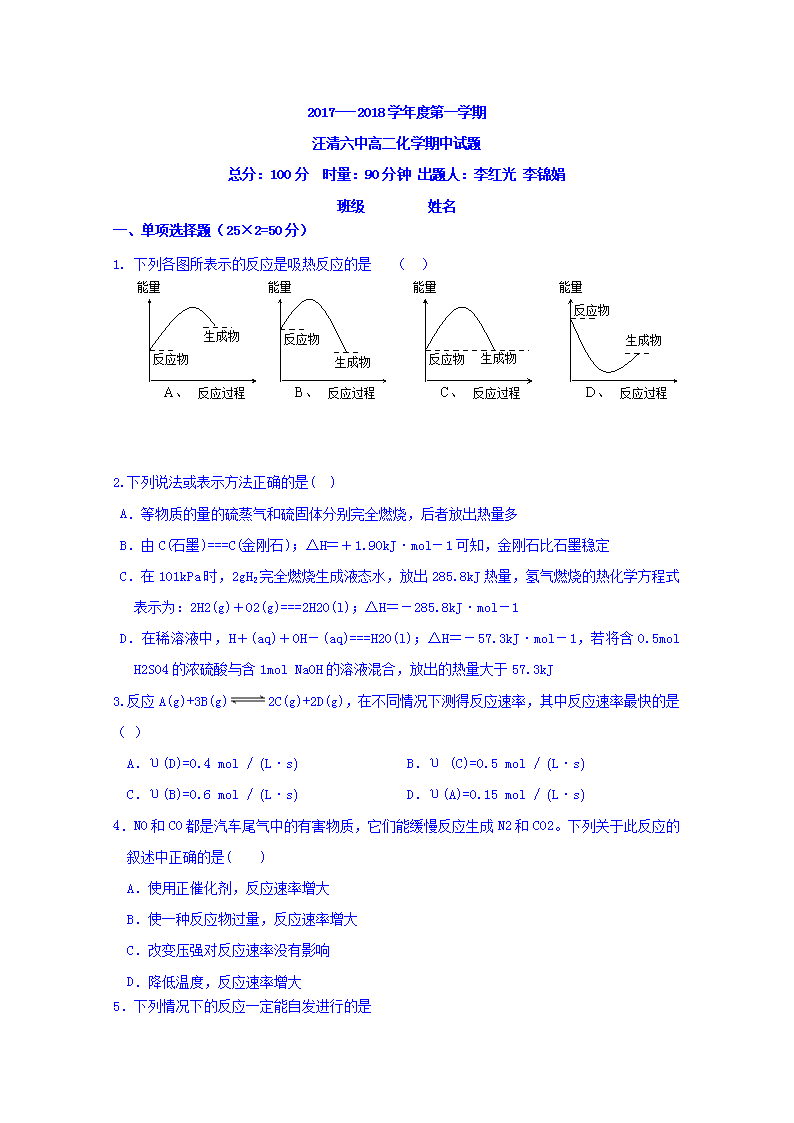
1. 下列各图所表示的反应是吸热反应的是 ( )
能量
A、 反应过程
反应物
生成物
能量
B、 反应过程
反应物
生成物
能量
C、 反应过程
反应物
生成物
能量
D、 反应过程
反应物
生成物
2.下列说法或表示方法正确的是( )
A.等物质的量的硫蒸气和硫固体分别完全燃烧,后者放出热量多
B.由C(石墨)===C(金刚石);ΔH=+1.90kJ·mol-1可知,金刚石比石墨稳定
C.在101kPa时,2gH2完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)===2H2O(l);ΔH=-285.8kJ·mol-1
D.在稀溶液中,H+(aq)+OH-(aq)===H2O(l);ΔH=-57.3kJ·mol-1,若将含0.5mol H2SO4的浓硫酸与含1mol NaOH的溶液混合,放出的热量大于57.3kJ
3.反应A(g)+3B(g) 2C(g)+2D(g),在不同情况下测得反应速率,其中反应速率最快的是( )
A.υ(D)=0.4 mol / (L·s) B.υ (C)=0.5 mol / (L·s)
C.υ(B)=0.6 mol / (L·s) D.υ(A)=0.15 mol / (L·s)
4.NO和CO都是汽车尾气中的有害物质,它们能缓慢反应生成N2和CO2。下列关于此反应的叙述中正确的是( )
A.使用正催化剂,反应速率增大
B.使一种反应物过量,反应速率增大
C.改变压强对反应速率没有影响
D.降低温度,反应速率增大
5.下列情况下的反应一定能自发进行的是
A.ΔH>0,ΔS<0 B.ΔH>0,ΔS>0 C.ΔH<0,ΔS>0 D.ΔH<0,ΔS<0
6.下列电离方程式中,不正确的是( )
A. Ba2++2OH-
B. NH3·H2ONH4++OH-
C. CH3COOHCH3COO-+H+
D. AgCl=Ag++Cl-
7.下列各组的酸,碱溶液等体积混合后,PH=7的是( )
A. 0.01mol.L-1 H2SO4溶液,0.01mol.L-1的NaOH溶液
B.0.01mol.L-1的CH3COOH溶液,0.01mol.L-1的NaOH溶液
C.PH=2的H2SO4溶液,PH=12的NaOH溶液
D.PH=2的CH3COOH溶液,PH=12的NaOH溶液
8.用铁片与稀硫酸反应制氢气时,下列措施不能使氢气生成速率加快的是( )
A.加热 B.不用稀硫酸,改用98%浓硫酸
C.加CuSO4溶液 D.不用铁片,改用铁粉
9.在密闭容器中进行下列反应:aM(g)+bN(g) cR(g)+dL(g)此反应符合右图,下列叙述正确的是 ( )
A.正反应吸热 ,a+b
c+d
C.正反应放热 ,a+bc+d
10.进行中和滴定时,事先不应该用所盛溶液润洗的仪器是(已用蒸馏水洗过)( )
A. 酸式滴定管 B. 碱式滴定管
C. 锥形瓶 D. 量筒
11.下列化合物属于弱电解质的是( )
A. HClO4 B. Ba(OH)2 C. CO2 D. HF
12.100℃时,水的离子积为1×10-12,若该温度下某溶液中的H+ 浓度为1×10-7mol/L则该溶液是( )
A. 酸性 B. 碱性 C. 中性 D. 无法判断
13. 将PH=2的盐酸加水稀释10倍后溶液的PH值是( )
A.2 B. 11 C. 0.01 D. 3
14.下列物质的水溶液,常温下pH值大于7的是()
A.硫化钠 B.氯化铜 C.硝酸钠 D.乙醇
15.25℃时,水的电离可达到平衡:H2O H++OH—,下列叙述正确的是( )
A.向水中加入稀氨水,平衡逆向移动,c(OH-)降低
B.向水中加入少量固体硫酸氢钠,c(H+)增大,Kw不变
C.向水中加入少量固体CH3COONa,平衡逆向移动,c(H+)降低
D.将水加热,Kw增大,pH不变
16.增大压强对下列反应的速率无影响的是( )
A.CO2(g) + Ca(OH)2(aq) = CaCO3(s)↓ + H2O(l)
B.H2 (g) + I2(g) 2HI(g)
C.NaCl(aq) +AgNO3(aq) = AgCl(s)↓ + NaNO3(aq)
D.N2(g) +3H2(g) 2NH3(g)
17.在密闭容器中,一定条件下进行如下反应:
NO(g)+CO(g) N2(g)+CO2(g);△H=-373.2kJ·mol-1 ,达到平衡后,为提高该反应的速率和NO的转化率,采取的正确措施是( )
A. 加催化剂同时升高温度 B. 加催化剂同时增大压强
C. 升高温度同时充入N2 D. 降低温度同时增大压强
18.下列说法正确的是( )
A.1 mol·L-1的稀硫酸中存在OH-
B.Kw随溶液c(H+)和c(OH-)的变化而改变
C.水的电离只受温度影响,酸碱性对其无影响
D.Kw=10-14适用于任何温度、任何溶液
19.下列溶液一定呈中性的是( )
A.pH=7的溶液
B.c(H+)=c(OH-)的溶液
C.由强酸、强碱等物质的量反应得到的溶液
D.非电解质溶于水得到的溶液
20.下列离子方程式属于盐的水解,且书写正确的是( )
A.HCO3-+H2O=CO32-+H3O+
B.HS-+H2OH2S+OH-
C.CO32-+2H2O=H2CO3+2OH-
D.ClO-+H2O=Cl-+2OH-
21.在常温下,将pH=8的NaOH溶液与pH=10的NaOH溶液等体积混合后,溶液的pH最接近于( )
A.8.3 B.8.7 C.9 D.9.7
22.对于可逆反应A(g)+2B(g)2C(g)(正反应吸热),下列图象中正确的是( )
23. 下列关于平衡常数K的说法中,正确的是( )
A.在任何条件下,化学平衡常数是一个恒定值
B.改变反应物浓度或生成物浓度都会改变平衡常数K
C.平衡常数K只与温度有关,与反应浓度、压强无关
D.从平衡常数K的大小不能推断一个反应进行的程度
24.在NH3•H2O⇌NH4++OH﹣形成的平衡中,要使NH3•H2O的电离程度及c(OH﹣)都增大,可采取的措施是( )
A.通入HCl B.加少量NaOH固体
C.加少量氯化铵固体 D.加热
25.在某温度时,测得纯水中的c(H+)=2.0×10-7 mol·L-1,则c(OH-)为( )
A.2.0×10-7 mol·L-1
B.0.1×10-7 mol·L-1
C.1.0×10-14/2.0×10-7 mol·L-1
D.无法确定
二、填空题(共50分)
1.(3分)已知下列热化学方程式
(l) C(s)+1/2O2(g)=CO(g) △H1=-110.5kJ/mol
(2) =2H2O(g) △H2=-483.6 kJ·
由此可知 C(s)+ H2O(g) == CO(g) + H2(g) ΔH3 。则 ΔH3等于
2.(6分)在一条件下,把物质A,B按一定比例充入容积为2L的球开容器,发生如下反应: 2A(g)+ B(g) 2C(g); △H=-180KJ.mol-1
(1) 写出该反应的化学平衡常数表达式 K=_________________________
(2)降低温度,该反应K值______,A转化率_________,化学反应速度_____
(以上均填“增大,减小或不变”)
(3) 若平均每分钟生成0.5mol的C,则此反应速率可表示为V(C)=__________
3.(6分)写出下列盐溶液水解的离子方程。
(1)(NH4)2SO4: ;
(2)AlCl3: ;
(3)KF: ;
4.(6分)下列盐的水溶液中,哪些呈酸性( ) 哪些呈碱性( )哪些呈中性( )
① FeCl3 ② NaClO ③ (NH4)2SO4
④ AgNO3 ⑤ Na2S ⑥ K2SO4
5.(6分)下列电解质中,①NaCl,②NaOH,③NH3·H2O,④CH3COOH,⑤BaSO4,⑥NaHCO3,⑦Na2O,⑧CH3CH2OH,⑨H2O,⑩SO2 ⑾NH3属于强电解质的是 ;属于弱电解质的是 属于非电解质的是 。
6.(6分)化学反应 2A+B⇌2C;△H<0达到化学平衡时,根据以下条件改变填空:
(1)若A、B、C都是气体,且C为有色气体.
①及时分离出C,平衡( ) 移动;(填正向、逆向、不)
②使密闭容器体积增大,A的转化率( );(填增大、减小、不变)
③如果升高温度,平衡混合物的颜色( );(填加深、变浅、不变)
④加入催化剂D,平衡( )移动;(填正向、逆向、不)
(2)若A、C为气体,B为固体;
①加压,则A的体积分数( );(填增大、减小、不变)
②增加B的量,A的转化率( ).(填增大、减小、不变)
7.(1分)在100时,PH=7呈( ) 性。
8.(2分).写出下列物质的电离方程式
(1)H2CO3
(2)KNO3
9.(14分)某学生用0.2000mol·L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作为如下几步:① 用蒸馏水洗涤碱式滴定管,并立即注入NaOH溶液至“0”刻度线以上
② 固定好滴定管并使滴定管尖嘴充满液体
③ 调节液面至“0”或“0”刻度线稍下,并记下读数
④ 移取20.00mL待测液注入洁净的锥形瓶中,并加入3滴酚酞溶液
⑤ 用标准液滴定至终点,记下滴定管液面读数。
请回答:(1)以上步骤有错误的是(填编号) ,该错误操作会导致测定结果(填“偏大”、 “偏小”或“无影响”)__________________
(2)步骤⑤中,在记下滴定管液面读数时,滴定管尖嘴有气泡,将导致测定结果(填“偏大”、“偏小”或“无影响”)___________________
(3)判断滴定终点的现象是:锥形瓶中溶液从 色变为 色,且半分钟不变色。
(4)图19是某次滴定时的滴定管中的液面,其读数为 mL
(5)(2分)根据下列数据:请计算待测盐酸溶液的浓度 mol/L
滴定次数
待测体积(ml)
标准烧碱体积(ml)
滴定前读数
滴定后读数
第一次
20.00
0.40
20.40
第二次
20.00
4.00
24.00
第三次
20.00
2.00
24.10
答案:一、选择题
1—5ADBAC 6—10ACBDC 11—15DBDAB 16—20CBABB 21—25DDCDA
二、填空题
1.131.3 kJ·
2.略 增大 增大 减小 0.25mol/l.min
3.(1)NH4++H2O NH3·H2O+H+
(2)Al3++3H2O Al(OH)3+3H+
(3)F-+H2O HF+OH-
4. ①③④、②⑤、⑥
5. ①②⑤⑥⑦、③④⑨、⑩ ⑾
6.正向 减小 变浅 不变 不变 不变
7.碱
8.略
9.(1) ① ,偏大 (2) 偏小
(3)无 ,粉红 (4) 22.60 (5) 0.2000