- 2021-08-06 发布 |
- 37.5 KB |
- 14页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
【化学】北京市中国人民大学附属中学2020届高三教学质量监测(解析版)
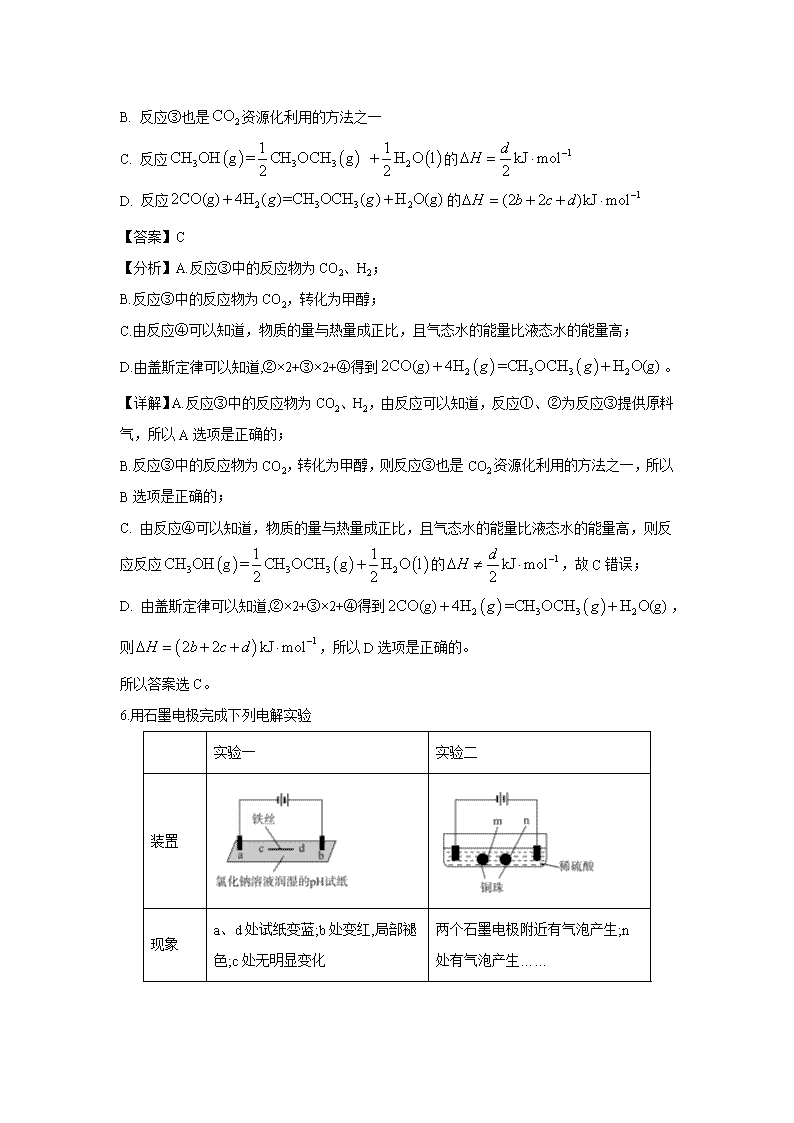
北京市中国人民大学附属中学2020届高三教学质量监测 可能用到的相对原子质量:H-1 C-12 N-14 O-16 S-32 Cl-35.5 K-39 Ti-48 Fe-56 I-127 Ag-108 一、选择题:本大题包括7小题,每小题6分。在每小题给出的四个选项中,只有一项符合题目要求。 1.古丝绸之路贸易中的下列商品,主要成分属于无机物的是( ) A.瓷器 B.丝绸 C.茶叶 D.中草药 【答案】A 【详解】A、瓷器是硅酸盐,陶瓷的成分主要是:氧化铝,二氧化硅,属于无机物,A正确。B、丝绸有要可怜人是蛋白质,属于有机物,B错误;C、茶叶主要含有茶多酚(Tea Polyphenols),是茶叶中多酚类物质的总称,包括黄烷醇类、花色苷类、黄酮类、黄酮醇类和酚酸类等,属于有机物,C错误;D、中药所含化学成分很复杂,通常有糖类、氨基酸、蛋白质、油脂、蜡、酶、色素、维生素、有机酸、鞣质、无机盐、挥发油、生物碱、甙类等,主要成份是有机物,D错误。 2.阿伏加德罗常数的值为。下列说法正确的是( ) A. 1L0.1mol·NH4Cl溶液中,的数量为0.1 B. 2.4gMg与H2SO4完全反应,转移的电子数为0.1 C. 标准状况下,2.24LN2和O2的混合气体中分子数为0.2 D. 0.1mol H2和0.1mol I2于密闭容器中充分反应后,其分子总数为0.2 【答案】D 【解析】A、NH4+是弱碱阳离子,发生水解:NH4++H2ONH3·H2O+H+,因此NH4+数量小于0.1NA,故A错误;B、2.4gMg为0.1mol,与硫酸完全反应后转移的电子的物质的量为2.4×2/24mol=0.2mol,因此转移电子数为为0.2NA,故B错误;C、标准状况下,N2 和O2都是气态分子,2.24L任何气体所含有的分子数都为0.1NA,故C错误;D、H2+I22HI,反应前后系数之和相等,即反应后分子总物质的量仍为0.2mol,分子数为0.2NA,故D正确。 3.下列反应可用离子方程式“H++OH−=H2O”表示的是( ) A. NaHSO4溶液与Ba(OH)2溶液混合 B. NH4Cl溶液与Ca(OH) 2溶液混合 C. HNO3溶液与KOH溶液混合 D. Na2HPO4溶液与NaOH溶液混合 【答案】C 【详解】A、NaHSO4溶液与Ba(OH)2溶液混合:H++SO42—+Ba2++OH-=BaSO4↓+H2O,A不合题意;B、NH4Cl溶液与Ca(OH) 2溶液混合:NH4++OH-=NH3·H2O,B不合题意; C、HNO3溶液与KOH溶液混合:H++OH−=H2O,C符合题意; D、Na2HPO4溶液与NaOH溶液混合:HPO42—+OH-=PO43—+H2O,D不合题意。 答案选C。 4.下列变化中,气体被还原的是( ) A. 二氧化碳使Na2O2固体变白 B. 氯气使KBr溶液变黄 C. 乙烯使Br2的四氯化碳溶液褪色 D. 氨气使AlCl3溶液产生白色沉淀 【答案】B 【解析】A、二氧化碳使Na2O2固体变白,发生反应2CO2+2Na2O2=O2+2Na2CO3,CO2的化合价没有发生改变,过氧化钠既是氧化剂,也是还原剂,A错误;B、氯气使KBr溶液变黄,发生反应2KBr+Cl2=2KCl+Br2,Cl元素化合价降低,被还原,B正确;C、乙烯使Br2的四氯化碳溶液褪色,是乙烯与溴发生了加成反应,Br元素化合价降低,Br2被还原,乙烯被氧化,C错误;D、氨气使AlCl3溶液产生白色沉淀氢氧化铝,反应过程中NH3化合价没有改变,不是氧化还原反应,D错误。答案选B。 5.通过以下反应可获得新型能源二甲醚()。下列说法不正确的是 ( ) ① ② ③ ④ A. 反应①、②为反应③提供原料气 B. 反应③也是资源化利用的方法之一 C. 反应的 D. 反应 【答案】C 【分析】A.反应③中的反应物为CO2、H2; B.反应③中的反应物为CO2,转化为甲醇; C.由反应④可以知道,物质的量与热量成正比,且气态水的能量比液态水的能量高; D.由盖斯定律可以知道,②×2+③×2+④得到。 【详解】A.反应③中的反应物为CO2、H2,由反应可以知道,反应①、②为反应③提供原料气,所以A选项是正确的; B.反应③中的反应物为CO2,转化为甲醇,则反应③也是 CO2资源化利用的方法之一,所以B选项是正确的; C. 由反应④可以知道,物质的量与热量成正比,且气态水的能量比液态水的能量高,则反应反应的,故C错误; D. 由盖斯定律可以知道,②×2+③×2+④得到,则,所以D选项是正确的。 所以答案选C。 6.用石墨电极完成下列电解实验 实验一 实验二 装置 现象 a、d处试纸变蓝;b处变红,局部褪色;c处无明显变化 两个石墨电极附近有气泡产生;n处有气泡产生…… 下列对实验现象的解释或推测不合理的是( ) A a、d处:2H2O+2e-=H2↑+2OH- B. b处:2Cl--2e-=Cl2↑ C. c处发生了反应:Fe-2e-=Fe2+ D. 根据实验一的原理,实验二中m处能析出铜 【答案】B 【详解】A、a、d处试纸变蓝,说明溶液显碱性,是溶液中的氢离子得到电子生成氢气,破坏了水的电离平衡,氢氧根离子浓度增大造成的,A正确; B、b处变红,局部褪色,说明是溶液中的氢氧根和氯离子同时放电,分别产生氧气和氯气,氢离子浓度增大,酸性增强,氯气与水反应生成的次氯酸具有漂白性,B错误; C、c处为阳极,铁失去电子生成亚铁离子,C正确; D、实验一中ac形成电解池,db形成电解池,所以实验二中也相当于形成三个电解池(一个球两面为不同的两极),m为电解池的阴极,另一球朝m的一面为阳极(n的背面),故相当于电镀,即m上有铜析出,D正确; 答案选B。 【点睛】化学反应主要是物质变化,同时也伴随着能量变化。电化学是化学能与电能转化关系的化学。电解池是把电能转化为化学能的装置,它可以使不能自发进行的化学借助于电流而发生。与外接电源正极连接的电极为阳极,与外接电源的负极连接的电极为阴极。阳极发生氧化反应,阴极发生还原反应。若阳极是活性电极(除Au、Pt、C之外的电极),则电极本身失去电子,发生氧化反应;若是惰性电极(Au、Pt、C等电极),则是溶液中的阴离子放电,放电的先后顺序是S2->I->Br->Cl->OH->含氧酸根离子,阴极则是溶液中的阳离子放电,放电顺序是Ag+>Hg2+>Fe3+>Cu2+>H+,与金属活动性顺序刚好相反。因此掌握电解池反应原理是本题解答的关键。注意依据实验现象分析可能发生的电极反应。 7.下列事实中,不能比较氢硫酸与亚硫酸的酸性强弱的是( ) A. 氢硫酸不能与碳酸氢钠溶液反应,而亚硫酸可以 B. 氢硫酸的导电能力低于相同浓度的亚硫酸 C. 0.10 mol·L-1的氢硫酸和亚硫酸的pH分别为4.5和2.1 D. 氢硫酸的还原性强于亚硫酸 【答案】D 【详解】A.氢硫酸不能与碳酸氢钠溶液反应,而亚硫酸可以,符合强酸制备弱酸的特点,可说明亚硫酸的酸性比氢硫酸强,A正确; B.氢硫酸的导电能力低于相同浓度的亚硫酸,可说明亚硫酸的电离程度大,则亚硫酸的酸性强,B正确; C.0.10mol•L-1的氢硫酸和亚硫酸的pH分别为4.5和2.1,可说明亚硫酸的电离程度大,酸性较强,C正确; D.氢硫酸的还原性强于亚硫酸,不能用于比较酸性的强弱,D错误。答案选D。 【点睛】本题考查学生弱电解质的电离知识,注意电解质是弱电解质的证明方法的使用是关键,即弱电解质的证明,是基于与强电解质对比进行的。弱电解质与强电解质最大的区别就是弱电解质存在电离平衡,而强电解质不存在电离平衡。因此只要证明有电离平衡存在,就证明了弱电解质。 二、非选择题:包括必考题和选考题两部分。第8题-第10题为必考题每个试题考生都必须作答,第11题-第12题为选考题,考生根据要求作答。 (一)必考题 8.SCR和NSR技术可有效降低柴油发动机在空气过量条件下的NOx排放。 (1)SCR(选择性催化还原)工作原理: ①尿素水溶液热分解为NH3和CO2,该反应的化学方程式:_____________________。 ②反应器中NH3还原NO2的化学方程式:_________________________________。 ③当燃油中含硫量较高时,尾气中SO2在O2作用下会形成(NH4)2SO4,使催化剂中毒。用化学方程式表示(NH4)2SO4的形成:_________________________________________。 ④尿素溶液浓度影响NO2的转化,测定溶液中尿素(M=60g·mol-1)含量的方法如下:取ag尿素溶液,将所含氮完全转化为NH3,所得NH3用过量的v1mLc1mol·L-1H2SO4溶液吸收完全,剩余H2SO4用v2mLc2mol·L-1NaOH溶液恰好中和,则尿素溶液中溶质的质量分数是________。 (2)NSR(NOx储存还原)工作原理: NOx的储存和还原在不同时段交替进行,如图a所示。 ①通过BaO和Ba(NO3)2的相互转化实现NOx的储存和还原。储存NOx的物质是_____。 ②用H2模拟尾气中还原性气体研究了Ba(NO3)2的催化还原过程,该过程分两步进行,图b表示该过程相关物质浓度随时间的变化关系。第一步反应消耗的H2与Ba(NO3)2的物质的量之比是________。 ③还原过程中,有时会产生笑气(N2O)。用同位素示踪法研究发现笑气的产生与NO有关。在有氧条件下15NO与NH3以一定比例反应时,得到的笑气几乎都是15NNO。将该反应的化学方程式补充完整:___□15NNO+□H2O___。 【答案】(1). CO(NH2)2+H2OCO2+2NH3 (2). 8NH3+6NO27N2+12H2O (3). 2SO2+O2+4NH3+2H2O=2(NH4)2SO4 (4). (5). BaO (6). 8∶1 (7). 415NO+4NH3+3O2415NNO+6H2O 【分析】结合反应物、生成物,根据原子守恒,若是氧化还原反应的方程式,再结合得失电子守恒配平化学反应方程式;测定溶液中尿素含量时,将所含氮完全转化为NH3,用过量的稀硫酸吸收氨气,反应后剩余的硫酸,用氢氧化钠溶液中和,整个过程中的,硫酸与氨气、氢氧化钠反应的化学方程式为2NH3+H2SO4=2(NH4)2SO4,2NaOH+H2SO4=2Na2SO4+2H2O。 【详解】(1)①尿素水溶液热分解为氨气和二氧化碳,反应方程式为CO(NH2)2+H2OCO2+2NH3 ; ②NH3在催化剂作用下还原NO2生成N2和H2O,反应的化学方程式为8NH3+6NO27N2+12H2O; ③二氧化硫在氧气作用下与氨气和水反应生成硫酸铵,此反应中二氧化硫是还原剂,氧气是氧化剂;反应的化学方程式为2SO2+O2+4NH3+2H2O=2(NH4)2SO4; ④NH3用过量的v1mLc1mol·L-1H2SO4溶液吸收完全,剩余H2SO4用v2mLc2mol·L-1NaOH溶液恰好中和,过程中所涉及的化学方程式为:2NH3+H2SO4=2(NH4)2SO4 ,2NaOH+H2SO4=2Na2SO4+2H2O,反应中n(H2SO4)=c1×v1×10-3mol,n(NaOH)=c2×v2×10-3mol,由方程式可知:n(NaOH)+n(NH3)=2n(H2SO4),则n(NH3)=(2c1×v1×10-3-c2×v2×10-3)mol,n[CO(NH2)2]=n(NH3)=×(2c1×v1×10-3-c2×v2×10-3)mol,m[CO(NH2)2]=60g·mol-1××(2c1×v1×10-3-c2×v2×10-3)mol=(0.06c1×v1-0.03c2×v2)g,所以尿素的质量分数是: =; (2)①由图可知BaO和NOx反应生成Ba(NO3)2,Ba(NO3)2再被还原为N2,则存储NOx的物质是BaO; ②第一步反应中H2被氧化生成水,氢元素化合价由0价升高到+1价,Ba(NO3)2中的N元素的化合价由+5价降到-3价,生成氨气,则1molBa(NO3)2生成氨气得到16mol电子,根据氧化还原反应中得失电子守恒,则参加反应的氢气的物质的量为mol=8mol,故第一步反应消耗的H2与Ba(NO3)2的物质的量之比是8:1; ③在有氧条件下15NO与NH3以一定比例反应时,得到的笑气几乎都是15NNO,由N元素守恒可知,15NO与NH3的物质的量之比应为1:1,结合氧化还原反应中得失电子守恒、原子守恒,可知该反应的化学方程式为:415NO+4NH3+3O2415NNO+6H2O。 【点睛】本题主要考查的是:根据反应物、生成物结合原子守恒、得失电子守恒配平化学反应方程式,在测定溶液中尿素(M=60g·mol-1)含量时,要结合相关数据的处理,通过反应方程式的化学计量数来计算相关的量。 9.高锰酸钾()是一种常用氧化剂,主要用于化工、防腐及制药工业等。以软锰矿(主要成分为MnO2)为原料生产高锰酸钾的工艺路线如下: 回答下列问题: (1)原料软锰矿与氢氧化钾按1∶1的比例在“烘炒锅”中混配,混配前应将软锰矿粉碎,其作用是_______________________。 (2)“平炉”中发生的化学方程式为______________________。 (3)“平炉”中需要加压,其目是______________________。 (4)将K2MnO4转化为KMnO4的生产有两种工艺。 ①“歧化法”是传统工艺,即在K2MnO4溶液中通入CO2气体,使体系呈中性或弱碱性,K2MnO4发生歧化反应,反应中生成K2MnO4,MnO2和____________(写化学式)。 ②“电解法”为现代工艺,即电解K2MnO4水溶液,电解槽中阳极发生的电极反应为___________________,阴极逸出的气体是______________。 ③“电解法”和“歧化法”中,K2MnO4的理论利用率之比为______________。 (5)高锰酸钾纯度的测定:称取1.0800 g样品,溶解后定容于100 mL容量瓶中,摇匀。取浓度为0.2000 mol·L−1的H2C2O4标准溶液20.00 mL,加入稀硫酸酸化,用KMnO4溶液平行滴定三次,平均消耗的体积为24.48 mL,该样品的纯度为___________________ (列出计算式即可,已知2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O)。 【答案】(1). 扩大接触面积,加快化学反应速率 (2). 2MnO2+O2+4KOH2K2MnO4+2H2O (3). 增大反应物的浓度,可使化学反应速率加快,同时使反应物的转化率增大 (4). K2CO3 (5). MnO42--e-=MnO4- (6). H2 (7). 3:2 (8). 95.62% 【详解】(1) MnO2的状态是固体,对于有固体参加的化学反应,可通过增大其反应接触面积的方法提高反应速率,故要将其粉碎成细小的颗粒; (2) 根据流程图可知,在“平炉”中MnO2、KOH、O2在加热时反应产生K2MnO4,结合质量守恒定律可知,另外一种物质是H2O,则发生的化学方程式为2MnO2+O2+4KOH2K2MnO4+2H2O ; (3)由于上述反应中氧气是气体,在“平炉”中加压,就可以使反应物氧气的浓度增大,根据外界条件对化学反应速率的影响,增大反应物的浓度,可以使化学反应速率加快;任何反应都具有一定的可逆性,增大压强,可以使化学平衡向气体体积减小的正反应方向移动,故可以提高原料的转化率; (4) ①在K2MnO4溶液中通入CO2气体,使体系呈中性或弱碱性,K2MnO4发生歧化反应,反应中生成KMnO4,MnO2,根据质量守恒定律可知,另外一种生成物是K2CO3,根据氧化还原反应中的电子守恒及反应的原子守恒,可得该反应的化学方程式是:3K2MnO4+ 2CO2= 2KMnO4+MnO2+K2CO3;②“电解法”为现代工艺,即电解K2MnO4水溶液,在电解槽中阳极,MnO42-失去电子,发生氧化反应,产生MnO4-。电极反应式是:MnO42--e-=MnO4- ;在阴极,水电离产生的H+获得电子变为氢气逸出,电极反应式是:2H2O+2e-=H2↑+2OH-。所以阴极逸出的气体是H2;总反应方程式是:2K2MnO4+2H2O2KMnO4+2H2↑+2KOH;③根据“电解法”方程式2K2MnO4+ 2H2O2KMnO4+2H2↑+2KOH 可知K2MnO4的理论利用率是100%;而在“CO2歧化法” 3K2MnO4+2CO2 = 2KMnO4+MnO2+K2CO3中,K2MnO4的理论利用率是2/3,所以二者的理论利用率之比为3:2; (5)根据离子方程式2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O可知KMnO4与草酸反应的关系式是:2 KMnO4~5H2C2O4。配制的溶液的浓度为:。则1.0800g样品中含KMnO4的物质的量为:n=KMnO4的质量为:m=0.006536mol × 158g/mol =1.03269g。故其纯度为:×100%=95.62%。 10.丁烯是一种重要的化工原料,可由丁烷催化脱氢制备。回答下列问题: (1)正丁烷(C4H10)脱氢制1-丁烯(C4H8)的热化学方程式如下: ①C4H10(g)= C4H8(g)+H2(g) ΔH1 已知:②C4H10(g)+O2(g)= C4H8(g)+H2O(g) ΔH2=-119 kJ·mol-1 ③H2(g)+ O2(g)= H2O(g) ΔH3=-242 kJ·mol-1 反应①的ΔH1为________ kJ·mol-1。图(a)是反应①平衡转化率与反应温度及压强的关系图,x_____________0.1(填“大于”或“小于”);欲使丁烯的平衡产率提高,应采取的措施是__________(填标号)。 A.升高温度 B.降低温度 C.增大压强 D.降低压强 (2)丁烷和氢气的混合气体以一定流速通过填充有催化剂的反应器(氢气的作用是活化催化剂),出口气中含有丁烯、丁烷、氢气等。图(b)为丁烯产率与进料气中n(氢气)/n(丁烷)的关系。图中曲线呈现先升高后降低的变化趋势,其降低的原因是_________________。 (3)图(c)为反应产率和反应温度的关系曲线,副产物主要是高温裂解生成的短碳链烃类化合物。丁烯产率在590 ℃之前随温度升高而增大的原因可能是_______________________、______________________________;590℃之后,丁烯产率快速降低的主要原因可能是_______________________________________。 【答案】(1). +123kJ·mol-1 (2). < (3). AD (4). 氢气是产物之一,随着n(氢气)/n(丁烷)增大,逆反应速率增大 (5). 升高温度有利于反应向吸热方向进行 (6). 温度升高反应速率加快 (7). 丁烷高温裂解生成短链烃类 【解析】(1)根据盖斯定律,用②式-③式可得①式,因此△H1=△H2-△H3=-119 kJ/mol +242 kJ/mol =+123kJ/mol。由a图可以看出,温度相同时,由0.1MPa变化到xMPa,丁烷的转化率增大,即平衡正向移动,根据反应前后气体系数之和,反应前气体系数小于反应后气体系数之和,因此减小压强,平衡向正反应方向移动,即x<0.1。提高丁烯的产率,要求平衡向正反应方向移动,A、因为反应①是吸热反应,升高温度,平衡向正反应方向移动,即丁烯转化率增大,故A正确;B、降低温度,平衡向逆反应方向移动,丁烯的转化率降低,故B错误;C、反应前气体系数之和小于反应后气体系数之和,增大压强,平衡向逆反应方向移动,丁烯的转化率降低,故C错误;D、根据C选项分析,降低压强,平衡向正反应方向移动,丁烯转化率提高,故D正确;(2)因为通入丁烷和氢气,发生①,氢气是生成物,随着n(H2)/n(C4H10)增大,相当于增大氢气的量,反应向逆反应方向进行,逆反应速率增加;(3)根据图(c),590℃之前,温度升高时反应速率加快,生成的丁烯会更多,同时由于反应①是吸热反应,升高温度平衡正向移动,平衡体系中会含有更多的丁烯。而温度超过590℃时,由于丁烷高温会裂解生成短链烃类,所以参加反应①的丁烷也就相应减少。 (二)选考题 11.(2017·新课标全国卷Ⅰ)钾和碘的相关化合物在化工、医药、材料等领域有着广泛的应用。回答下列问题: (1)元素K的焰色反应呈紫红色,其中紫色对应的辐射波长为_______nm(填标号)。 A.4044 B.553.5 C.589.2 D.670.8 E.766.5 (2)基态K原子中,核外电子占据的最高能层的符号是_________,占据该能层电子的电子云轮廓图形状为___________。K和Cr属于同一周期,且核外最外层电子构型相同,但金属K的熔点、沸点等都比金属Cr低,原因是___________________________。 (3)X射线衍射测定等发现,I3AsF6中存在I3+离子。I3+离子的几何构型为_____________,中心原子的杂化形式为________________。 (4)KIO3晶体是一种性能良好的非线性光学材料,具有钙钛矿型的立体结构,边长为a=0.446nm,晶胞中K、I、O分别处于顶角、体心、面心位置,如图所示。K与O间的最短距离为______nm,与K紧邻的O个数为__________。 (5)在KIO3晶胞结构的另一种表示中,I处于各顶角位置,则K处于______位置,O处于______位置。 . 【答案】(1). A (2). N (3). 球形 (4). K的原子半径较大且价电子数较少,金属键较弱 (5). V形 (6). sp3 (7). 0.315 (8). 12 (9). 体心 (10). 棱心 【解析】(1)紫色波长400nm~435nm,因此选项A正确;(2)K位于第四周期IA族,电子占据最高能层是第四层,即N层,最后一个电子填充子在s能级上,电子云轮廓图为球形;K的原子半径大于Cr的半径,且价电子数较少,金属键较弱,因此K的熔点、沸点比Cr低;(3)I3+与OF2互为等电子体,OF2属于V型,因此I3+几何构型为V型,其中心原子的杂化类型为sp3;(4)根据晶胞结构,K与O间的最短距离是面对角线的一半,即为nm=0.315nm,根据晶胞的结构,距离K最近的O的个数为12个;(5)根据KIO3的化学式,以及晶胞结构,K处于体心,O处于棱心。 12.反-2-己烯醛(D)是一种重要的合成香料,下列合成路线是制备D的方法之一。根据该合成路线回答下列问题: 已知:RCHO+R'OH+R"OH (1)A的名称是__________;B分子中共面原子数目最多为__________;C分子中与环相连的三个基团中,不同化学环境的氢原子共有__________种。 (2)D中含氧官能团的名称是__________,写出检验该官能团的化学反应方程式:__________________________________________________________。 (3)E为有机物,能发生的反应有__________。 a.聚合反应b.加成反应c.消去反应d.取代反应 (4)B的同分异构体F与B有完全相同的官能团,写出F所有可能的结构:________。 (5)以D为主要原料制备己醛(目标化合物),在方框中将合成路线的后半部分补充完整。 (6)问题(5)的合成路线中第一步反应的目的是______________________________。 【答案】(1). 正丁醛或丁醛 (2). 9 8 (3). 醛基 (4). +2Ag(NH3)2OH+2Ag↓+3NH3+H2O或+2Cu(OH)2+NaOH+Cu2O↓+3H2O; (5). cd (6). CH2=CHCH2OCH3、、、 (7). ; (8). 保护醛基 【详解】(1)根据流程图,A为CH3CH2CH2CHO,是丁醛;B为CH2=CHOC2H5,分子中共面原子数目最多为9个(如图:),C分子中与环相连的三个基团中,8个碳原子上的氢原子化学环境都不相同,共有8种,故答案为丁醛;9;8; (2)D为,其中含氧官能团是醛基,检验醛基可以用银氨溶液或新制氢氧化铜悬浊液,故答案为醛基;+2Ag(NH3)2OH+2Ag↓+3NH3+H2O或+2Cu(OH)2+NaOH+Cu2O↓+3H2O; (3)根据流程图,结合信息,C在酸性条件下反应生成、CH3CH2CH2CHO和CH3CH2OH以及水,因此E为CH3CH2OH,属于醇,能发生的反应有消去反应和取代反应,故选cd; (4)B的同分异构体F与B有完全相同的官能团, F可能的结构有:CH2=CHCH2OCH3、、,故答案为CH2=CHCH2OCH3、、; (5)D为,己醛的结构简式为CH3CH2CH2CH2CH2CHO,根据信息和己醛的结构,首先需要将碳碳双键转化为单键,然后在酸性条件下反应即可,故答案为; (6)醛基也能够与氢气加成,(5)中合成路线中第一步反应目的是保护醛基,故答案为保护醛基。 【点晴】本题为信息推断题,解这类题目的关键是看懂信息,明确各类有机物的基本反应类型和相互转化关系。可以由原料结合反应条件正向推导产物,也可以从产物结合条件逆向推导原料,也可以从中间产物出发向两侧推导,审题时要抓住基础知识,结合新信息进行分析、联想、对照、迁移应用、参照反应条件推出结论。解题的关键是要熟悉烃的各种衍生物间的转化关系,不仅要注意物质官能团的衍变,还要注意同时伴随的分子中碳、氢、氧、卤素原子数目以及有机物相对分子质量的衍变,这种数量、质量的改变往往成为解题的突破口。本题的难点是同分异构体的书写,特别是有限制条件的同分异构体的书写,平时要多加训练。查看更多