化学卷·2019届河南省信阳高级中学高二上学期第一次月考(2017
可能用到的相对分子质量:H 1 C 12 O 16 N 14 Fe 56 Co 59
一、选择题(每题3分,16小题,共48分)
1、下列说法错误的是
A. 工业上利用蛋白质的水解反应产生肥皂和甘油
B. Al2O3、MgO可用作耐高温材料,二氧化硅是生产光纤制品的基本原料
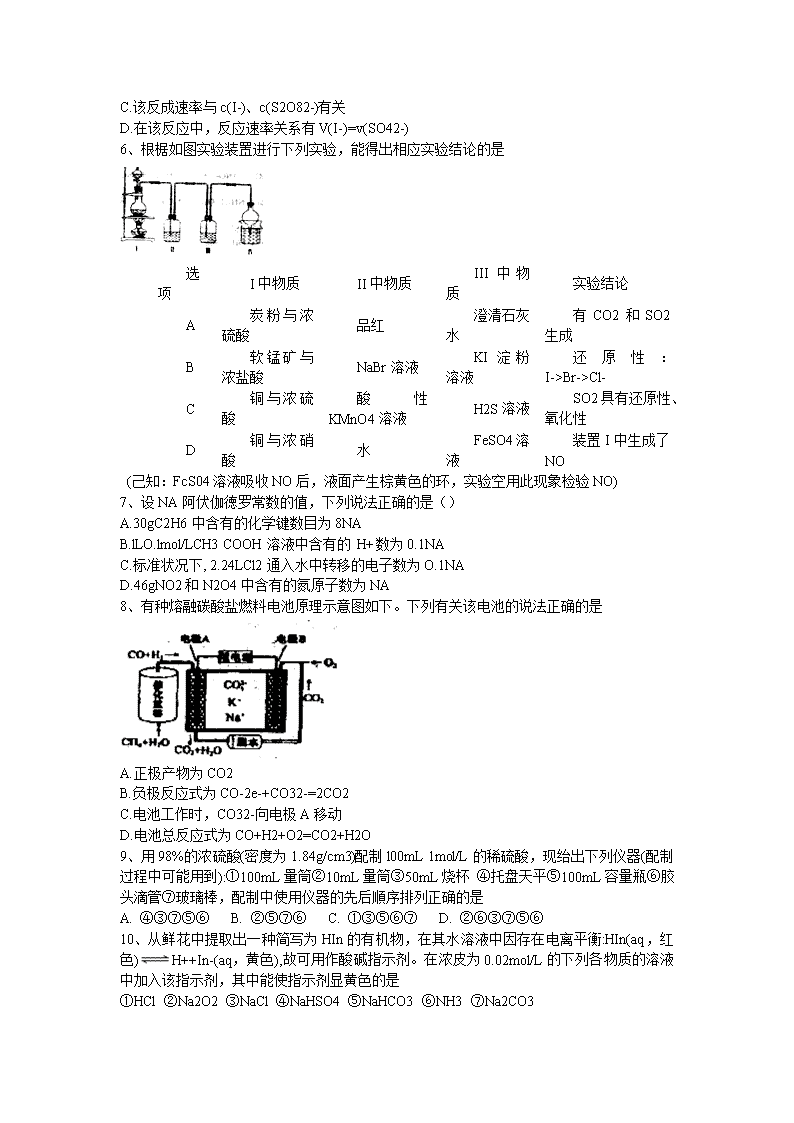
C.从石油中获得乙烯是工业生产乙烯的主要途径
D.淀粉和纤维素都是天然高分子化合物,且水解的最终产物相同
2、邻苯二甲酸二(2—乙基)己酯(代号DEHP,结构简式为)是一种塑化剂,曾有不法厂商将DEHP用作食品添加剂,造成了塑化剂污染。下面有关DEHP的说法错误的是
A.分子式为C24H38O4 B.在NaOH溶液中水解生成邻苯二甲酸与2-乙基-1-乙醇
C.一氯代物有10种 D.难溶于水,可溶于有机溶剂
3、某恒温密闭容器发生可逆反应:Z(?)+W (? )X(g) +Y (? ) △H,在t1时刻反应达到平衡。在t2时刻缩小容器体积,t3时刻再次达到平衡状态后未再改变条件。下列有关说法中不正确的是
A.Z和W在该条件下至少有一个是为气态
B.t1〜t2时间段与t3时刻后,两时间段反应体系中气体的平均摩尔质量不可能相等
C.若在该温度下此反应平衡常数表达式为K=c(X), 则t1〜t2时间段与t3时刻后的X浓度相等
D.若该反应只在高于某温度T时能自发进行,则该反应的平衡常数K随温度升高而增大
4、有机物M在氧气中燃烧仅生成CO2、CO和H2O,M的相对分子质量小于100,其中氧元素的质量分数为18.18%。已知M能和钠反应产生H2的结构有X种,不能喝钠反应的结构有Y种,则X、Y分别为
A.5、4 B.8、6 C.6、8 D.7、9
5、(NH4)2S2O8可以看成是H2O2的衍生物,在KI溶液中滴加(NH4)2S2O8溶液发生反应:(NH4)2S2O8(aq)+2KI(aq)=(NH4)2SO4(aq)+I2(s)+K2SO4(aq),正反应的活化能(Ea)为52.72kJ/mol。下列说法销误的是
A.正反应的焓变△H
Br->Cl-
C
铜与浓硫酸
酸性KMnO4溶液
H2S溶液
SO2具有还原性、氧化性
D
铜与浓硝酸
水
FeSO4溶液
装置I中生成了NO
(己知:FcS04溶液吸收NO后,液面产生棕黄色的环,实验空用此现象检验NO)
7、设NA阿伏伽徳罗常数的值,下列说法正确的是()
A.30gC2H6中含有的化学键数目为8NA
B.lLO.lmol/LCH3COOH溶液中含有的 H+数为0.1NA
C.标准状况下, 2.24LCl2通入水中转移的电子数为O.1NA
D.46gNO2和N2O4中含有的氮原子数为NA
8、有种熔融碳酸盐燃料电池原理示意图如下。下列有关该电池的说法正确的是
A.正极产物为CO2
B.负极反应式为CO-2e-+CO32-=2CO2
C.电池工作时,CO32-向电极A移动
D.电池总反应式为CO+H2+O2=CO2+H2O
9、用98%的浓硫酸(密度为1.84g/cm3)配制l00mL 1mol/L的稀硫酸,现绐出下列仪器(配制过程中可能用到):①100mL量筒②10mL量筒③50mL烧杯 ④托盘天平⑤100mL容量瓶⑥胶头滴管⑦玻璃棒,配制中使用仪器的先后順序排列正确的是
A. ④③⑦⑤⑥ B. ②⑤⑦⑥ C. ①③⑤⑥⑦ D. ②⑥③⑦⑤⑥
10、从鲜花中提取出一种简写为HIn的有机物,在其水溶液中因存在电离平衡:HIn(aq,红色)H++In-(aq,黄色),故可用作酸碱指示剂。在浓皮为0.02mol/L的下列各物质的溶液中加入该指示剂,其中能使指示剂显黄色的是
①HCl ②Na2O2 ③NaCl ④NaHSO4 ⑤NaHCO3 ⑥NH3 ⑦Na2CO3
A. ①④⑤ B. ②⑤⑥ C. ⑤⑥⑦ D. ①④
11、下列文字表述与反应的离子方程式对应且正确的是()
A. SO2通入NaClO溶液中:SO2+2ClO-+H2OSO32-+2HC1O
B. Fe3O4与足量稀HNO3反应:3Fe3O4+28H++NO3-=9Fe3++NO2↑+14H2O
C. NaHSO4溶液与 Ba(OH)2溶液混合后显中性:Ba2++OH-+H++SO42-=BaSO4↓+H2O
D. NaNO2液中加入酸性KMnO4溶液:2MnO4-+5NO2-+6H+=2Mn2++5NO3-+3H2O
12、某无色溶液中,若加入溴水,溴水褪色,若加入NH4HCO3,固体溶解并产生刺激性气味的气体,则该溶液中可能大量存在的离子组是( )
A. Na+、K+、Cl-、OH- B. Na+、Mg2+、S2-、ClO-
C. H+、Na+、SO42-、NO3- D. K+、Ca2+、OH-、SO32-
13、在含有nmolFeI2的溶液中通入Cl2,有xmolCl2发生反应。下列说法正确的是()
A.当时,反应的离子方程式为:2Fe2++Cl2=2Fe3++2Cl-
B.当x≥n时,反应的离子方程式为:2Fe2++2I-+2Cl2=2Fe3++I2+4C1-
C.当Fe2+和I-同时被氧化时,x与n的关系为x>n
D.当x=n时,反应后氧化产物的物质的量为nmol
14、有一种铁的氧化物样品,用5mol/L盐酸200mL恰好完全溶解,所得溶液还能吸收标况 下2.24L氯气,恰好使其中Fe2+全部转化成Fe3+,该样品可能的化学式是( )
A. Fe2O3 B. Fe3O4 C. Fe4O5 D. Fe5O7
15、我国科学家成功研发了甲烷和二氧化碳的共转化技术,利用分子筛催化剂高效制得乙酸,下列有关说法正确的是( )
A.所有反应物和产物中都既含极性键又含非极性键
B.消耗22.4LCO2可制得乙酸60g
C.该反应不是氧化还原反应
D. 该反应过程符合“绿色化学”原理,其原子利用率为100%
16、为了除去NO、NO2、N2O4对大气的污染,常采用氢氧化钠溶液进行吸收处理反应方程式:
2NO2+2NaOH=NaNO3+NaNO2+H2O;NO2+NO+2NaOH=2NaNO2+H2O。现有amolNO、bmolNO2、cmolN2O4组成的混合气体,能被1.0mol/L的氢氧化钠溶液完全吸收,则消耗氢氧化钠溶液的体积最小为
A.(a+b+c)L B.2(a+b+c)L C. (a+b+2c)L D.3(a+b+c)L
二、必做题
l7、(14分)碱式碳酸钴[Cox(OH)y(CO3)z,相对分子质量为365]常用作电子材料、磁性材料的添加剂.碱式碳酸钴中的Co的化合价类似与Fe3O4中Fe的化合价,其中高价态具有强氧化性,而低价态在溶液中能稳定存在,受热时可分解生成三种氧化物。为了确定其组成,某化学兴趣小组同学设计了如图所示的装置进行实验:
(1)请完成下列实验步骤:
① 称取一定量的样品置于硬质玻璃管内,称量乙、丙装置的质量;
② 按如图所示装置组装好仪器,并_______________;
③ 加热甲中玻璃管.当乙装置中________(填实验现象),停止加热;
④ 打开活塞a,缓缓通入空气数分钟后,称量乙、丙装置的质量;
⑤ 计算。
(2) 步骤④中缓缓通入空气数分钟的目的是____________。
(3) 上述实验装置中存在一个明显缺陷。为解决这一问题,可在_____(填装置连接位置)
增加一个_____装置(填字母)。
A.盛有浓硫酸的洗气瓶 B. 盛有无水氯化钙的U形管
C. 盛有P2O5的干燥管 D. 盛有碱石灰的干燥管
(4)若按正确装置进行实验,测得乙裝置增重0.36g,丙装置增重0.88g, 则该碱式碳酸钴的化学式为_________。
(5)该碱式碳酸钴与浓盐酸反应时,起酸性作用的HCl与被氧化的HC1的物质的量之比为_________。
18.(16分)氮及其化合物在工农业生产、生活、航空航天等方面应用广泛。
(1)肼(N2H4)与O2反应的能量变化如图所示。
己知,N—H键、O=O键的键能分别为391kJ/mol、497kJ/mol,则E1=_______kJ/mol,N2H4(g)中N-N键的键能为____________。
(2)某温度下,在1L恒容密闭容器中投入2mol N2H4(g)和lmolN2O4(g),发生反应:2 N2H4(g)+4 N2O4(g)=3N2(g) +4H2O (g) △H=-1097kJ/mol,该反应中 N2以平均反应速率为0.06mol/(L·min)进行10min时达到平衡状态。
①下列叙述能说明反应达到平衡状态的是________。
A.c(N2):c(H2O)=3:4 B.混合气体密度保持不变
C.混合气体平均相对分子质量保持不变 D.混合气体中N2体积分数保持不变
②平衡时,为________,混合气体总物质的量为_______。
③甲、乙是体积相同的恒容密闭容器,起始投入N2H4(g)和N2O4(g)的量相同,甲在恒温条件下达到平衡,乙在绝热条件下达到平衡。平衡时,N2H4(g)的转化率较大的是_____(填 “甲”或“乙”)
(3)如图是反应I:4NH3(g)+3O2(g)=2N2(g)+6H2O(g)和反应Ⅱ:N2(g)+O2(g)=2NO(g)的平衡常数的负对数(pK=-lgK)与温度T的关系。
①根据图中的数据判断,下列说法正确的是_______。
a.反应I为放热反应
b.常温下,反应I的速率很大,二而反应Ⅱ的速率很小
c.升高温度.反应I的速率减小,反应Ⅱ的速率增大
d.x K时,反应I和反应Ⅱ的反应程度相差很大
②下列叙述对反应I自发性判断正确的是_____。
A. 较高温度下能自发进行
B. 较低温度下能自发进行
C. 所有温度下均能自发进行
D. 任何温度下都不能自发进行
19.(14分)二氧化锗被广泛用于制作高纯金属锗、锗的化合物、化工催化剂及医药工业, 某工厂用褐煤烟灰(主要成分为C、GeO2,还有少量Al2O3和SiO2)为原料制备GeO2,其流程如 下:
己知: GeO2不溶于水,不跟水反应,是以酸性为主的两性氧化物,可溶于浓盐酸生成四氯化锗,也可溶于强碱溶液,生成锗酸盐。操作X为蒸馏
(1)褐煤灰中加入NaOH和Na2CO3固体进行焙烧时,要加入过量的粉碎的NaOH和Na2CO3固体,其原因是_________________。写出GeO2与NaOH反应的化学方程式:
__________。
(2)为提高含锗化合物的浸出率,除采用水浸取焙烧物2小时外,还可采取的措施有_____________。(写出两条即可)
(3)浸出液中滴加7mol/L盐酸,调节溶液的pH约为11,目的是__________。
(4)滴加7mol/L盐酸使滤液“酸化”,若滤液“酸化”时酸度不够,溶液会出现明显的浑浊,该沉淀物是________________,(写化学式)
(5)GeCl4的沸点是83.1℃,其电子式为______________。
(6)单质锗可用作电子工业的半导体材料。由纯净的GeO2和H2在加热的条件下可制得单质锗.该反应的化学方程式为_________________。
三、选做题(共8分,请从20、21题任选一题作答)
20、CH4、NH3、H2O和HF均为含10e-的分子。
(1)C、N、O、F四种元素中,与C基态原子的核外未成对电子数相等的元素是_______(写元家名称),其基态原子的核外电子排布式为_____________。
(2)C、N、O、F四种元索第电离能由大到小的顺序是__________(用元素符号表示)
(3) CH4、NH3和H2O分子中,从原子轨道的重叠方向来说.三种分子的中心原子的杂化轨道类型均为__________。
(4) CH4燃烧生成 CO、CO2和H2O
①在CO气流中轻微加热金属镍(Ni),生成无色挥发性液态Ni(CO)4, 423K时 Ni(CO)4分解为Ni和CO,从而制得高纯度的Ni粉..试推测四碳基镍的晶体类型为_________。
②CO2、H2O和NH3反应生成(NH4)2CO3,根据电子对互斥理论知CO32-的空间构型为_____。
(5) CH4、H2O和HF三种物质中H2O的熔沸点最高,其原因是__________。
(6)硅晶体的结构跟金刚石的结构相似.而SiO2的结构相当于在硅晶体结构中每个硅与硅 化学键之间插入一个O原子。观察下图金刚石的结构,分析SiO2的空间结构中,Si,O形成的最小环上O原子的数目是_______________。
21.己知氨基酸可发生如下反应:
D、E的相对分子质量分别为162和144,可发生如下物质转化关系。如下图所示:
(1)写出B、D的结构简式:B________,D_________。
(2)写出C→E的化学方程式:_________________。
(3)写出C→D的化学方程式:_________________。
一、选择题
1-5:ABBBB 6-10:CDCDC 11-16:DADCD C
17、(每空2分)(1)②检查装置气密性;③不再有气泡产生;
(2)将装置中生成的CO2和水蒸汽全部排入乙、丙装置中;
(3)装置甲前;D;
(4)Co3(OH)4(CO3)2;(5)3:1
18、(每空2分)(1)2218;157kJ/mol;
(2)①CD;②4;3.8mol;③甲;
(3)①ad;②C。
19、(每空2分)
(1)使GeO2尽可能转化为Na2GeO3,且加快GeO2与NaOH和碳酸钠反应的速率;GeO2+2NaOH= Na2GeO3+H2O;
(2)搅拌,适当升高温度;
(3)使AlO2-和SiO32-形成沉淀而除去;
(4)H2GeO3(或GeO2·nH2O)
(5);
(6)GeO2+2H2Ge+2H2O。
20、(1)氧(1分);1s22s22p4;(1分)
(2)F>N>O>C(1分);(3)平面三角形(1分);
(4)①分子晶体(1分)②NO3-(或SiO32-、BF3等)(1分);
(5)H2O分子间含有氢键且氢键数目最多(1分);
(6)6(1分)
21、(1);;
(2)
(3)