- 2021-08-06 发布 |
- 37.5 KB |
- 8页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2017-2018学年重庆市綦江区高二上学期期末联考化学试题(Word版)
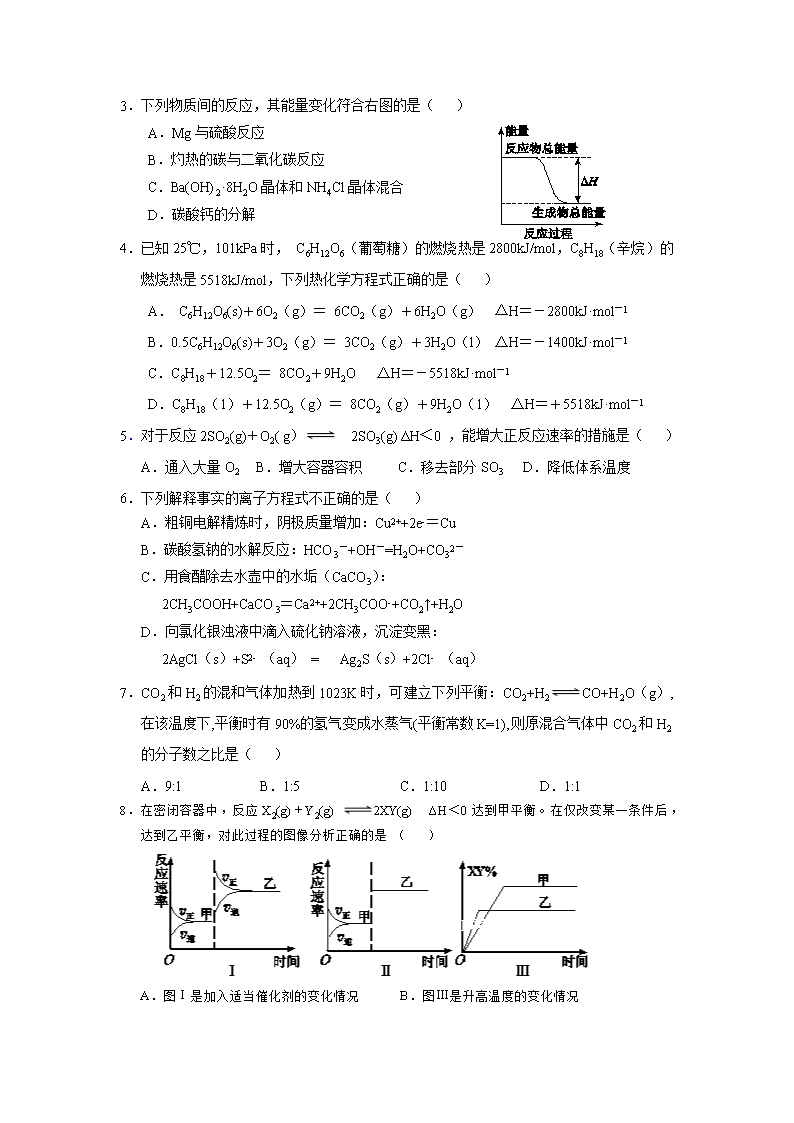
2017-2018学年重庆市綦江区高二上学期期末联考 化学试题 试卷分为第I卷(选择题)和第II卷(非选择题)两部分。满分100分,考试时间100分钟。 注意事项: 1.答题前,务必将自己的姓名、准考证号等填写在答题卷规定的位置上。 2.答选择题时,必须使用2B铅笔将答题卷上对应题目的答案标号涂黑。 3.答非选择题时,必须使用0.5毫米黑色签字笔,将答案书写在答题卷规定的位置上。 4.考试结束后,将答题卷交回。 5.可能用到的相对原子质量: H-1 C-12 Pb-207 Na-23 O-16 S-32 第I卷(选择题,共54分) 一、选择题(本大题共18个小题,每小题只有一个正确选项,每小题3分,共54分) 1.下列说法错误的是( ) A.用甲醇、乙醇代替汽油是应对化石能源危机的一种有效措施 B.化学反应方向的判断要综合考虑熵效应和能量效应 C.在电解水制取H2和O2时,为了增强液体的导电性,可加入CuCl2 D.配制FeCl3溶液时,为防止出现浑浊,可向该溶液中加入少量盐酸 2.下列说法错误的是( ) A.蔗糖、硫酸钡和HF分别属于非电解质、强电解质和弱电解质 B. Na、Mg、Al用电解法冶炼 C.石油、沼气和水煤气分别属于化石能源、可再生能源和二次能源 D.酸碱指示剂可用于测定溶液pH且精确度很高 3.下列物质间的反应,其能量变化符合右图的是( ) A.Mg与硫酸反应 B.灼热的碳与二氧化碳反应 C.Ba(OH)2·8H2O晶体和NH4Cl晶体混合 D.碳酸钙的分解 4.已知25℃,101kPa时, C6H12O6(葡萄糖)的燃烧热是2800kJ/mol,C8H18(辛烷)的燃烧热是5518kJ/mol,下列热化学方程式正确的是( ) A. C6H12O6(s)+6O2(g)= 6CO2(g)+6H2O(g) △H=-2800kJ·mol-1 B.0.5C6H12O6(s)+3O2(g)= 3CO2(g)+3H2O(l) △H=-1400kJ·mol-1 C.C8H18+12.5O2= 8CO2+9H2O △H=-5518kJ·mol-1 D.C8H18(1)+12.5O2(g)= 8CO2(g)+9H2O(1) △H=+5518kJ·mol-1 5.对于反应2SO2(g)+O2( g) 2SO3(g) ΔH<0 ,能增大正反应速率的措施是( ) A.通入大量O2 B.增大容器容积 C.移去部分SO3 D.降低体系温度 6.下列解释事实的离子方程式不正确的是( ) A.粗铜电解精炼时,阴极质量增加:Cu2++2e-=Cu B.碳酸氢钠的水解反应:HCO3-+OH-=H2O+CO32- C.用食醋除去水壶中的水垢(CaCO3): 2CH3COOH+CaCO3=Ca2++2CH3COO-+CO2↑+H2O D.向氯化银浊液中滴入硫化钠溶液,沉淀变黑: 2AgCl(s)+S2- (aq) = Ag2S(s)+2Cl- (aq) 7.CO2和H2的混和气体加热到1023K时,可建立下列平衡:CO2+H2CO+H2O(g),在该温度下,平衡时有90%的氢气变成水蒸气(平衡常数K=1),则原混合气体中CO2和H2的分子数之比是( ) A.9:1 B.1:5 C.1:10 D.1:1 8.在密闭容器中,反应X2(g)+Y2(g) 2XY(g) ΔH<0达到甲平衡。在仅改变某一条件后,达到乙平衡,对此过程的图像分析正确的是( ) A.图Ⅰ是加入适当催化剂的变化情况 B.图Ⅲ是升高温度的变化情况 C.图Ⅲ是增大压强的变化情况 D. 图Ⅱ是扩大容器体积的变化情况 9.相同温度下,体积均为0.25 L的两个密闭容器中发生反应:X2(g)+3Y2(g) 2XY3(g) ΔH=-92.6 kJ·mol-1实验测得反应在起始、达到平衡时的有关数据如下表所示: 起始时各物质物质的量/mol 达平衡时体系能量的变化 容器 X2 Y2 XY3 容器①恒温恒容 1 3 0 放热 23.15 kJ 容器②恒温恒压 1 3 0 Q(Q>0) 下列叙述正确的是( ) A.容器①、②中反应物X2的转化率相同 B.达平衡时,两个容器中XY3的物质的量浓度均为2 mol·L-1 C.容器①、②达到平衡时间相同 D.容器②, Q大于23.15 kJ 10.25℃时,H2O H++OH– △H>0,下列能够使水电离平衡正向移动,且pH增大的措施是( ) A.加入稀氨水 B.加热 C.加入稀硫酸 D.加入CH3COONa固体 11.25℃时,在一定体积pH = 12的NaOH溶液中, 加入一定体积0.01 mol/L的NaHSO4溶液,此时混合溶液的pH = 11。若反应后溶液的体积等于NaOH 溶液与NaHSO4溶液的体积之和,则NaOH溶液与NaHSO4溶液的体积比是( ) A.1∶9 B.10∶1 C.11∶9 D.1∶2 12.下列无色澄清的溶液中,可能大量共存的离子组是( ) A.Cl-、SO32-、Fe2+、H+ B.NH4+、Al3+、NO3-、HCO3- C. Na+、K+、OH-、AlO2- D.K+、Na+、SO42-、MnO4- 13.室温下,pH均为2的两种一元酸HA和HB各1mL,分别加水稀释,pH随溶液体积的变化曲线如右图所示。下列说法正确的是( ) A. 稀释前的HA和HB溶液分别与等物质的量的NaOH恰 好反应,消耗酸的体积:V(HA)>V(HB) B. a点溶液的导电性比c点溶液的导电性弱 C. HB是强酸 D. a、b两点溶液中水的电离程度相同 14.对滴有酚酞试液的下列溶液,操作后颜色变深的是( ) A.KAl(SO4)2溶液加热 B. Na2CO3溶液加热 C.氨水中加入少量NH4Cl固体 D.NH4NO3溶液中加入少量NaNO3固体 15.结合下图判断,下列叙述正确的是( ) A.图Ⅲ盐桥的原电池工作时,铜电极上发生氧化反应,CuSO4溶液蓝色变深 B.Ⅰ和Ⅱ中负极反应均是Fe-2e-===Fe2+ C.Ⅰ和Ⅱ中正极反应均是O2+2H2O+4e-===4OH- D.Ⅰ和Ⅱ中分别加入少量K3[Fe(CN)6]溶液,Ⅱ有蓝色沉淀 16.下图各容器中盛有海水,铁在其中被腐蚀时由快到慢的顺序是 ( ) A.④>②>①>③ B.②>①>③>④ C.④>②>③>① D.③>②>④>① 放电 充电 17.铅蓄电池是典型的可充型电池,电池总反应式为: Pb+PbO2+4H++2SO42-2PbSO4+2H2O,下列说法正确的是( ) A.放电时,负极的电极反应式是 : PbO2+2e-+4H++SO42-=PbSO4+2H2O B.放电时,电解液中H2SO4的浓度将不变 C.充电时,当外电路通过1mol电子时,原负极板的质量理论上减少48g。 D.充电时,阳极电极反应式为:PbSO4+2e-=Pb+SO42-, 18.常温时,下列各溶液中,物质的量浓度关系错误的是( ) A.在0.1 mol·L-1NaClO溶液中,c(Na+)=c(HClO)+c(ClO-) B.10 mL 0.1 mol/L NH4Cl溶液与5 mL 0.2 mol/L NaOH溶液混合: c(Na+)=c(Cl-)>c(OH-)>c(H+) C.10 mL pH=2的HCl溶液与10 mL 0.01 mol·L-1Ba(OH)2溶液充分混合,若混 合后溶液的体积为20 mL,则溶液的: c(Cl-)+c(OH-)=c(Ba2+)+c(H+) D.10 mL 0.5 mol/L Na2CO3溶液中慢慢滴入10 mL 0.5 mol/L盐酸后的溶液: c(CO32-)+c(OH-)=c(H2CO3)+c(H+) 第II卷(非选择题,共46分) 二、非选择题(共46分) 19.(12分)NaOH和盐酸都是中学化学常见的试剂 (一)某同学用0.200 0 mol·L-1标准盐酸滴定待测烧碱溶液浓度 (1)将5.0g烧碱样品( 杂质不与酸反应)配成250 mL待测液,取10.00 mL待测液,用________式滴定管量取,右图是某次滴定时的滴定管中的液面,其读数为________ mL。 (2)由下表数据, NaOH的百分含量是________。 滴定次数 待测NaOH溶液体积(mL) 标准盐酸体积 滴定前的刻度(mL) 滴定后的刻度(mL) 第一次 10.00 0.40 20.50 第二次 10.00 4.10 24.00 (3)用标准盐酸滴定某浓度的NaOH溶液,下列操作可能使测定结果偏高的是( ) A.用蒸馏水洗锥形瓶后,直接取10.00 mL待测液注入锥形瓶中 B.酸式滴定管在装酸液前未用标准盐酸溶液润洗2—3次 C.开始实验时酸式滴定管尖嘴部分有气泡,在滴定过程中气泡消失 D.对酸式滴定管,滴定前正确读数,滴定后俯视读数 (二)50 mL 0.50 mol·L-1盐酸与50 mL 0.55 mol·L-1NaOH溶液测定计算中和反应的反应热。回答下列问题: (4)从实验装置上看,图中缺少的一种玻璃用品是__________。 如改用0.0275 mol NaOH固体与该盐酸进行实验,则实验中测 得的“中和热”数值将________( 填“偏大”、“偏小”或“无影响”)。 (5)已知盐酸和NaOH稀溶液发生中和反应生成0.1 mol H2O时, 放出5.73 kJ的热量,则表示该反应中和热的热化学方程式为:_______________。 (三)常温时,向盛有0.1 mol·L-1Mg2+溶液的试管中滴加适量的NaOH溶液,到pH为11.0时(已知Ksp Mg(OH)2=5.61×10‾12) (6)此时上层清液中c(Mg2+)=________ mol·L-1 20.(10分)在2L密闭容器内,800℃时反应:2NO(g)+O2(g) 2NO2(g) ,体系中n(NO2)随时间的变化如表: 时间(s) 0 1 2 3 4 5 n(NO2)(mol) 0.00 0.010 0.012 0.013 0.013 0.013 (1)写出该反应的平衡常数表达式:K= 。 已知:K(350℃)查看更多
相关文章
- 当前文档收益归属上传用户