- 2021-08-06 发布 |
- 37.5 KB |
- 10页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
河南省三市2020届高三下学期联考试题 化学
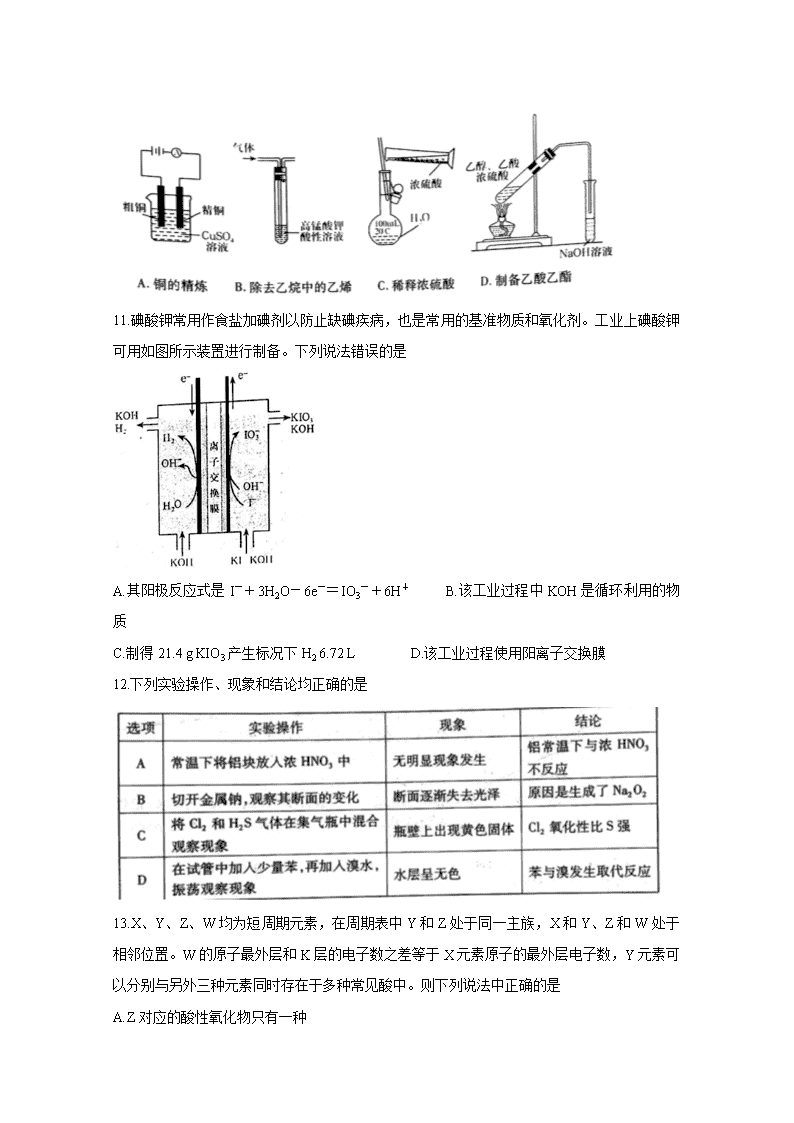
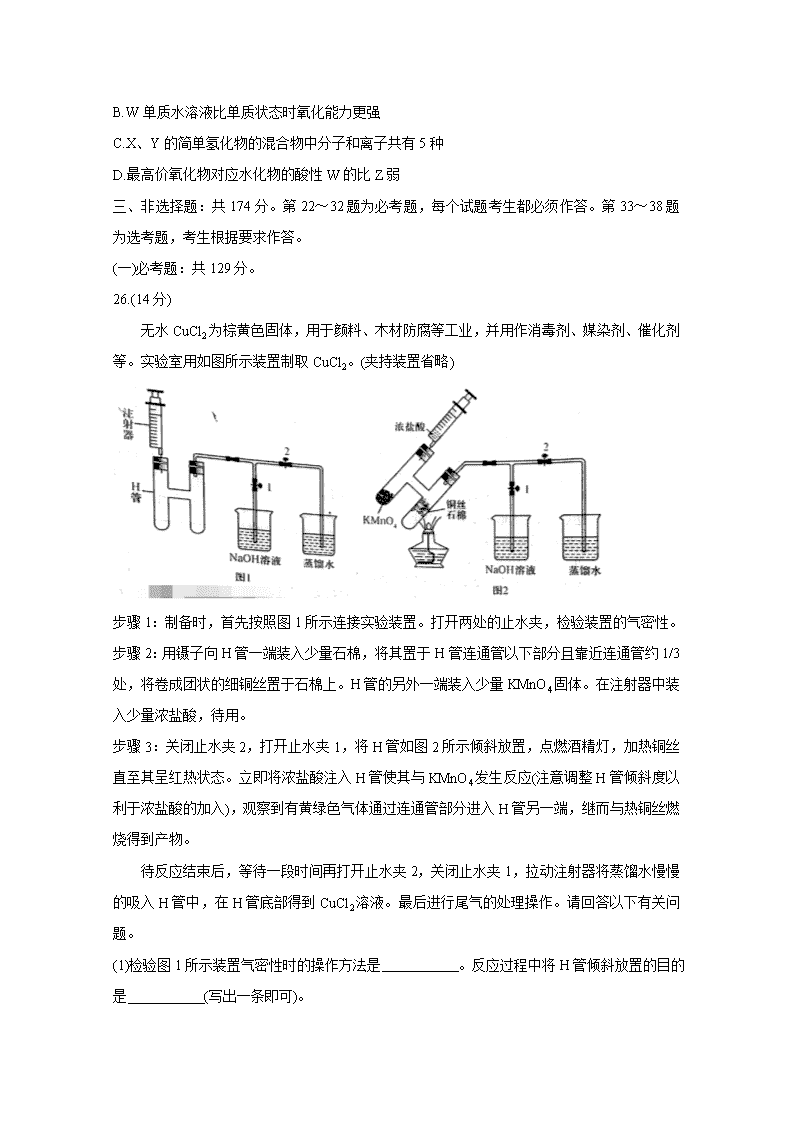
许昌济源平顶山2020年高三第二次质量检测 理科综合 化学部分 注意事项: 1答卷前,考生务必将自己的姓名、考生号等填写在答题卡和试卷指定位置上。 2.回答选择题时,选出每小题答案后,用铅笔把答题卡上对应题目的答案标号涂黑。如需改动,用橡皮擦干净后,再选涂其它答案标号。回答非选择题时将答案写在答题卡上,写在本试卷上无效。 3.考试结束后,将答题卡交回。 可能用到的相对原子质量:H1 Li7 C12 N14 O16 P31 K39 Fe56 I127 一、选择题:本题共13小题,每小题6分,共78分。在每小题给出的四个选项中,只有一项是符合题目要求的。 7.磁山(在今河北省邯郸市武安)是我国四大发明之一指南针的发源地。据《古矿录》记载:《明史地理志》称:“磁州武安县西南有磁山,产磁铁石。”文中的磁铁石的主要化学成分应该是 A.Fe2O3 B.FeO C.Fe3O4 D.Fe(OH)3 8.下列说法中正确的是 A.酒精的浓度越大其消毒杀菌的效果越好 B.人体需要的各种微量元素必须通过保健食品进行补充 C.谷氨酸钠主要是以石油或煤为原料合成的化工产品 D.淀粉等糖类物质是人体需要能量的主要来源 9.环之间共用一个碳原子的化合物称为螺环化合物,螺[2,3]己烷的结构为,已知环烷烃的碳原子数越少越容易开环加成。下列说法中正确的是 A.的名称为螺[4,3]辛烷 B.的所有碳原子处于一个平面 C.螺[2,3]己烷是己烯的同分异构体 D.螺[2,3]己烷加氢可能生成己烷 10.下列实验方法中正确的是 11.碘酸钾常用作食盐加碘剂以防止缺碘疾病,也是常用的基准物质和氧化剂。工业上碘酸钾可用如图所示装置进行制备。下列说法错误的是 A.其阳极反应式是I-+3H2O-6e-=IO3-+6H+ B.该工业过程中KOH是循环利用的物质 C.制得21.4 g KIO3产生标况下H2 6.72 L D.该工业过程使用阳离子交换膜 12.下列实验操作、现象和结论均正确的是 13.X、Y、Z、W均为短周期元素,在周期表中Y和Z处于同一主族,X和Y、Z和W处于相邻位置。W的原子最外层和K层的电子数之差等于X元素原子的最外层电子数,Y元素可以分别与另外三种元素同时存在于多种常见酸中。则下列说法中正确的是 A.Z对应的酸性氧化物只有一种 B.W单质水溶液比单质状态时氧化能力更强 C.X、Y的简单氢化物的混合物中分子和离子共有5种 D.最高价氧化物对应水化物的酸性W的比Z弱 三、非选择题:共174分。第22~32题为必考题,每个试题考生都必须作答。第33~38题为选考题,考生根据要求作答。 (一)必考题:共129分。 26.(14分) 无水CuCl2为棕黄色固体,用于颜料、木材防腐等工业,并用作消毒剂、媒染剂、催化剂等。实验室用如图所示装置制取CuCl2。(夹持装置省略) 步骤1:制备时,首先按照图1所示连接实验装置。打开两处的止水夹,检验装置的气密性。 步骤2:用镊子向H管一端装入少量石棉,将其置于H管连通管以下部分且靠近连通管约1/3处,将卷成团状的细铜丝置于石棉上。H管的另外一端装入少量KMnO4固体。在注射器中装入少量浓盐酸,待用。 步骤3:关闭止水夹2,打开止水夹1,将H管如图2所示倾斜放置,点燃酒精灯,加热铜丝直至其呈红热状态。立即将浓盐酸注入H管使其与KMnO4发生反应(注意调整H管倾斜度以利于浓盐酸的加入),观察到有黄绿色气体通过连通管部分进入H管另一端,继而与热铜丝燃烧得到产物。 待反应结束后,等待一段时间再打开止水夹2,关闭止水夹1,拉动注射器将蒸馏水慢慢的吸入H管中,在H管底部得到CuCl2溶液。最后进行尾气的处理操作。请回答以下有关问题。 (1)检验图1所示装置气密性时的操作方法是 。反应过程中将H管倾斜放置的目的是 (写出一条即可)。 (2)浓盐酸与KMnO4反应的化学方程式为 。热铜丝燃烧得到产物时,铜丝上方的H管中观察到的现象是 。反应结束后,“等待一段时间”再进行后续操作的原因是 。 (3)实验观察到蒸馏水慢慢地吸入H管中时,H管底部得到CuCl2溶液的颜色,有一个从黄绿色到绿色再到蓝绿色的变化过程。已知在溶液中[Cu(H2O)4]2+呈蓝色,[CuCl4]2-呈黄色。请用方程式表示溶液颜色变化的化学平衡体系: 。 (4)H管中铜丝不直接放置在右管底部的优点是 (写出两条即可)。 27.(14分) 目前的锂离子电池的正极材料多是LiCoO2、LiMn2O4、LiFePO4和双离子传递型聚合物等。改良正极材料的性能是锂离子电池领域的重点方向,如用碳包覆LiFePO4和向其中掺杂金属银等。下列过程是制备该正极材料的流程图: 回答下列问题: (1)LiFePO4中铁元素的化合价为 价。已知原料是Li2CO3、FeC2O4·2H2O、NH4H2PO4和C6H12O6的混合物,其中Li、Fe、P三种元素的物质的量比为1:1:1,C6H12O6的用量占原料总质量的5%。若原料的质量为1000g,则需要称取NH4H2PO4的质量为 (保留两位小数)。 (2)将原料先行研磨4h目的是 。为了更快得到前驱体粉末,除了保持温度在50℃外,还应进行的常见操作方法是 。 (3)两次焙烧均需要在高纯氮气环境下进行,原因是 。葡萄糖分解产生的碳除了提供还原性环境,提高产物纯度,而且可以阻止晶粒的聚集长大,控制颗粒形状,提高LiFePO4的电导率。则葡萄糖分解的化学反应方程式(分解过程中只有C一种单质生成)为 。600℃加热时硝酸银发生分解生成红棕色气体和3种常见单质(其中两种气体单质物质的量比为2:7),则分解时的化学反应方程式为 。 (4)如图所示是用LiFePO4/Ag/C做正极材料制成的纽扣锂离子电池组装示意图。充电时,其正、负极材料所发生反应的电极方程式分别是 、 (锂离子电池是靠xLi+在两极的嵌入和嵌出进行工作)。 28.(15分) 二甲醚(CH3OCH3)是无色气体,是柴油的理想替代燃料。清华大学王志良等研究了,由合成气(组成为H2、CO和少量的CO2)一步法制备二甲醚的问题,其中的主要过程包括以下三个反应: (i)CO(g)+2H2(g)=CH3OH(g) △H1=-90.1 kJ·mol-1 (ii)CO(g)+H2O(g)=CO2(g)+H2(g) △H2=-41.1 kJ·mol-1 (iii)2CH3OH(g)=CH3OCH3(g)+H2O(g) △H3=-24.5 kJ·mol-1 (1)由H2和CO制备二甲醚(另一产物为CO2)的热化学方程式为 。 (2)合成气初始组成为n(H2)/n(CO)/n(CO2)=0.67/0.32/0.01的反应体系。在250℃和5.0MPa条件下,在1 L密闭容器中经10min达到化学平衡时,各组分的物质的量如下表: 则反应(iii)在该条件下的平衡常数是 ;在反应进行的10min内,用CH3OH表示的反应(i)的平均速率是 。 (3)课题组探究了外界条件,对合成气单独合成甲醇反应体系和直接合成二甲醚反应体系的影响。 ①图1和图2显示了温度250℃和5.0MPa条件下,合成气组成不同时,反应达到平衡时的情况。(图中M代表甲醇、D代表二甲醚、D+M代表甲醇和二甲醚。下同) 由图可知,随着合成气中H2所占比例的提高,合成甲醇的反应体系中,CO转化率的变化趋势是 。对于由合成气直接合成二甲醚的反应体系,为了提高原料转化率和产品产率,n(H2)/n(CO+CO2)的值应控制在 附近。 ②在压强为5.0 MPa、n(H2)/n(CO+CO2)=2.0及n(CO)/n(CO2)=0.9/0.04的条件下,反应温度对平衡转化率和产率的影响如图3和图4所示。 课题组认为图3所示的各反应物的转化率变化趋势符合反应特点,其理由是 。图中显示合成气直接合成二甲醚体系中,CO的转化率明显高于H2的转化率,原因是 。图4显示随着温度增大,合成气单独合成甲醇时的产率,要比合成气直接合成二甲醚时的产率减小的快,原因是 。 (二)选考题:共45分。请考生从给出的2道物理题、2道化学题、2道生物题中每科任选一道作答。如果多做,则每科按所做的第一题计分。 35.[化学——选修3:物质结构与性质](15分) 锌在电池制造方面有着重要的作用,也是人体必需的微量元素之一。它与常见的非金属都可以形成重要的化合物。 (1)Zn的核外电子排布式是[Ar] 。 (2)Zn的各级电离能数据如下表所示: ①请依据表中数据说明锌的常见化合价为+2的原因是 。 ②氧、硫、氯三种常见非金属的电负性,由大到小的顺序是 。二氯化硫为鲜红色液体,熔点-78℃,则其晶体中微粒间的作用力应属于 ,它的分子中中心原子具有的孤电子对数是 。 (3)氯化锌易溶于水,在水中形成配合物H[ZnCl2(OH)],H[ZnCl2(OH)]在水中电离时的离子方程式为 。 (4)晶胞的空隙问题是晶胞研究的重要内容。 ①已知面心立方晶胞的四面体空隙和八面体空隙状况如上图所示。面心立方晶胞的每个晶胞中,堆积球数:四面体空隙数:八面体空隙数= 。 ②根据立方ZnS晶胞示意图,描述在每个晶胞中,锌离子填充在硫离子的立方面心晶胞空隙中的方式为 。离坐标参数为(0,0,0)的硫离子最近的锌离子坐标参数为(参数数值限定为正值) 。 36.[化学——选修5:有机化学基础](15分) 对甲基苯甲醚是我国CB2760-86规定为允许使用的食用香料。常用于烘烤食品、软糖、冰冻乳制品。根据以下与其有关的合成有机物H的路线,回答问题。 (1)有机物A的名称是 ,有机物C的结构简式是 。 (2)E→F的反应类型是 ,F→G的反应类型是 。 (3)已知G→H的反应过程是,G先与NaBH4以物质的量比4:1发生加成反应,然后再水解生成H以及钠和硼的氢氧化物,则G→H的总化学方程式为 。 (4)能与FeCl3溶液发生显色反应的E的同分异构体中,其苯环上的一氯取代物最多有 种。 (5)已知,请结合题中信息设计由合成的合成路线(其他试剂任选): 。 许昌济源平顶山2020年高三第二次质量检测 理科综合能力测试(化学部分) 参考答案及评分标准 评卷说明:1. 简答题学生只要回答出最核心的要点即可给分。学生多答只要无错误不扣分。 2.化学方程式化学式正确给1分,配平给1分,条件和状态符号不占分。 3. 热化学方程式,方程式和焓变各占1分。 一、选择题(每小题6分,本大题共13小题。每小题给出的四个选项中,只有一项是符合题目要求的。) 题号 7 8 9 10 11 12 13 答案 C D D A A C B 三、非选择题: (一)必考题(11题,共129分) 26.(14分)(1)慢慢向上拉动注射器(2分) 便于用酒精灯加热(或有利于氯气与铜丝的接触等)(2分) (2)2KMnO4+16HCl(浓)==2KCl + 2MnCl2 +5 Cl2↑ +8H2O(2分) 有棕黄色的烟产生(2分) 防止蒸馏水使热的H管炸裂 (2分) (3)[CuCl4]2- +4H2O [Cu(H2O)4]2+ +4Cl—(2分,反应物和产物互换或误写成“=”也给分) (4)①有利于氯气与铜丝接触 ②有利于观察溶液的形成过程 ③防止(或减少)反应过程中H管炸裂等(答出两点即可,共2分) 27.(14分)(1)+2(1分) 328.90 g ~329.07 g 之间均给分(1分) (2)粉碎原料,增强后续过程中的焙烧效果(1分) 不断搅拌(1分) (3)防止碳的燃烧和二价铁的氧化(2分) C6H12O6 △ 6C + 6H2O(2分) 6AgNO3 △ 6Ag + 2N2 ↑ + 7O2 ↑ + 2NO2 ↑ (2分) (4)LiFePO4 == xLi+ + Li1-xFePO4 + xe— (2分) xLi+ + xe— + C6 == LixC6(或Li+ +e— == Li等)(2分) 28.(15分) (1)3CO(g) + 3H2(g) == CO2(g) + CH3OCH3(g) △H = -245.8kJ•mol-1(2分) (2)11(2分) 0.024mol·L—1·min—1(2分) (3)①由小逐渐变大(2分) 1(2分) ②反应体系中的所有反应均为放热反应(1分) 反应(ii)有H2生成(2分) 反应(i)的焓变大于反应(iii)的焓变(2分) (二)选考题: 35. 化学——选修3:物质结构与性质](15分) (1)3d104s2(1分) (2) ①因为第2和第3级电离能的差值远高于第2和第1级的差值(2分) ② O > Cl > S (1分) 范德华力(2分) 2(2分) (3)H[ZnCl2(OH)] == [ZnCl2(OH)]— +H+ (2分) (4)①1:2:1(2分) ②锌离子填充到硫离子面心晶胞的一半四面体空隙中(2分,或锌离子填充到硫离子面心晶胞的8个四面体空隙的4个中或用4个锌离子的具体坐标参数表示。无论哪种描述缺少定量描述只给1分) (1/4,1/4,1/4)(1分) 36.[化学——选修5:有机化学基础](15分) (1)甲苯(2分) (2分)(2)加成(或还原)反应(2分) 氧化反应(2分) (3) (4)4(2分) (说明:学生如果把用O3氧化时的产物先写成得到醛基,然后再氧化为羧基也给分,羧基—CO2H也可写成—COOH)。查看更多