- 2021-08-06 发布 |
- 37.5 KB |
- 5页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2019届一轮复习全国通用版第30讲化学平衡题的题型结构及解题策略学案
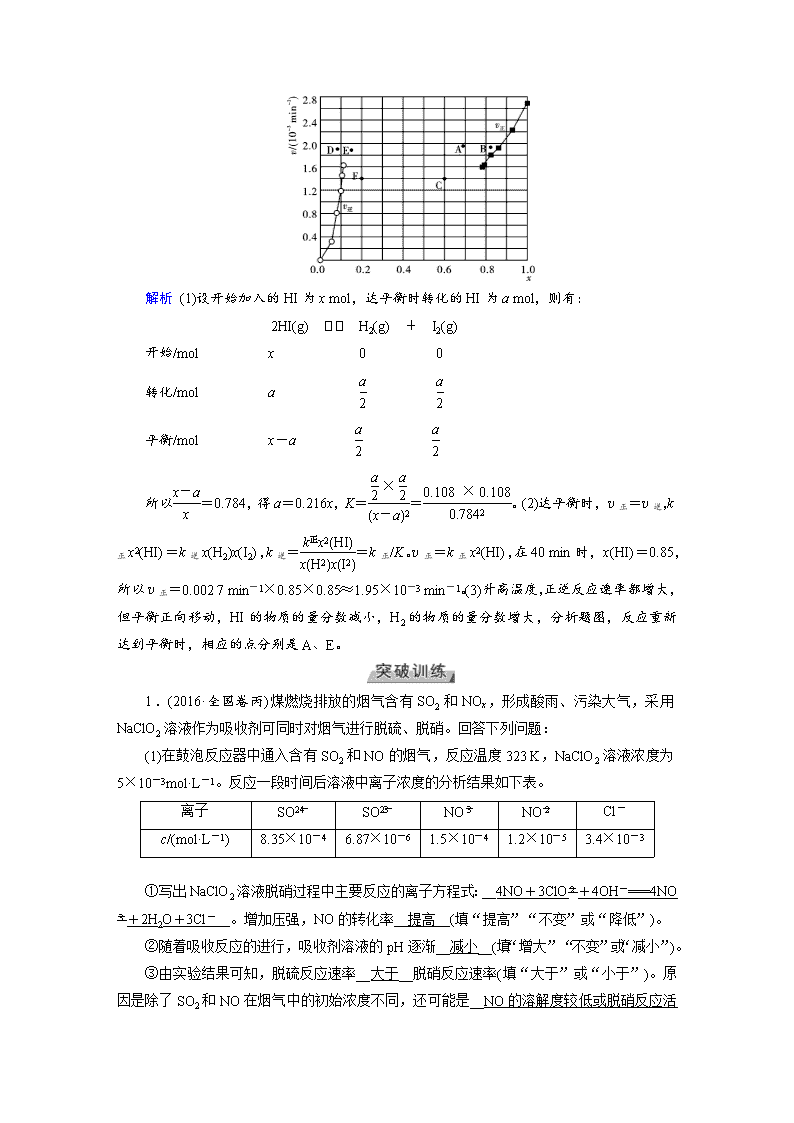
第30讲 高考必考题突破讲座 ——化学平衡题的题型结构及解题策略 (见学用讲义P151) 题型特点 考情分析 命题趋势 化学平衡是化学反应原理的重要组成部分,也是高考重点考查的主干知识。近年高考试题中的化学平衡题呈现出了如下三个特点:(1)体现化学学科思想;(2)注重对图像、图表和数据的分析和判断;(3)注重平衡移动理论在日常生活、科学研究领域等方面的迁移应用。 2016,全国卷甲,28T 2016,全国卷丙,13T 2016,北京卷,13T 化学平衡中包含很广阔的创新空间。预计2019年高考化学平衡会在情境、取材上创新,化学平衡中实验分析、设计、化工生产中选择适宜温度、酸碱性环境等将是热点考查内容。 分值:6~10分 1.化学平衡状态的判断 判断化学平衡状态的方法——“正逆相等,变量不变” 2.化学平衡图像分析 3.化学平衡移动原理在化工生产中的应用 化工生产适宜条件 原则 从化学反应速率分析 既不能过快,又不能太慢 从化学平衡移动分析 既要注意外界条件对速率和平衡影响的一致性,又要注意二者影响的矛盾性 从原料的利用率分析 增加易得廉价原料,提高难得高价原料的利用率,从而降低生产成本 从实际生产能力分析 如设备承受高温、高压能力等 从催化剂的使用活性分析 注意催化剂的活性对温度的限制 1.极值思想 该方法常用来判断混合物的组成,平衡混合物中各组分含量的范围等。解题的关键是将问题合理假设成某种“极值状态”,从而进行极端分析。一般来说,对于混合物成分的确定,常把混合物看成某单一组分进行讨论;对于化学平衡来说,常假设可逆反应向某一反应方向进行到底,再进行讨论。 2.虚拟思想 所谓虚拟思想,就是在分析或解决问题时,根据需要和可能,虚拟出能方便解题的对象,并以此为中介,实现由条件向结论转化的思维方法。即把一种状态与另一种状态平衡时的情况(如转化率、物质的量浓度及含量等)进行比较,可以假设一个中间转化过程,便于比较。该方法的思维模型为: →→ [例1]Bodensteins研究了下列反应: 2HI(g)H2(g)+I2(g) 在716 K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如下表: t/min 0 20 40 60 80 120 x(HI) 1 0.91 0.85 0.815 0.795 0.784 x(HI) 0 0.60 0.73 0.773 0.780 0.784 (1)根据上述实验结果,该反应的平衡常数K的计算式为____。 (2)上述反应中,正反应速率为v正=k正x2(HI),逆反应速率为v逆=k逆x(H2)x(I2),其中k正、k逆为速率常数,则k逆为__k正/K__(以K和k正表示)。若k正=0.002 7 min-1,在t=40 min时,v正=__1.95×10-3__min-1。 (3)由上述实验数据计算得到v正~x(HI)和v逆~x(H2)的关系可用下图表示。当升高到某一温度时,反应重新达到平衡,相应的点分别为__A、E__(填字母)。 解析 (1)设开始加入的HI为x mol,达平衡时转化的HI为a mol,则有: 2HI(g) H2(g) + I2(g) 开始/mol x 0 0 转化/mol a 平衡/mol x-a 所以=0.784,得a=0.216x,K==。(2)达平衡时,v正=v逆,k正x2(HI)=k逆x(H2)x(I2),k逆==k正/K。v正=k正x2(HI),在40 min时,x(HI)=0.85,所以v正=0.002 7 min-1×0.85×0.85≈1.95×10-3 min-1。(3)升高温度,正逆反应速率都增大,但平衡正向移动,HI的物质的量分数减小,H2的物质的量分数增大,分析题图,反应重新达到平衡时,相应的点分别是A、E。 1.(2016·全国卷丙)煤燃烧排放的烟气含有SO2和NOx,形成酸雨、污染大气,采用NaClO2溶液作为吸收剂可同时对烟气进行脱硫、脱硝。回答下列问题: (1)在鼓泡反应器中通入含有SO2和NO的烟气,反应温度323 K,NaClO2溶液浓度为5×10-3mol·L-1。反应一段时间后溶液中离子浓度的分析结果如下表。 离子 SO SO NO NO Cl- c/(mol·L-1) 8.35×10-4 6.87×10-6 1.5×10-4 1.2×10-5 3.4×10-3 ①写出NaClO2溶液脱硝过程中主要反应的离子方程式:__4NO+3ClO+4OH-===4NO+2H2O+3Cl-__。增加压强,NO的转化率__提高__(填“提高”“不变”或“降低”)。 ②随着吸收反应的进行,吸收剂溶液的pH逐渐__减小__(填“增大”“不变”或“减小”)。 ③由实验结果可知,脱硫反应速率__大于__脱硝反应速率(填“大于”或“小于”)。 原因是除了SO2和NO在烟气中的初始浓度不同,还可能是__NO的溶解度较低或脱硝反应活化能较高__。 (2)在不同温度下,NaClO2溶液脱硫、脱硝的反应中SO2和NO的平衡分压pe如图所示。 ①由图分析可知,反应温度升高,脱硫、脱硝反应的平衡常数均__减小__(填“增大”“不变”或“减小”)。 ②反应ClO+2SO2SO+Cl-的平衡常数K的表达式为 。 (3)如果采用NaClO、Ca(ClO)2替代NaClO2,也能得到较好的烟气脱硫效果。从化学平衡原理分析,Ca(ClO)2相比NaClO具有的优点是__形成CaSO4沉淀,反应平衡向产物方向移动,SO2转化率提高__。 解析 (1)①NaClO2溶液脱硝过程中,NO转化为NO、NO,主要转化为NO,书写离子方程式时运用得失电子守恒、电荷守恒和原子守恒,得到4NO+3ClO+4OH-===4NO+2H2O+3Cl-。上述反应是气体分子数减小的反应,增加压强有利于反应正向进行,使NO的转化率提高。②根据上述反应可知,随着吸收反应的进行,溶液中c(H+)逐渐增大,pH逐渐减小。③由实验结果看出,溶液中含硫离子的浓度大于含氮离子的浓度,所以脱硫反应速率大于脱硝反应速率。这可能是因为NO的溶解度较低、脱硝反应活化能较高等。(2)①纵坐标是平衡分压的负对数,反应温度升高,SO2和NO的平衡分压的负对数减小,即平衡分压增大,说明平衡逆向移动,所以平衡常数减小。②根据平衡常数表达式的规则书写即可。(3)如果使用Ca(ClO)2,则生成的SO会与Ca2+结合,生成CaSO4沉淀,促使脱硫反应正向移动,提高SO2的转化率。 2.(2016·海南卷)顺-1,2-二甲基环丙烷和反-1,2-二甲基环丙烷可发生如图1转化: 该反应的速率方程可表示为:v正=k正·c顺和v逆=k逆·c反,k正和k逆在一定温度时为常数,分别称为正、逆反应速率常数。回答下列问题: (1)已知:t1温度下,k正=0.006 s-1,k逆=0.002 s-1,该温度下反应的平衡常数值K1=__3__;该反应的活化能Ea(正)小于Ea(逆),则ΔH__小于__0(填“小于”“等于”或“大于”)。 (2)t2温度下,图2中能表示顺式异构体的质量分数随时间变化的曲线是__B__(填曲线编号),平衡常数值K2=__7/3__;温度t2__大于__t1(填“小于”“等于”或“大于”),判断理由是__放热反应升高温度时,平衡向逆反应方向移动__。查看更多