- 2021-08-06 发布 |
- 37.5 KB |
- 32页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020届高考化学专题五第16讲物质结构与性质同步练习含解析
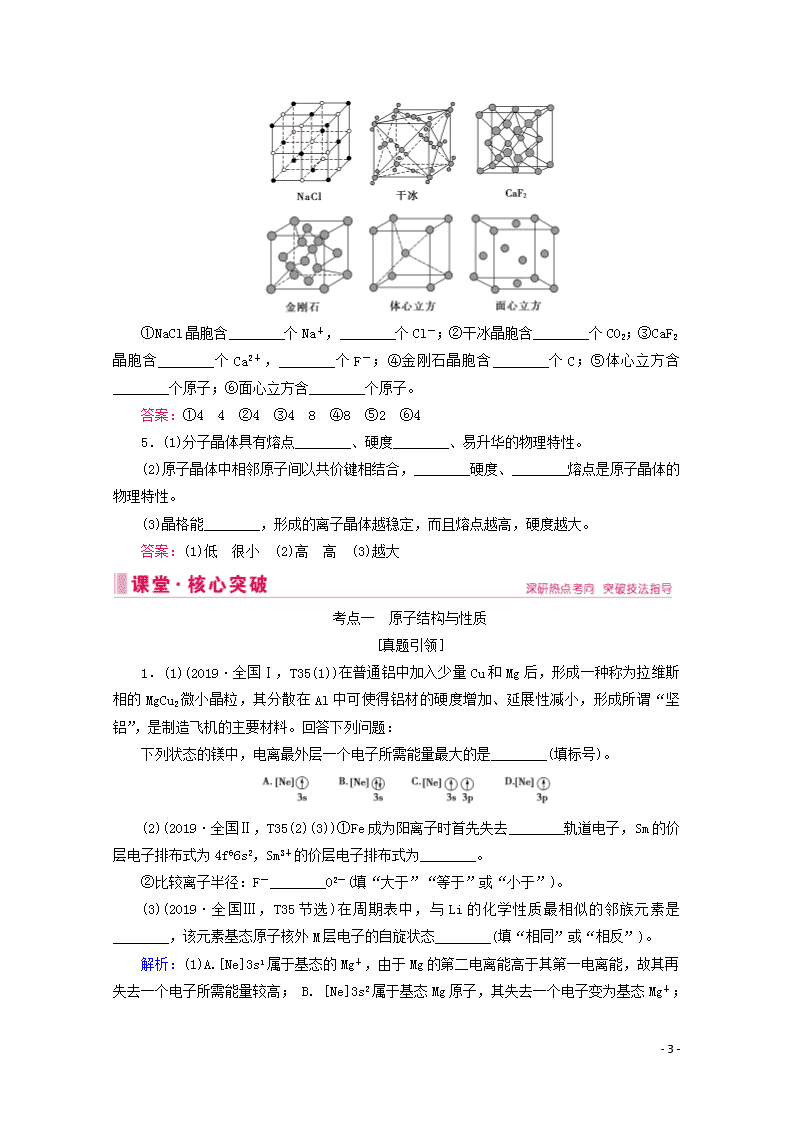
第16讲 物质结构与性质 1.原子结构与元素的性质 (1)了解原子核外电子的运动状态、能级分布和排布原理,能正确书写1~36号元素原子核外电子、价电子的电子排布式和轨道表达式。 (2)了解电离能的含义,并能用以说明元素的某些性质。 (3)了解电子在原子轨道之间的跃迁及其简单应用。 (4)了解电负性的概念,并能用以说明元素的某些性质。 2.化学键与分子结构 (1)理解离子键的形成,能根据离子化合物的结构特征解释其物理性质。 (2)了解共价键的形成、极性、类型(σ键和π键),了解配位键的含义。 (3)能用键能、键长、键角等说明简单分子的某些性质。 (4)了解杂化轨道理论及简单的杂化轨道类型(sp、sp2、sp3)。 (5)能用价层电子对互斥理论或者杂化轨道理论推测简单分子或离子的空间结构。 3.分子间作用力与物质的性质 (1)了解范德华力的含义及对物质性质的影响。 (2)了解氢键的含义,能列举存在氢键的物质,并能解释氢键对物质性质的影响。 4.晶体结构与性质 (1)了解晶体的类型,了解不同类型晶体中结构微粒、微粒间作用力的区别。 (2)了解晶格能的概念,了解晶格能对离子晶体性质的影响。 (3)了解分子晶体结构与性质的关系。 (4)了解原子晶体的特征,能描述金刚石、二氧化硅等原子晶体的结构与性质的关系。 (5)理解金属键的含义,能用金属键理论解释金属的一些物理性质。了解金属晶体常见的堆积方式。 (6)了解晶胞的概念,能根据晶胞确定晶体的组成并进行相关的计算。 (1)原子结构与性质 (2)分子结构与性质 (3)晶体结构与性质 (4)晶胞的相关计算 宏观辨识与微观探析:从宏观和微观相结合的视角认识原子核外电子排布,化学键与分子结构、晶体结构和晶胞的相关计算。 证据推理与模型认知:以元素周期表的结构为载体,论证推理原子结构和其性质的周期性变化;以杂化轨道理论和简单的杂化轨道模型论证推理分子的空间结构与性质。 - 32 - 1.完成下列各题 (1)(2016·全国卷Ⅱ·节选)镍元素基态原子的电子排布式为________________,3d能级上的未成对电子数为________。 (2)(2016·全国卷Ⅲ·节选)写出基态As原子的核外电子排布式________________________________。 (3)Na位于元素周期表第________周期第________族;S的基态原子核外有________个未成对电子;Si的基态原子核外电子排布式为________________________。 答案:(1)1s22s22p63s23p63d84s2(或[Ar]3d84s2) 2 (2)1s22s22p63s23p63d104s24p3(或[Ar]3d104s24p3) (3)3 IA 2 1s22s22p63s23p2(或[Ne]3s23p2) 2.有以下物质:①HF,②Cl2,③H2O,④N2,⑤C2H4。 (1)只含有极性键的是________; (2)只含有非极性键的是________; (3)既有极性键又有非极性键的是________; (4)只含有σ键的是________; (5)既有σ键又有π键的是________。 答案:(1)①③ (2)②④ (3)⑤ (4)①②③ (5)④⑤ 3.写出下列原子的杂化轨道类型及分子的结构式、空间构型。 (1)CO2分子中的C:________杂化,分子的结构式________,空间构型________。 (2)CH2O中的C:________________杂化,分子的结构式________,空间构型________。 (3)CH3Cl分子中的C:________________杂化,分子的结构式________,空间构型________。 答案:(1)sp O=C=O 直线形 4.以下是几种常见的晶胞结构及晶胞中粒子的排列方式: - 32 - ①NaCl晶胞含________个Na+,________个Cl-;②干冰晶胞含________个CO2;③CaF2晶胞含________个Ca2+,________个F-;④金刚石晶胞含________个C;⑤体心立方含________个原子;⑥面心立方含________个原子。 答案:①4 4 ②4 ③4 8 ④8 ⑤2 ⑥4 5.(1)分子晶体具有熔点________、硬度________、易升华的物理特性。 (2)原子晶体中相邻原子间以共价键相结合,________硬度、________熔点是原子晶体的物理特性。 (3)晶格能________,形成的离子晶体越稳定,而且熔点越高,硬度越大。 答案:(1)低 很小 (2)高 高 (3)越大 考点一 原子结构与性质 [真题引领] 1.(1)(2019·全国Ⅰ,T35(1))在普通铝中加入少量Cu和Mg后,形成一种称为拉维斯相的MgCu2微小晶粒,其分散在Al中可使得铝材的硬度增加、延展性减小,形成所谓“坚铝”,是制造飞机的主要材料。回答下列问题: 下列状态的镁中,电离最外层一个电子所需能量最大的是________(填标号)。 (2)(2019·全国Ⅱ,T35(2)(3))①Fe成为阳离子时首先失去________轨道电子,Sm的价层电子排布式为4f66s2,Sm3+的价层电子排布式为________。 ②比较离子半径:F-________O2-(填“大于”“等于”或“小于”)。 (3)(2019·全国Ⅲ,T35节选)在周期表中,与Li的化学性质最相似的邻族元素是________,该元素基态原子核外M层电子的自旋状态________(填“相同”或“相反”)。 解析:(1)A.[Ne]3s1属于基态的Mg+,由于Mg的第二电离能高于其第一电离能,故其再失去一个电子所需能量较高; B. [Ne]3s2属于基态Mg原子,其失去一个电子变为基态Mg+ - 32 - ; C.[Ne]3s13p1属于激发态Mg原子,其失去一个电子所需能量低于基态Mg原子;D.[Ne]3p1属于激发态Mg+,其失去一个电子所需能量低于基态Mg+,综上所述,电离最外层一个电子所需能量最大的是[Ne]3s1。 (2)①Fe为26号元素,Fe原子核外电子排布式为1s22s22p63s23p63d64s2,Fe原子失去1个电子使4s轨道为半充满状态,能量较低,故首先失去4s轨道电子;Sm的价电子排布式为4f66s2,失去3个电子变成Sm3+成为稳定状态,则应先失去能量较高的4s电子,所以Sm3+的价电子排布式为4f5,②F-和O2-的核外电子排布相同,核电荷数越大,则半径越小,故半径:F-查看更多
相关文章
- 当前文档收益归属上传用户