理综化学卷·2019届湖南省衡阳市八中高二(实验班)上学期第一次月考(2017
衡阳八中2017-2018学年上期高二第一次月考试卷
理综化学
9.处理含 CO、SO2 烟道气污染的一种方法,是将其在催化剂作用下转化为单质S。已知:
2CO(g)+O2(g)=2 CO2(g) △H1=-566.0kJ/mol
S(g)+O2(g)=SO2(g) △H2=-296.0kJ/mol
S(s)+O2(g)=SO2(g) △H3=?
下列说法不正确的是
A. △H3<△H2
B. 将少量 CO 2、SO2分别通入澄清石灰水,都能产生浑浊现象
C. CO2分子中各原子最外层均为8电子稳定结构
D. 相同条件下:2CO(g)+SO2(g)=S(g)+2CO2(g) △H=-270kJ/mol
10.己知 25°C,101 kPa 时,2SO2(g)+O2(g) 2SO3(g);△H=-197 kJ·mol-1。向密闭容器中通入2 mol SO2和1 mol O2,达到平衡时,放出热量为Q1,向另一个体积相同的容器中通入1 mol SO2、0.5 mol O2 达到平衡时放出热量为Q2,则下列关系正确的是
A. 2Q2
T(Ⅱ)
B. a、b、c三点对应的气体的平均相对分子质量:a>c>b
C. 平衡时Z的产率:b>c
D. t2-t3时间段内,两种条件下X的平均反应速率相等
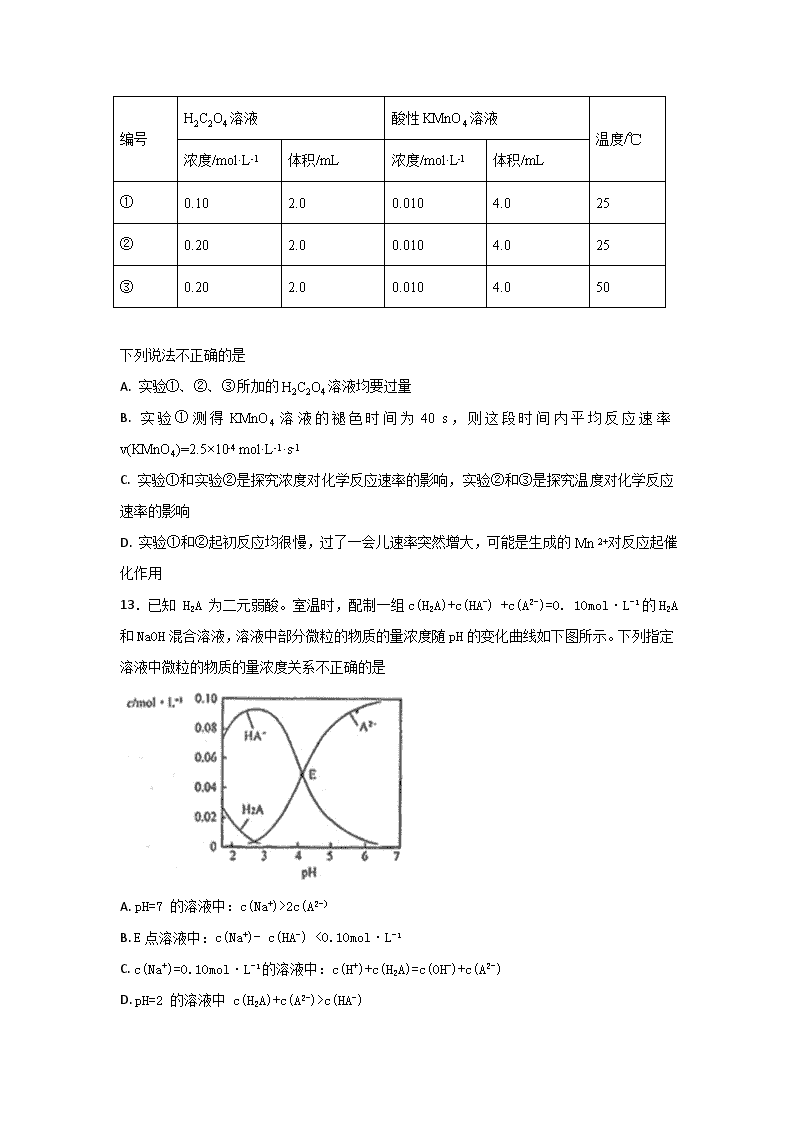
12.以反应5H2C2O4+2MnO4-+6H+=10CO2↑+2Mn2++8H2O为例探究“外界条件对化学反应速率的影响”。实验时,分别量取H2C2O4溶液和酸性KmnO4溶液,迅速混合并开始计时,通过测定溶液褪色所需时间来判断反应的快慢。
编号
H2C2O4溶液
酸性KMnO4溶液
温度/℃
浓度/mol·L-1
体积/mL
浓度/mol·L-l
体积/mL
①
0.10
2.0
0.010
4.0
25
②
0.20
2.0
0.010
4.0
25
③
0.20
2.0
0.010
4.0
50
下列说法不正确的是
A. 实验①、②、③所加的H2C2O4溶液均要过量
B. 实验①测得KMnO4溶液的褪色时间为40 s,则这段时间内平均反应速率v(KMnO4)=2.5×10-4 mol·L-1·s-1
C. 实验①和实验②是探究浓度对化学反应速率的影响,实验②和③是探究温度对化学反应速率的影响
D. 实验①和②起初反应均很慢,过了一会儿速率突然增大,可能是生成的Mn 2+对反应起催化作用
13.已知 H2A 为二元弱酸。室温时,配制一组c(H2A)+c(HA-) +c(A2-)=0. 10mol·L-1的H2A和NaOH混合溶液,溶液中部分微粒的物质的量浓度随pH的变化曲线如下图所示。下列指定溶液中微粒的物质的量浓度关系不正确的是
A. pH=7 的溶液中:c(Na+)>2c(A2-)
B. E点溶液中:c(Na+)- c(HA-) <0.10mol·L-1
C. c(Na+)=0.10mol·L-1的溶液中:c(H+)+c(H2A)=c(OH-)+c(A2-)
D. pH=2 的溶液中 c(H2A)+c(A2-)>c(HA-)
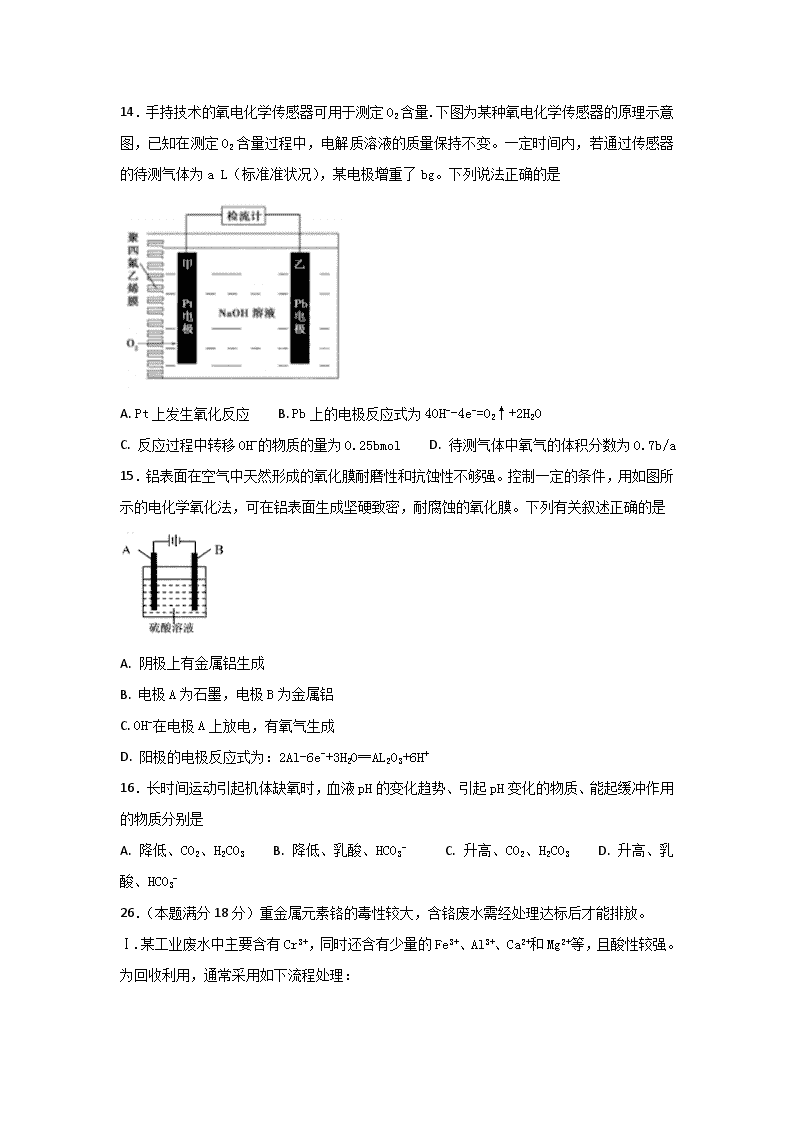
14.手持技术的氧电化学传感器可用于测定O2含量.下图为某种氧电化学传感器的原理示意图,已知在测定O2含量过程中,电解质溶液的质量保持不变。一定时间内,若通过传感器的待测气体为a L(标准准状况),某电极增重了bg。下列说法正确的是
A. Pt上发生氧化反应 B. Pb上的电极反应式为4OH--4e-=O2↑+2H2O
C. 反应过程中转移OH-的物质的量为0.25bmol D. 待测气体中氧气的体积分数为0.7b/a
15.铝表面在空气中天然形成的氧化膜耐磨性和抗蚀性不够强。控制一定的条件,用如图所示的电化学氧化法,可在铝表面生成坚硬致密,耐腐蚀的氧化膜。下列有关叙述正确的是
A. 阴极上有金属铝生成
B. 电极A为石墨,电极B为金属铝
C. OH-在电极A上放电,有氧气生成
D. 阳极的电极反应式为:2Al-6e-+3H2O═AL2O3+6H+
16.长时间运动引起机体缺氧时,血液pH的变化趋势、引起pH变化的物质、能起缓冲作用的物质分别是
A. 降低、CO2、H2CO3 B. 降低、乳酸、HCO3- C. 升高、CO2、H2CO3 D. 升高、乳酸、HCO3-
26.(本题满分18分)重金属元素铬的毒性较大,含铬废水需经处理达标后才能排放。
Ⅰ.某工业废水中主要含有Cr3+,同时还含有少量的Fe3+、Al3+、Ca2+和Mg2+等,且酸性较强。为回收利用,通常采用如下流程处理:
注:部分阳离子常温下以氢氧化物形式完全沉淀时溶液的pH见下表
氢氧化物
Fe(OH)3
Fe(OH)2
Mg(OH)2
Al(OH)3
Cr(OH)3
pH
3.7
9.6
ll.l
8
9(>9溶解)
(1)氧化过程中可代替H2O2加入的试剂是________(填序号)。
A.HNO3 B.Na2O2 C.FeCl3 D.KMnO4
(2)加入NaOH溶液调整溶液pH=8时,除去的离子是________(填ABCD序号);已知钠离子交换树脂的原理:Mn++nNaR→MRn+nNa+,此步操作被交换除去的杂质离子是__________(填ABCD序号)。
A.Fe3+ B.Ca2+ C.Al3+ D.Mg2+
Ⅱ.酸性条件下,六价铬主要以Cr2O72-形式存在,工业上常用电解法处理含Cr2O72-的废水。实验室利用如图装置模拟处理含Cr2O72-的废水,阳极反应是Fe-2e-==Fe2+,阴极反应式是2H++2e-==H2↑。
(3)电解时能否用Cu电极来代替阳极上的Fe电极?________(填“能”或“不能”),理由是______________。
(4)电解时阳极附近溶液中Cr2O72-转化为Cr3+的离子方程式为______________。
27.(本题满分18分)锰酸锂(LiMn2O4)可作为锂离子电池的正极材料。工业上利用软锰矿浆吸收含硫烟气(SO2 和O2)制备锰酸锂,生产流程如下:
已知:①软锰矿主要成分为MnO2,含少量Fe2O3、FeO、Al2O3、SiO2等杂质。
②软锰矿浆在吸收含硫烟气的过程中酸性逐渐增强。
③部分氢氧化物沉淀相关的溶液pH如下表:
(1)已知:
下列措施可提高SO2吸收率的是__________(填序号)
a.降低通入含硫烟气的温度 b.升高通入含硫烟气的温度
c.减少软锰矿浆的进入量 d.减小通入含硫烟气的流速
(2)加入试剂X能提高产品纯度,则X可以是_____________(填化学式)
(3)加氨水调溶液pH在5~6之间,目的是_______________。
(4)锰酸锂可充电电池的总反应式为:Li1-xMnO2+LixC LiMn2O4+C(x<1)
①放电时,电池的正极反应式为__________________
②充电时,若转移1mole-,则石墨电极将增重__________g。
28.(本题满分22分)二甲醚又称甲醚,简称 DME,熔点-141.5℃,沸点-24.9℃,与石油液化气(LPG)相似,被誉为“21世纪的清洁燃料”。 由合成气(CO、H2)制备二甲醚的反应原理如下:
①CO(g)+2H2(g) CH3OH(g) △H1=-90.0kJ·mo l -1
②2 CH3OH(g) CH3OCH3(g)+H2O(g) △H2=-20.0kJ·mo l -1
回答下列问题:
(1)已知:H2O(1) =H2O(g) △H= +44.0kJ/mol,若由合成气(CO、H2) 制备 1molCH3OCH3(g),且生成 H2O(1),其热化学方程式为_______________。
(2)有人模拟该制备原理:500K时,在2L的密闭容器中充入2mol CO和6molH2,5min达到平衡,平衡时测得c(H2)=1.8mo l·L-1, c(CH3OCH3)=0.2mo l·L-1,此时 CO的转化率为__________。用 CH3OH 表示反应①的速率是_____________mo l·L-1·m i n -1,可逆反应②的平衡常数 K2=______________________。
(3)在体积一定的密闭容器中发生反应②,如果该反应的平衡常数 K2 值变小,下列说法正确的是____。
A. 平衡向正反应方向移动 B. 平衡移动的原因是升高了温度
C. 达到新平衡后体系的压强不变 D. 容器中 CH3OCH3 的体积分数减小
(4)一定条件下在恒温恒容的密闭容器中,按不同投料比充入 CO(g)和 H2(g)进行反应①,平衡时 CO(g)和 H2(g)的转化率如图8所示,则a=________ (填数值)。
(5)绿色电源“二甲醚燃料电池”的结构如图 9 所示,电解质为 熔 融 态 的 碳 酸 盐 (如 熔 融K2CO3),其中 CO2 会参与电极反应。 工作时正极的电极反应为______________ 。
9
10
A
A
11
12
13
14
15
16
B
B
D
D
D
B
26. B AC BD 不能 因阳极产生的Cu2+不能使Cr2O72-还原到低价态
Cr2O72-+6Fe2++14H+==2Cr3++6Fe3++7H2O
27.a、d H2O2(或O3) 除去铁元素和铝元素[或形成Fe(OH)3和Al(OH)3沉淀而除去]
Li1-xMn2O4+ xLi++ xe-==LiMn2O47
28.2CO(g)+4H2(g) CH3OCH3(g)+H2O(l ) △H2=-244.0kJ·mo l -1 60% 0.12 1 BD
2 2CO2+O2+4e- =2CO32-