- 2021-08-06 发布 |
- 37.5 KB |
- 7页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2017-2018学年吉林省榆树一中高二上学期期中考试化学试题
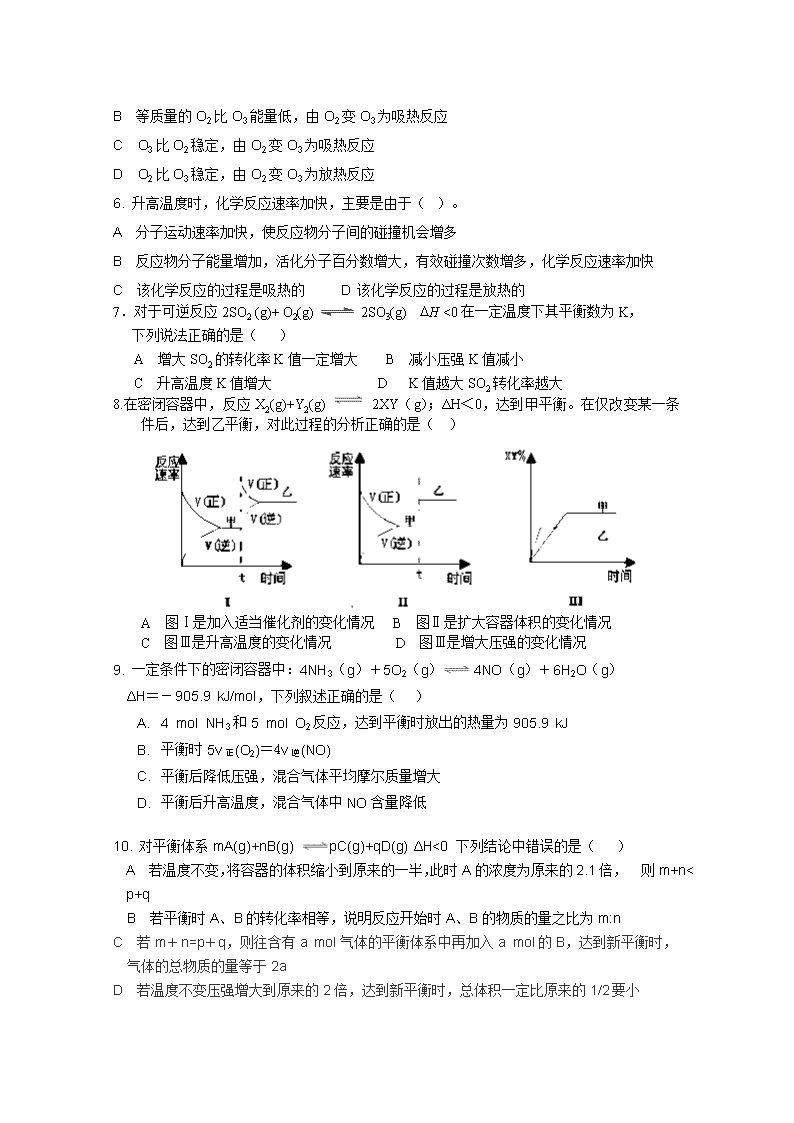
2017-2018学年吉林省榆树一中高二上学期期中考试 化学试题(卷) 本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分,共100分,考试用时90分钟。可能用到的相对原子质量:H—1,O—16,C—12 N--14 第I卷(选择题 共54分) 一、选择题(本大题共18小题,每小题3分,共54分,在每小题给出的四个选项中,只有一选项符合题目要求。) 1.下列说法正确的是( ) A 乙醇和汽油都是可再生能源,应大力推广“乙醇汽油” B 废弃的塑料、金属、纸制品及玻璃都是可回收再利用的资源 C 燃煤时通入空气越多,燃烧越充分,热效率越高 D 凡含有食品添加剂的食物对人体健康均有害,不宜食用 2. 下列与化学反应能量变化相关的叙述正确的是( )。 A 生成物总能量一定低于反应物总能量 B 放热反应的反应速率总是大于吸热反应的反应速率 C 应用盖斯定律,可计算某些难以直接测量的反应焓变 D 同温同压下,H2+Cl2=2HCl在光照和点燃条件下的ΔH不同 3.下列说法或表示方法正确的是( ) A 强酸跟强碱反应放出的热量就是中和热 B 由石墨比金刚石稳定可知: C(金刚石, s) = C(石墨, s) ΔH﹤0 C 反应物的总能量低于生成物的总能量时,该反应一定不能发生 D 在101KPa、25℃时,1gH2完全燃烧生成气态水,放出120.9kJ热量,则氢气的燃烧热为241.8 kJ/mol 4. 热化学方程式C(s)+H 2O(g)= CO(g)+H 2(g) △H =+131.3kJ/mol表示 A 碳和水反应吸收131.3kJ能量 B 1mol碳和1mol水反应生成一氧化碳和氢气并吸收131.3kJ热量 C 1个固态碳原子和1分子水蒸气反应吸热131.1kJ D 1mol固态碳和1mol水蒸气反应生成一氧化碳气体和氢气,并吸热131.3kJ 5. 已知25℃、101KPa条件下: 由此得出的结论正确的是( )。 A 等质量的O2比O3能量低,由O2变O3为放热反应 B 等质量的O2比O3能量低,由O2变O3为吸热反应 C O3比O2稳定,由O2变O3为吸热反应 D O2比O3稳定,由O2变O3为放热反应 6. 升高温度时,化学反应速率加快,主要是由于( )。 A 分子运动速率加快,使反应物分子间的碰撞机会增多 B 反应物分子能量增加,活化分子百分数增大,有效碰撞次数增多,化学反应速率加快 C 该化学反应的过程是吸热的 D 该化学反应的过程是放热的 7.对于可逆反应2SO2 (g)+ O2(g) 2SO3(g) DH <0在一定温度下其平衡数为K, 下列说法正确的是( ) A 增大SO2的转化率K值一定增大 B 减小压强K值减小 C 升高温度K值增大 D K值越大SO2转化率越大 8.在密闭容器中,反应X2(g)+Y2(g) 2XY(g);ΔH<0,达到甲平衡。在仅改变某一条件后,达到乙平衡,对此过程的分析正确的是( ) A 图Ⅰ是加入适当催化剂的变化情况 B 图Ⅱ是扩大容器体积的变化情况 C 图Ⅲ是升高温度的变化情况 D 图Ⅲ是增大压强的变化情况 9. 一定条件下的密闭容器中:4NH3(g)+5O2(g) 4NO(g)+6H2O(g) ΔH=-905.9 kJ/mol,下列叙述正确的是( ) A. 4 mol NH3和5 mol O2反应,达到平衡时放出的热量为905.9 kJ B. 平衡时5v正(O2)=4v逆(NO) C. 平衡后降低压强,混合气体平均摩尔质量增大 D. 平衡后升高温度,混合气体中NO含量降低 10. 对平衡体系mA(g)+nB(g) pC(g)+qD(g) ΔH<0 下列结论中错误的是( ) A 若温度不变,将容器的体积缩小到原来的一半,此时A的浓度为原来的2.1倍, 则m+n查看更多