- 2021-08-06 发布 |
- 37.5 KB |
- 9页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2018-2019学年吉林省“五地六校”合作体高二上学期期末考试化学试题 Word版
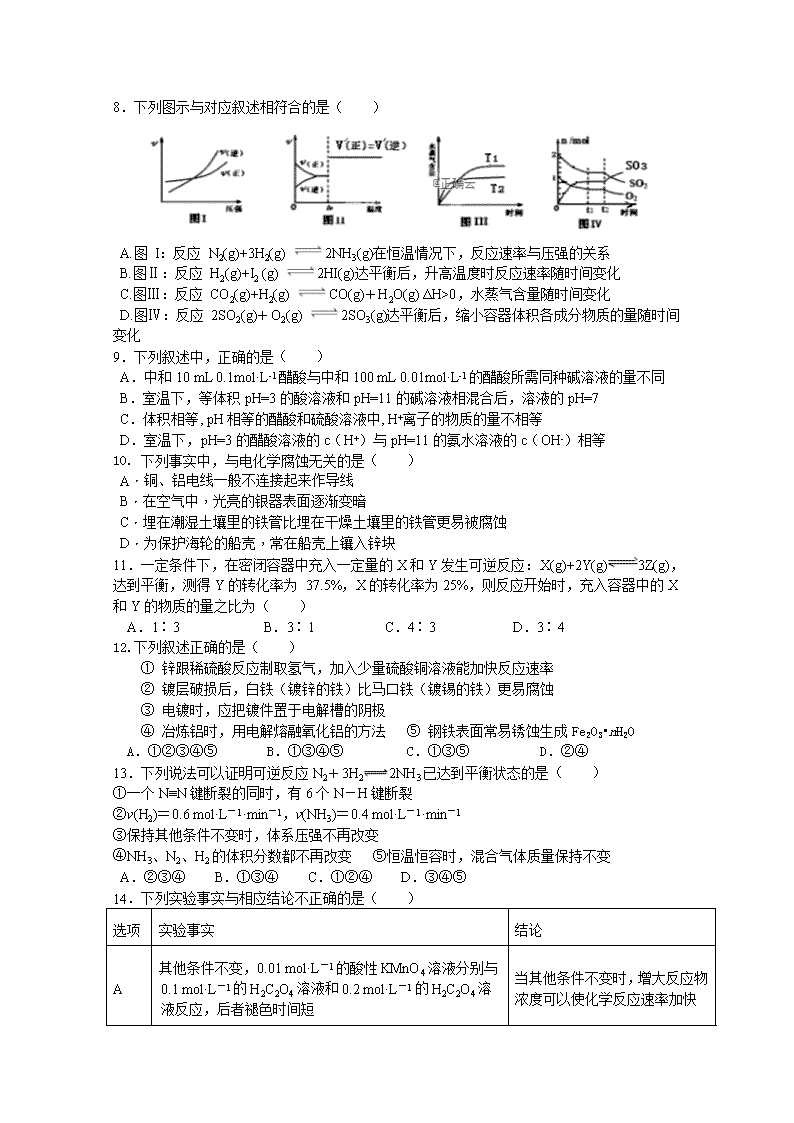
高二化学试题 本试卷分选择题和表达题两部分,共29题,共4页,满分100分。考试时间为90分钟。考试结束后,只交答题卡。 可能用到的相对原子质量:H-1 O-16 C-12 Si-28 N-14 Na-23 Ti-48 第Ⅰ卷 (选择题,共计50分) 一、选择题(每题2分,共50分,每小题只有一个选项符合题意) 1.反应A+B→C(△H<0)分两步进行:①A+B→X(△H>0),②X→C(△H<0).下列示意图中,能正确表示总反应过程中能量变化的是( ) A. B. C. D. 2.下列说法不正确的是( ) A.催化剂能够改变化学反应路径 B.升高温度提高了活化分子百分数 C.增大反应物浓度提高了活化分子百分数 D.增大压强能增大活化分子的浓度 3. 为证明某可溶性一元酸(HX)是弱酸,有如下实验方案,其中不合理的是( ) A. 室温下,测0.1 mol/L HX溶液的pH,若pH>1,证明HX是弱酸 B. 相同条件下,对0.1 mol/L的HCl和0.1 mol/L的HX进行导电性实验,若与HX溶液相串联的灯泡较暗,证明HX为弱酸 C. 将等浓度、等体积的HCl和NaX溶液混合,若混合溶液pH<7,证明HX是弱酸 D. 室温下,测1 mol/L NaX溶液的pH,若pH>7,证明HX是弱酸 4. 下列说法正确的是( ) A. ΔH<0、ΔS>0的反应在温度低时不能自发进行 B. NH4HCO3(s)═NH3(g)+H2O(g)+CO2(g) △H = +185.57kJ/mol能自发进行,原因是体系有自发地向混乱度增大的方向转变的倾向 C.因为焓变和熵变都与反应的自发性有关,因此焓变或熵变均可单独作为反应自发性的判据 D. 化学反应的限度不可以通过改变条件而改变 5.下列变化不能用勒夏特列原理解释的是( ) A.向H2S水溶液中加入NaOH有利于S2-增多 B.H2、I2、HI 混合气体加压后颜色变深 C.合成氨时将氨液化分离,可提高原料的利用率 D.新制氯水久置后颜色变浅 6.下列有关问题与盐的水解相关的是( ) ①NH4Cl与ZnCl2溶液可作焊接金属中的除锈剂 ②明矾可做净水剂 ③草木灰与铵态氮肥不能混合施用 ④实验室盛放碳酸钠溶液的试剂瓶不能用磨口玻璃塞 ⑤加热蒸干AlCl3溶液并灼烧得到Al2O3固体 A.①②③ B.②③④ C.①④⑤ D.①②③④⑤ 7.对于任何一个平衡体系,采用以下措施,一定会使平衡移动的是( ) A.升高温度 B.加入一种反应物 C.增大压强 D.使用催化剂 8.下列图示与对应叙述相符合的是( ) A.图 I:反应 N2(g)+3H2(g) 2NH3(g)在恒温情况下,反应速率与压强的关系 B.图Ⅱ:反应 H2(g)+I2 (g) 2HI(g)达平衡后,升高温度时反应速率随时间变化 C.图Ⅲ:反应 CO2(g)+H2(g) CO(g)+H2O(g) ΔH>0,水蒸气含量随时间变化 D.图Ⅳ:反应 2SO2(g)+O2(g) 2SO3(g)达平衡后,缩小容器体积各成分物质的量随时间变化 9.下列叙述中,正确的是( ) A.中和10 mL 0.1mol·L-1醋酸与中和100 mL 0.01mol·L-1的醋酸所需同种碱溶液的量不同 B.室温下,等体积pH=3的酸溶液和pH=11的碱溶液相混合后,溶液的pH=7 C.体积相等, pH相等的醋酸和硫酸溶液中, H+离子的物质的量不相等 D.室温下,pH=3的醋酸溶液的c(H+)与pH=11的氨水溶液的c(OH-)相等 10. 下列事实中,与电化学腐蚀无关的是( ) A.铜、铝电线一般不连接起来作导线 B.在空气中,光亮的银器表面逐渐变暗 C.埋在潮湿土壤里的铁管比埋在干燥土壤里的铁管更易被腐蚀 D.为保护海轮的船壳,常在船壳上镶入锌块 11.一定条件下,在密闭容器中充入一定量的X和Y发生可逆反应:X(g)+2Y(g)3Z(g),达到平衡,测得Y的转化率为 37.5%,X的转化率为25%,则反应开始时,充入容器中的X和Y的物质的量之比为( ) A.1∶3 B.3∶1 C.4∶3 D.3∶4 12.下列叙述正确的是( ) ① 锌跟稀硫酸反应制取氢气,加入少量硫酸铜溶液能加快反应速率 ② 镀层破损后,白铁(镀锌的铁)比马口铁(镀锡的铁)更易腐蚀 ③ 电镀时,应把镀件置于电解槽的阴极 ④ 冶炼铝时,用电解熔融氧化铝的方法 ⑤ 钢铁表面常易锈蚀生成Fe2O3•nH2O A.①②③④⑤ B.①③④⑤ C.①③⑤ D.②④ 13.下列说法可以证明可逆反应N2+3H22NH3已达到平衡状态的是( ) ①一个N≡N键断裂的同时,有6个N-H键断裂 ②v(H2)=0.6 mol·L-1·min-1,v(NH3)=0.4 mol·L-1·min-1 ③保持其他条件不变时,体系压强不再改变 ④NH3、N2、H2的体积分数都不再改变 ⑤恒温恒容时,混合气体质量保持不变 A.②③④ B.①③④ C.①②④ D.③④⑤ 14.下列实验事实与相应结论不正确的是( ) 选项 实验事实 结论 A 其他条件不变,0.01 mol·L-1的酸性KMnO4溶液分别与0.1 mol·L-1的H2C2O4溶液和0.2 mol·L-1的H2C2O4溶液反应,后者褪色时间短 当其他条件不变时,增大反应物浓度可以使化学反应速率加快 B 其他条件不变,分别将等体积、等物质的量浓度的Na2S2O3溶液和H2SO4混合液放在冷水和热水中,放在热水中的混合液先出现浑浊 当其他条件不变时,反应体系的温度越高,化学反应速率越快 C 将少量MnO2粉末加入盛有10%双氧水的锥形瓶内,在化学反应前后,MnO2的质量和化学性质都没有发生改变 催化剂虽然可以加快化学反应的速率,但一定不参与化学反应过程 D 一定条件下,分别在容积为1 L和容积为2 L的两个密闭容器中加入等量的氢气和碘蒸气,发生如下反应:H2(g)+I2(g)2HI(g),获得等量HI时需要的时间前者少 当其他条件不变时,气态反应体系的压强越大,化学反应速率越快 15. 铁镍蓄电池又称爱迪生电池,放电时的总反应为: Fe+Ni2O3+3H2OFe(OH)2+2Ni(OH)2,下列有关该电池的说法不正确的是( ) A.电池的电解液为碱性溶液,正极为Ni2O3、负极为Fe B.电池充电过程中,阴极附近溶液的酸性增强 C.电池放电时,负极反应为Fe+2OH--2e-=Fe(OH)2 D.电池充电时,阳极反应为2Ni(OH)2+2OH--2e-=Ni2O3+3H2O 16.下列有关滴定操作的顺序正确的是( ) ①检查滴定管是否漏水 ②用蒸馏水洗涤玻璃仪器 ③用标准溶液润洗盛标准溶液的滴定管,用待测液润洗盛待测液的滴定管 ④装标准溶液和待测液并调整液面(记录初读数)⑤取一定体积的待测液于锥形瓶中并滴加适量指示剂 ⑥滴定 A.①③②④⑤⑥ B.①②③④⑤⑥ C.②③①④⑤⑥ D.④⑤①②③⑥ 17.关于中和热的测定实验,下列说法正确的是( ) A. 为了使反应进行的更完全,可以使酸或碱适当过量 B. 为了使反应充分,可以向酸(碱)中分次加入碱(酸) C. 中和热为一定值,实验结果与所用酸(碱)的用量和种类均无关 D. 用铜丝代替玻璃棒搅拌,会使中和热测定值偏大 18.某温度时,Ag2SO4在水中的沉淀溶解平衡曲线如图所示.该温度下,下列说法正确的是( ) A.含有大量SO42-的溶液中肯定不存在Ag+ B.0.02mol/L的AgNO3溶液与0.2mol/L的Na2SO4溶液等体积混合不会生成沉淀 C.Ag2SO4的溶度积常数(Ksp)为1×10-3 D.a点表示Ag2SO4的不饱和溶液,蒸发可以使溶液由a点变到b点 18题图 19题图 19.电解质溶液的电导率越大,导电能力越强。用0.100mol·L-1的NaOH溶液分别滴定10.00mL 浓度均为0.100mol·L-1的盐酸和CH3COOH溶液。利用传感器测得滴定过程中溶液电导率如图所示。下列说法不正确的是( ) A.曲线①代表滴定CH3COOH溶液的曲线 B.在相同温度下,A、B、C 三点溶液中水电离的 c(H+):B<A=C C.D点溶液中:c(Cl-)=2c(OH-)-2c(H+) D.A点溶液中: c(CH3COO-)+c(OH-)-c(H+) = 0.05mol·L-1 20.下列热化学方程式正确的是( ) A.甲烷的燃烧热为890.3 kJ·mol-1,则甲烷燃烧的热化学方程式可表示为 CH4(g)+2O2(g)===CO2(g)+2H2O(g) ΔH=-890.3 kJ·mol-1 B.500 ℃、30 MPa下,将0.5 mol N2和1.5 mol H2置于密闭容器中充分反应生成NH3(g), 放热19.3 kJ,其热化学方程式为 N2(g)+3H2(g) 2NH3(g) ΔH=-38.6 kJ·mol-1 C.已知在101 kPa下,1 g H2燃烧生成水蒸气放出121 kJ热量,其热化学方程式为 H2(g)+O2(g)===H2O(g) ΔH=-242 kJ·mol-1 D.25 ℃,101 kPa时,强酸与强碱的稀溶液发生中和反应的中和热为57.3 kJ·mol-1, 表示硫酸溶液与氢氧化钾溶液反应的中和热的热化学方程式为 H2SO4(aq)+2KOH(aq)===K2SO4(aq)+2H2O(l) ΔH=-114.6 kJ·mol-1 21根据表中的信息判断下列说法正确的是( ) A. 表示石墨燃烧热的热化学方程式C(石墨,s)+O2(g)===CO(g)ΔH=﹣393.5 kJ·mol-1 B. 由表中信息知C(石墨,s)===C(金刚石,s)ΔH=+1.9 kJ·mol-1 C. 由表中信息可得如图所示的图像 D. 由表中信息可推知相同条件下金刚石的熔点高于石墨的 22. 利用如图装置进行实验,甲、乙两池均为1 mol·L-1 的AgNO3 溶液,A、B 均为Ag 电极。实验开始先闭合K1,断开K2。一段时间后,断开K1,闭合K2,形成浓差电池,灵敏电流计指针发生偏转(提示:Ag+浓度越大,氧化性越强),下列说法不正确的是( ) A. 闭合K1,断开K2 后,A 电极增重 B. 闭合K1,断开K2 后,乙池中c(Ag+)增大 C. 断开K1,闭合K2 后,NO3‒向A 电极移动 D. 断开K1,闭合K2 后,B 电极发生氧化反应 22题图 23题图 23.工业废气H2S经资源化利用后可回收能量并得到单质硫。反应原理为:2H2S(g)+O2(g)=S2(s) +2H2O(l) △H=-632kJ·mol-1。H2S燃料电池的工作原理如图所示。下列说法不正确的是( ) A.电极a为电池的负极 B.电极b上发生的电极反应为O2+4H++4e-=2H2O C.若电路中通过2mol电子,则电池内部释放632kJ热能 D.若有17gH2S参与反应,则会有1molH+经质子膜进入正极区 24.如图所示,反应:X(g)+3Y(g) 2Z(g)△H>0,在不同温度、不同压强 (P1>P2)下,达到平衡时,混合气体中Z的百分含量随温度变化的曲线应为( ) 25. 室温下,向下列溶液中通入相应的气体至溶液pH=7(通入气体对溶液体积的影响可忽略),溶液中部分微粒的物质的量浓度关系正确的是( ) A.向0.10 mol·L-1 NH4HCO3溶液中通CO2:c(NH)=c(HCO)+c(CO) B.向0.10 mol·L-1 NaHSO3溶液中通NH3:c(Na+)>c(NH)>c(SO) C.向0.10 mol·L-1 Na2SO3溶液中通SO2:c(Na+)=2[c(SO)+c(HSO)+c(H2SO3)] D.向0.10 mol·L-1 CH3COONa溶液中通HCl:c(Na+)>c(CH3COOH)=c(Cl-) 第Ⅱ卷 (表达题,共计50分) 26、(11分)I.依据氧化还原反应Zn(s)+Cu2+(aq)===Zn2+(aq)+Cu(s)设计的原电池如图1所示。 图1 图2 图3 请回答下列问题: (1) 铜电极为电池的________极;电解质溶液Y是________________。 (2) 盐桥中的Cl-向________(填“左”、或“右”)移动,如将盐桥撤掉,电流计的指针将不偏转。 Ⅱ.电解原理在化学工业中有广泛应用。 如图2表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。请完成以下问题: (1)若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液: ①在X极附近观察到的现象是_________________; ②电解一段时间后,该反应总离子方程式_______________________________; (2)若用该装置电解精炼铜,电解液a选用CuSO4溶液,则:X电极的材料是____________电解一段时间后,CuSO4溶液浓度_________(填“增大”、减小”或“不变”)。 (3)若X、Y都是惰性电极,a是溶质为Cu(NO3)2和X(NO3)3,且均为0.1 mol的混合溶液,通电一段时间后,阴极析出固体质量m(g)与通过电子的物质的量n(mol)关系如图3所示,则 Cu2+、X3+、H+氧化能力由大到小的顺序是 。 27、(13分)现用氯化铜晶体(CuCl 2·2H 2O,含氯化亚铁杂质)制取纯净CuCl 2·2H 2O。先将其制成水溶液,后按如图步骤进行提纯: 已知Cu 2+、Fe 3+和Fe 2+的氢氧化物开始沉淀和沉淀完全时的pH见下表 金属离子 Fe3+ Fe2+ Cu2+ 氢氧化物开始沉淀时的pH 1.9 7.0 4.7 氢氧化物沉淀完全时的pH 3.2 9.0 6.7 请回答下列问题: (1)最适合作氧化剂X的是____。离子方程式为____________________________________ A.K2Cr2O7 B.NaClO C.H2O2 D.KMnO4 (2)溶液II中除Cu 2+外,还有金属阳离子______,检验试剂为______________。物质Y 不能为下列的________________________。 a.CuO b.Cu(OH) 2 c.CuCO 3 d.Cu 2(OH) 2CO 3 e.CaO f.NaOH (3)加入的Y调节的pH范围是_________________ (4)常温下,计算 Fe(OH)3的溶度积Ksp=________(通常认为残留在溶液中的离子浓度小于1×10-5 mol/L 时则沉淀完全。) (5)若在空气中加热固体CuCl 2·2H 2O,可水解生成Cu(OH)Cl,写出相关的化学方程式_______________________________________。 欲将CuCl2·2H2O加热制得无水CuCl2,必要的操作是: 。 28.(12分)甲醇是重要的化学工业基础原料和液体燃料。工业上可利用CO或CO2来生产燃料甲醇。已知甲醇制备的有关化学反应以及在不同温度下的化学反应平衡常数如下表所示: 化学反应 平衡常数 温度(℃) 500 800 ①2H2(g)+CO(g)CH3OH(g) K1 2.5 0.15 ②H2(g)+CO2(g)H2O(g)+CO(g) K2 1.0 2.50 ③3H2(g)+CO2(g)CH3OH(g)+H2O(g) K3 (1)某温度下反应①中H2的平衡转化率(a)与体系总压强(P)的关系如图所示。则平衡状态由A变到B时,平衡常数K(A) ____K(B)(填“>”、“<”或“=”)。 (2)反应②是____(填“吸热”或“放热”)反应。 (3)判断反应③△H____0;△S____0(填“>”“=”或“<”) 在500℃、2L的密闭容器中,进行反应③,测得某时刻H2、CO2、 CH3OH、H2O的物质的量分别为6mol、2 mol、10 mol、10 mol,此时v(正) ____v(逆)(填“>”“=”或“<”) (4)一定温度下,在3 L容积可变的密闭容器中发生反应②,已知c(CO)与反应时间t变化曲线Ⅰ如图所示,若在t0时刻分别改变一个条件,曲线Ⅰ变为曲线Ⅱ和曲线Ⅲ。 当曲线Ⅰ变为曲线Ⅱ时,改变的条件是________________。 当曲线Ⅰ变为曲线Ⅲ时,改变的条件是________________。 29.(14分)已知25 ℃时部分弱电解质的电离平衡常数数据如下表: 弱酸化学式 HSCN CH3COOH HCN H2CO3 电离平衡常数 1.3×10-1 1.7×10-5 6.2×10-10 K1=4.3×10-7 K2=5.6×10-11 (1)等物质的量浓度的 a.CH3COONa、b.NaCN、c. NaHCO3溶液的pH由大到小的顺序为____________(填字母)。 (2) 常温下, 0.1 mol·L-1的CH3COOH 溶液加水稀释,下列表达式的数据变大的是______。 A.C(H+) B.C(H+)/C(CH3COOH) C.C(H+)/C(OH-) D. C(OH-) /C(CH3COO-) (3)25 ℃时,将 20 mL 0.1 mol·L-1 CH3COOH 溶液和 20mL0.1 mol·L-1HSCN溶液分别与20mL 0.1 mol·L-1NaHCO3溶液混合,实验测得产生的气体体积(V)随时间(t)的变化如右图所示:反应初始阶段两种溶液产生CO2气体的速率存在明显差异的原因是______________________; 反应结束后所得两溶液中,(CH3COO-)________c(SCN-)(填“>”、 “<”或“=”) (4)25 ℃时,在 CH3COOH 与 CH3COONa 的混合溶液中,若测得 pH=6,则溶液中c(CH3COO-)-c(Na+)=______mol·L-1(填精确值), c(CH3COO-)/c(CH3COOH)=_____。 (5)用标准的NaOH溶液滴定未知浓度的醋酸,选用酚酞为指示剂,下列能造成测定结果偏高的是 。 A.未用标准液润洗碱式滴定管 B.滴定终点读数时,俯视滴定管的刻度 C.盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗 D.滴定达终点时,发现滴定管尖嘴处悬挂一滴溶液 高二化学试题答案 1—5 DCCBB 6—10 DADDB 11—15 DBBCB 16—20 BABBC 21—25 BDCBD 26、(11分) I.(1) 正(1分) CuCl2或CuSO4(其他合理答案)(1分) (2) 左(1分) Ⅱ.(1)①放出气体,溶液变红 (2分答案不全扣1分) ② 2Cl-+2H2O2OH-+Cl2↑+H2↑ (2分) (2)纯铜 (1分) 减小(1分) (3)Cu2+>H+>X3+ (2分) 27 、(13分) (1)C (1分) 2Fe2++H2O2+2H+= 2Fe3++2H2O (2分) (2)Fe3+ (1分) KSCN (1分) ef (1分漏选不给分) (3)[ 3.2, 4.7 ) (1分 答对数字即可) (4)10-37.4 (mol·L-1)4 (2分 单位不扣分) (5)CuCl2·2H2OCu(OH)Cl+HCl+H2O (2分) 在HCl氛围下加热(2分) 28、(12分) (1)= (1分) (2)吸热(1分) (3)<(2分) <(2分) >(2分) (4)加入催化剂(2分);将容器的体积压缩至2L(2分,只写出加压或缩小容器体积得1分) 29、(14分每空2分) (1)bca (2)BD(答案不全扣1分) (3)同浓度的HSCN比醋酸酸性强,其溶液中氢离子浓度大,反应较快; < 。 (4)9.9×10-7 ; 17。 (5)AD(答案不全扣1分)查看更多