江苏省2020高考化学二轮复习专题题型十二电解质溶液中的粒子关系训练含解析
题型十二 电解质溶液中的粒子关系
(建议用时:25分钟)
一、单项选择题
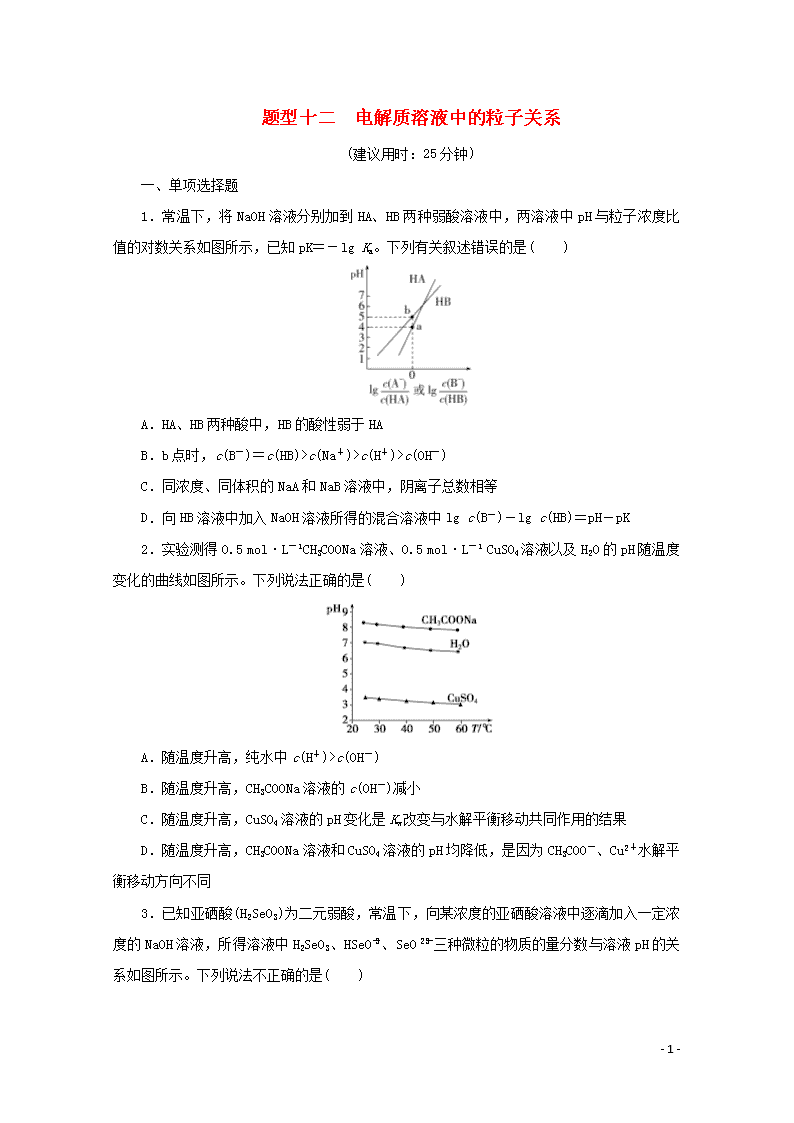
1.常温下,将NaOH溶液分别加到HA、HB两种弱酸溶液中,两溶液中pH与粒子浓度比值的对数关系如图所示,已知pK=-lg Ka。下列有关叙述错误的是( )
A.HA、HB两种酸中,HB的酸性弱于HA
B.b点时,c(B-)=c(HB)>c(Na+)>c(H+)>c(OH-)
C.同浓度、同体积的NaA和NaB溶液中,阴离子总数相等
D.向HB溶液中加入NaOH溶液所得的混合溶液中lg c(B-)-lg c(HB)=pH-pK
2.实验测得0.5 mol·L-1CH3COONa溶液、0.5 mol·L-1 CuSO4溶液以及H2O的pH随温度变化的曲线如图所示。下列说法正确的是( )
A.随温度升高,纯水中c(H+)>c(OH-)
B.随温度升高,CH3COONa溶液的c(OH-)减小
C.随温度升高,CuSO4溶液的pH变化是Kw改变与水解平衡移动共同作用的结果
D.随温度升高,CH3COONa溶液和CuSO4溶液的pH均降低,是因为CH3COO-、Cu2+水解平衡移动方向不同
3.已知亚硒酸(H2SeO3)为二元弱酸,常温下,向某浓度的亚硒酸溶液中逐滴加入一定浓度的NaOH溶液,所得溶液中H2SeO3、HSeO、SeO三种微粒的物质的量分数与溶液pH的关系如图所示。下列说法不正确的是( )
- 9 -
A.pH=4.2的溶液中:c(Na+)+c(H+)=c(OH-)+3c(HSeO)
B.常温下,亚硒酸的电离平衡常数Ka2=10-4.2
C.在NaHSeO3溶液中,存在c(SeO)
c(C2O)>c(H2C2O4)对应溶液pH:1.22D>E
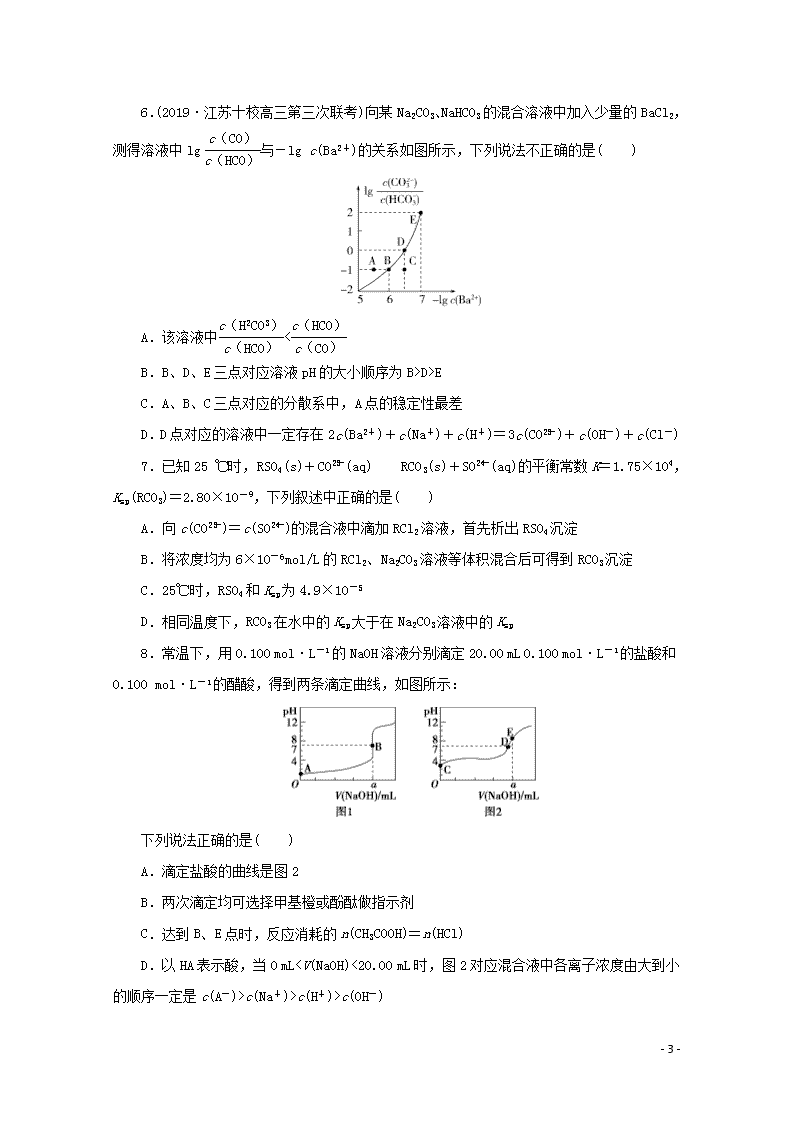
C.A、B、C三点对应的分散系中,A点的稳定性最差
D.D点对应的溶液中一定存在2c(Ba2+)+c(Na+)+c(H+)=3c(CO)+c(OH-)+c(Cl-)
7.已知25 ℃时,RSO4(s)+CO(aq)RCO3(s)+SO(aq)的平衡常数K=1.75×104,Ksp(RCO3)=2.80×10-9,下列叙述中正确的是( )
A.向c(CO)=c(SO)的混合液中滴加RCl2溶液,首先析出RSO4沉淀
B.将浓度均为6×10-6mol/L的RCl2、Na2CO3溶液等体积混合后可得到RCO3沉淀
C.25℃时,RSO4和Ksp为4.9×10-5
D.相同温度下,RCO3在水中的Ksp大于在Na2CO3溶液中的Ksp
8.常温下,用0.100 mol·L-1的NaOH溶液分别滴定20.00 mL 0.100 mol·L-1的盐酸和0.100 mol·L-1的醋酸,得到两条滴定曲线,如图所示:
下列说法正确的是( )
A.滴定盐酸的曲线是图2
B.两次滴定均可选择甲基橙或酚酞做指示剂
C.达到B、E点时,反应消耗的n(CH3COOH)=n(HCl)
D.以HA表示酸,当0 mLc(Na+)>c(H+)>c(OH-)
- 9 -
二、不定项选择题
9.苯甲酸钠(COONa,缩写为NaA)可用作饮料的防腐剂。研究表明苯甲酸(HA)的抑菌能力显著高于A-。已知25 ℃时,HA的Ka=6.25×10-5,H2CO3的Ka1=4.17×10-7,Ka2=4.90×10-11。在生产碳酸饮料的过程中,除了添加NaA外,还需加压充入CO2气体。下列说法正确的是(温度为25 ℃,不考虑饮料中其他成分)( )
A.相比于未充CO2的饮料,碳酸饮料的抑菌能力较低
B.提高CO2充气压力,饮料中c(A-)不变
C.当pH为5.0时,饮料中=0.16
D.碳酸饮料中各种粒子的浓度关系为c(H+)=c(HCO)+c(CO)+c(OH-)-c(HA)
10.25 ℃时,向H2CO3溶液中滴入NaOH溶液,溶液中H2CO3、HCO及CO的物质的量分数δ(X)随溶液pH的变化如图所示[δ(X)=×100%]。下列说法错误的是( )
A.H2CO3的一级电离平衡常数的对数值lg Ka1(H2CO3)=-6.38
B.pH=7时,c(HCO)>c(H2CO3)>c(CO)
C.pH=13时,c(Na+)+c(H+)=c(OH-)+2c(CO)
D.25 ℃时,反应CO+H2OHCO+OH-的平衡常数对数值lg K=-3.79
11.(2019·宿迁高三期末测试)常温下,下列溶液中有关微粒的物质的量浓度关系正确的是( )
A.等物质的量浓度的MgSO4和(NH4)2SO4的混合溶液中:c(SO)>c(NH)>c(Mg2+)>c(H+)
B.向一定浓度Na2CO3溶液中通入少量CO2:c(Na+)=2[c(H2CO3)+c(HCO)+c(CO)]
C.pH=11的氨水与pH=3的盐酸等体积混合,所得溶液中:c(Cl-)>c(NH)>c(H+)>c(OH-)
D.一元酸Ka(HA)=1.75×10-5,20 mL 0.1 mol·L-1的HA与10 mL 0.1 mol·L-1 NaOH混合溶液中:c(A-)+c(OH-)>c(HA)+c(H+)
- 9 -
12.(2019·南京、盐城高三一模)分别调节0.01 mol·L-1 HCOOH溶液、0.01 mol·L-1氨水的pH,系统中微粒浓度的负对数值(-lg c)与pH的关系分别如图所示:
下列说法错误的是( )
A.25 ℃时,NH3·H2ONH+OH-的lg K=-4.7
B.25 ℃时,0.01 mol·L-1 HCOOH溶液的pH为3.7
C.HCOONa溶液中加入NH4Cl至溶液呈中性:c(Cl-)>c(Na+)>c(HCOO-)
D.HCOONa溶液中加入KHSO3至溶液呈中性:c(HCOOH)+c(H2SO3)=c(SO)
参考答案与解析
1.解析:选C。在常温下,分析图像可知,当横坐标为0时,即lg=lg=0,a点表示c(A-)=c(HA),b点表示c(B-)=c(HB),K(HA)==cHA(H+)=10-4,K(HB)==cHB(H+)=10-5,相同温度下,K(HA)>K(HB),即酸性HA强于HB,故A正确; b点时,c(B-)=c(HB),根据电荷守恒可知,c(H+)+c(Na+)=c(B-)+c(OH-),又由于c(H+)>c(OH-),故c(Na+)cHB(H+),根据电荷守恒可知,cHA(H+)+cHA(Na+)=c(A-)+cHA(OH-),cHB(H+)+cHB(Na+)=c(B-)+cHB(OH-),所以,c(A-)+cHA(OH-)>c(B-)+cHB(OH-),故C错误;根据公式K(HB)=可知,-lg K(HB)=-lg,pK=-{lg c(H+)+lg c(B-)-lg c(HB)}=pH-lg c(B-)+lg c(HB),即pH-pK=lg c(B-)-lg c(HB),故D正确。
2.解析:选C。任何温度时,纯水中H+浓度与OH-浓度始终相等,A项错误;随温度升高,CH3COONa水解程度增大,溶液中c(OH-)增大,且温度升高,水的电离程度增大,c(OH-)也增大,B项错误;温度升高,水的电离程度增大,c(H+)增大,又CuSO4水解使溶液显酸性,
- 9 -
温度升高,水解平衡正向移动,故c(H+)增大,C项正确;温度升高,能使电离平衡和水解平衡均向正反应方向移动,而CH3COONa溶液随温度升高pH降低的原因是水的电离程度增大得多,而CuSO4溶液随温度升高pH降低的原因是Cu2+水解程度增大得多,D项错误。
3.解析:选C。pH=4.2时,根据电荷守恒可知,c(Na+)+c(H+)=c(OH-)+c(HSeO)+2c(SeO),已知溶液中HSeO和SeO的浓度相等,故c(Na+)+c(H+)=c(OH-)+3c(HSeO),A项正确;根据电离方程式:H2SeO3HSeO+H+,HSeOSeO+H+可知,Ka2(H2SeO3)=,当pH=4.2时,c(SeO)=c(HSeO),因此Ka2=10-4.2,B项正确;同理可求得Ka1(H2SeO3)=10-1.2,Kh(HSeO)===10-12.8,在NaHSeO3溶液中,Kh(HSeO)c(HSeO),C项错误;向pH=1.2的溶液中滴加NaOH溶液至pH=4.2的过程中,加入的NaOH中和了溶液中的氢离子,促进了水的电离,故水的电离程度一直增大,D项正确。
4.解析:选B。根据物料守恒,Na2S溶液中存在:2c(S2-)+2c(HS-)+2c(H2S)=c(Na+),A项错误;b点是CuCl2与Na2S溶液恰好完全反应的点,c(Cu2+)=c(S2-),根据b点坐标可知,c(Cu2+)=1×10-18mol·L-1,故常温下Ksp(CuS)=1×10-36,Ksp(CuS)的数量级为10-36,B项正确;CuCl2、Na2S均能水解,可促进水的电离,b点是CuCl2与Na2S溶液恰好完全反应的点,溶质是氯化钠,对水的电离平衡没有影响,故b点为水的电离程度最小的点,C项错误;c点对应溶液中溶质为NaCl和Na2S,n(Cl-)=10×10-3×0.1×2 mol=2×10-3mol,n(Na+)=0.1×20×10-3×2 mol=4×10-3mol,则c点对应溶液中:2c(Cl-)=c(Na+),D项错误。
5.解析:选C。草酸的电离平衡常数Ka1=,Ka2=,且Ka1>Ka2,当lg X=0时,即X=1,pH=-lg c(H+)=-lg Ka,pH1=1.22Ka2=10-4.19,所以线Ⅰ中X表示的是,线Ⅱ中X表示的是,A项正确;pH=0时,c(H+)=1 mol·L-1,lg=lg=lg Ka1=-1.22,lg=lg=lg Ka2=-4.19,所以,线Ⅰ、Ⅱ的斜率均为1,B项正确;设pH=a,c(H+)=10-amol·L-1,==10a-4.19,当c(C2O)c(H2C2O4)时,102a-5.41>1,即2a-5.41>0,解得a>2.705,所以c(HC2O)>c(C2O)>c(H2C2O4)对应溶液pH:2.705Kh(HCO),故<,故A正确;根据Ka2=,lg的数值越大,c(H+)越小,溶液酸性越弱,pH越大,因此pH的大小顺序为BKsp(RCO3),向c(CO)=c(SO)的混合液中滴加RCl2溶液,首先析出RCO3沉淀,A项错误;将浓度均为6×10-6mol/L的RCl2、Na2CO3溶液等体积混合后,c(R2+)=3×10-6mol/L、c(CO)=3×10-6mol/L,此时的离子积Qc=c(R2+)·c(CO)=3×10-6×3×10-6=9×10-121,A项错误;甲基橙的变色范围是3.1~4.4,酚酞的变色范围是8.2~10.0,由图2中pH突变的范围(>7)可知,用氢氧化钠溶液滴定醋酸时,只能选择酚酞做指示剂,B项错误;B、E两点对应消耗氢氧化钠溶液的体积均为a mL,所以反应消耗的n(CH3COOH)=n(HCl),C项正确;0 mLc(H+)=c(OH-),D项错误。
9.解析:选C。由题给电离平衡常数可知,HA的酸性比H2CO3的酸性强。A项,A-在溶液中存在水解平衡A-+H2OHA+OH-,碳酸饮料中因充有CO2,可使平衡正向移动,
- 9 -
生成更多的苯甲酸,根据题意,苯甲酸(HA)的抑菌能力显著高于A-,因此相比未充入CO2的饮料,碳酸饮料的抑菌能力较强,错误;B项,提高CO2充气压力,CO2的溶解度增大,可使A-的水解平衡正向移动,饮料中c(A-)减小,错误;C项,由Ka=知,当pH为5.0时,饮料中===0.16,正确;D项,因为不考虑饮料中其他成分,故有电荷守恒c(Na+)+c(H+)=c(HCO)+2c(CO)+c(OH-)+c(A-),物料守恒c(Na+)=c(HA)+c(A-),两式相减得c(H+)=c(HCO)+2c(CO)+c(OH-)-c(HA),错误。
10.解析:选C。根据图像可知,pH=6.38时,c(H+)=10-6.38 mol/L,c(H2CO3)=c(HCO),所以H2CO3的一级电离平衡常数的对数值lg Ka1(H2CO3)=-6.38,A项正确;由图中信息可知,pH=7时,c(HCO)>c(H2CO3)>c(CO),B项正确;pH=13时,由电荷守恒可知,c(Na+)+c(H+)=c(OH-)+c(HCO)+2c(CO),C项错误;由题图可知,pH=10.21时,c(H+)=10-10.21mol/L,c(CO)=c(HCO),所以Ka2(H2CO3)=10-10.21,因此,25 ℃时,反应CO+H2OHCO+OH-的平衡常数K==10-3.79,其对数值lg K=-3.79,D项正确。
11.解析:选AD。A项,NH和Mg2+均水解,但是水解很微弱,所以2 mol NH水解后的量肯定比1 mol Mg2+多,正确;B项,由于外加了CO2,增加了碳元素,所以原来Na2CO3中Na与C之间的物料守恒不成立,错误;C项,氨水过量,溶液显碱性,错误;D项,反应后的溶液中n(HA)∶n(NaA)=1∶1,A-水解方程式为A-+H2OHA+OH-,Kh====≈5.7×10-10,HA的电离大于A-的水解,即溶液显酸性,电荷守恒:c(H+)+c(Na+)=c(OH-)+c(A-),物料守恒:2c(Na+)=c(A-)+c(HA),消去c(Na+)得,2c(H+)+c(HA)=c(A-)+2c(OH-),酸性溶液中,c(H+)>c(OH-),所以c(H+)+c(HA)
查看更多