2018-2019学年江西省上饶市“山江湖”协作体高一下学期第一次月考化学试题(自招班)
2018-2019学年江西省上饶市“山江湖”协作体高一下学期第一次月考化学试题(自招班)
可能用到的相对原子量:H-1 C-12 O-16 I-127 Na-23
一、选择题(每空3分 共48分)
1.在多电子原子里,把电子运动的能量不同的区域简化为不连续的壳层称作为电子层。电子层模型被称为洋葱式结构,如图所示:根据电子层模型,判断下列说法不正确的是( )
A. 多电子原子的核外电子是分层运动的
B. 所有电子在同一区域里运动
C. 排在K、L、M层上的电子的能量依次增大
D. 多电子原子里电子的能量不同
2.短周期元素W、X、Y、Z的原子序数依次增大,W与Y、X与Z分别位于同一主族,W与X可形成共价化合物WX2,Y原子的内层电子总数是最外层电子数的2.5倍。下列叙述不正确的是( )
A.WX2分子中的所有原子最外层都为8电子结构 B.WX2、ZX2的化学键类型相同
C.YX2是共价化合物 D.原子半径:X
Z(b+1)->Xa+
C.Z(b+1)-的还原性一定大于Yb- D.气态氢化物的稳定性Hb+1Z一定大于HbY
4.部分短周期元素原子半径的相对大小、最高正价或最低负价随原子序数的变化关系如图所示,下列说法正确的是( )
A.离子半径的大小顺序:e>f>g>h
B.与x形成简单化合物的沸点:y>z>d
C.x、z、d三种元素形成的化合物可能含有离子键
D.e、f、g、h四种元素对应最高价氧化物的水化物相互之间均能发生反应
5.氰[(CN)2]的化学性质与卤素(X2)很相似,化学上称之为拟卤素,其氧化性介于Br2和I2之间,下列有关反应方程式不正确的是( )
A. (CN)2和NaOH溶液反应:(CN)2+2OH-=== CN-+CNO-+H2O
B. MnO2和HCN反应:MnO2+4HCN(浓)Mn(CN)2+(CN)2↑+2H2O
C. 向KCN溶液中加入碘水:I2+2KCN === 2KI+(CN)2
D. 在NaBr和KCN混合溶液中通入少量Cl2:Cl2+2CN-=== 2Cl-+(CN)2
6.如图中的大黑点代表原子序数为1~18的元素的原子实(原子实是原子除最外层电子后剩余的部分),小黑点代表未用于形成共价键的最外层电子,短线代表共价键。下列各图表示的结构与化学式一定不相符的是( )
A. B. C. D.
7.C2H5OH、CH4、C3H8、C是常用的燃料,它们每1 mol分别完全燃烧时,放出的热量依次为1366.8 kJ、890.3 kJ、2219.9 kJ、393.5 kJ。相同质量的这四种燃料,完全燃烧时放出热量最少的是( )
A.C2H5OH B.CH4 C.C3H8 D.C
8.在25 ℃,101 kPa下,1mol的白磷(化学式为P4)完全燃烧放出的热量比4mol的红磷(化学式为P)完全燃烧放出的热量多。化学方程式分别为P4(s)+5O2(g)===P4O10(s);4P(s)+5O2(g)===P4O10(s)。由此判断,下列说法正确的是( )
A.由红磷转化为白磷是吸热反应,等质量时红磷能量比白磷高
B.由红磷转化为白磷是放热反应,等质量时红磷能量比白磷低
C.由红磷转化为白磷是放热反应,等质量时红磷能量比白磷高
D.由红磷转化为白磷是吸热反应,等质量时红磷能量比白磷低
9.根据碘与氢气反应的热化学方程式
(ⅰ)I2(g)+H2(g) 2HI(g) ΔH=-9.48 kJ·mol-1
(ⅱ)I2(s)+H2(g) 2HI(g) ΔH=+26.48 kJ·mol-1
下列判断正确的是( )
A.254 g I2(g)中通入2 g H2(g),反应放热9.48 kJ
B.1 mol固态碘与1 mol气态碘所含的能量相差17.00 kJ
C.反应(ⅰ)的产物比反应(ⅱ)的产物稳定
D.反应(ⅱ)的反应物的总能量比反应(ⅰ)的反应物的总能量低
10.工业上由 CO2 和 H2 合成气态甲醇的热化学方程式为CO2(g)+3H2(g)===CH3OH(g)+H2O(g) ΔH=-50 kJ·mol-1。下面表示合成甲醇的反应的能量变化示意图,其中正确的是( )
11.用中和热的测定方法,即保温、隔热的条件下,向盛有20 mL 2.08 mol/L的NaOH溶液的试管中分五次加入5 mL未知浓度的H2SO4(边加边振荡,每次加1 mL,不考虑H2SO4溶于水的放热效应)后,测得溶液的温度分别是1.4 ℃、2.5 ℃、4.2 ℃、5.2 ℃、5.18 ℃,则该硫酸的浓度是( )
A.20.8 mol/L B.6.9 mol/L C.5.2 mol/L D.4.16 mol/L
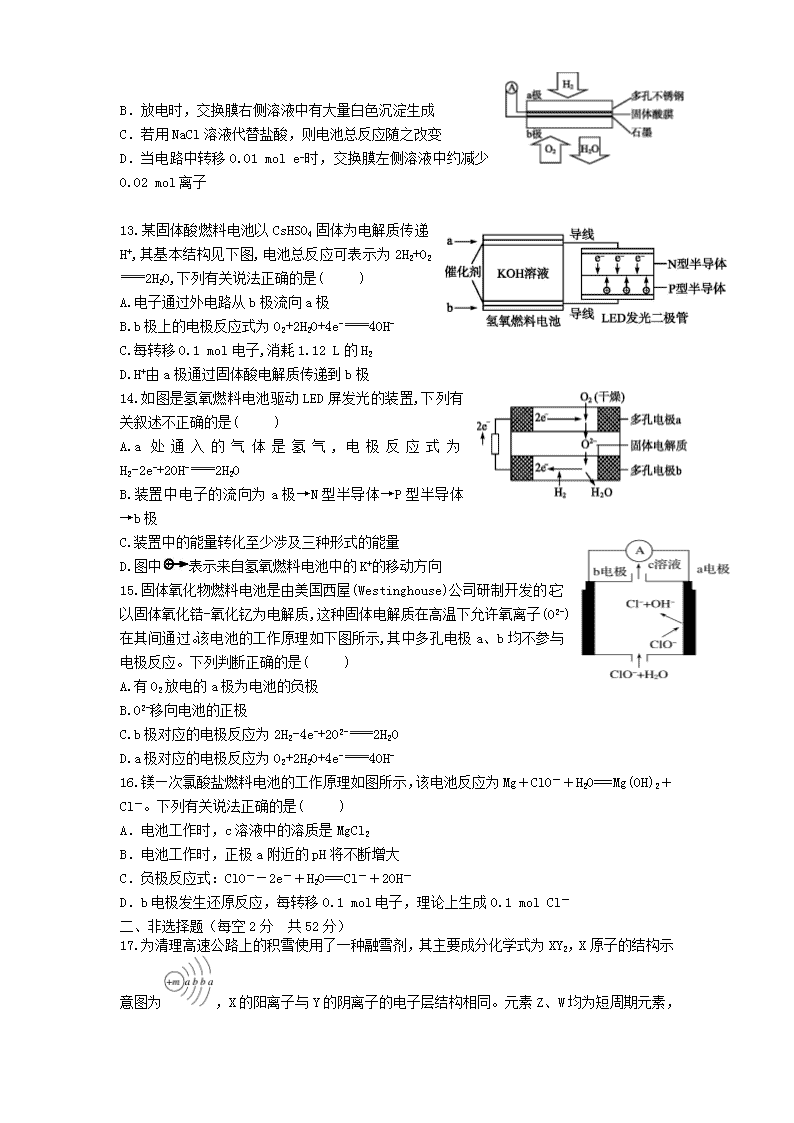
12.某原电池装置如图所示,电池总反应为2Ag+Cl2===2AgCl。下列说法正确的是( )
A.正极反应为AgCl+e−===Ag+Cl−
B.放电时,交换膜右侧溶液中有大量白色沉淀生成
C.若用NaCl溶液代替盐酸,则电池总反应随之改变
D.当电路中转移0.01 mol e−时,交换膜左侧溶液中约减少0.02 mol离子
13.某固体酸燃料电池以CsHSO4固体为电解质传递H+,其基本结构见下图,电池总反应可表示为2H2+O22H2O,下列有关说法正确的是( )
A.电子通过外电路从b极流向a极
B.b极上的电极反应式为O2+2H2O+4e-4OH-
C.每转移0.1 mol电子,消耗1.12 L的H2
D.H+由a极通过固体酸电解质传递到b极
14.如图是氢氧燃料电池驱动LED屏发光的装置,下列有关叙述不正确的是( )
A.a处通入的气体是氢气,电极反应式为H2-2e-+2OH-2H2O
B.装置中电子的流向为a极→N型半导体→P型半导体→b极
C.装置中的能量转化至少涉及三种形式的能量
D.图中表示来自氢氧燃料电池中的K+的移动方向
15.固体氧化物燃料电池是由美国西屋(Westinghouse)公司研制开发的。它以固体氧化锆-氧化钇为电解质,这种固体电解质在高温下允许氧离子(O2-)在其间通过。该电池的工作原理如下图所示,其中多孔电极a、b均不参与电极反应。下列判断正确的是( )
A.有O2放电的a极为电池的负极
B.O2-移向电池的正极
C.b极对应的电极反应为2H2-4e-+2O2-2H2O
D.a极对应的电极反应为O2+2H2O+4e-4OH-
16.镁—次氯酸盐燃料电池的工作原理如图所示,该电池反应为Mg+ClO-+H2O===Mg(OH)2+Cl-。下列有关说法正确的是( )
A.电池工作时,c溶液中的溶质是MgCl2
B.电池工作时,正极a附近的pH将不断增大
C.负极反应式:ClO--2e-+H2O===Cl-+2OH-
D.b电极发生还原反应,每转移0.1 mol电子,理论上生成0.1 mol Cl-
二、非选择题(每空2分 共52分)
17.为清理高速公路上的积雪使用了一种融雪剂,其主要成分化学式为XY2,X原子的结构示意图为
,X的阳离子与Y的阴离子的电子层结构相同。元素Z、W均为短周期元素,它们原子的最外层电子数均是其电子层数的2倍,Z与Y相邻且Z、W能形成一种WZ2型分子。
(1)m=________,该保湿剂的化学式为________。
(2)Z、W元素的名称分别为________、________。
(3)下列说法正确的是________(填字母)。
A.XY2和WZ2都为离子化合物
B.XY2中仅含离子键,WZ2中仅含极性共价键
C.H2Z比HY的稳定性强
D.X的阳离子比Y的阴离子半径大
(4)下列化学用语表达正确的是________(填字母)。
A.XY2的电子式:
B.WZ2的结构式:Z===W===Z
C.Y元素的单质与H2Z水溶液反应的离子方程式:Y2+Z2-===2Y-+Z↓
D.用电子式表示XY2的形成过程:
18.下表中的数据是破坏1 mol物质中的化学键所消耗的能量(kJ):
根据上述数据回答下列问题。
(1)下列物质本身具有的能量最低的是________(填字母代号)。
A.H2 B.Cl2 C.Br2 D.I2
(2)下列氢化物中最稳定的是________(填字母代号)。
A.HCl B.HBr C.HI
(3)X2+H2===2HX(X代表Cl、Br、I)的反应是吸热反应还是放热反应?________。
(4)相同条件下,X2(X代表Cl、Br、I)分别与氢气反应,当消耗等物质的量的氢气时,放出或吸收的热量最多的是________。
19.下面是同学们熟悉的物质:
①O2 ②金刚石 ③NaBr ④H2SO4 ⑤Na2CO3 ⑥NH4Cl ⑦NaHSO4 ⑧Ne ⑨Na2O2 ⑩NaOH
(1)这些物质中,只含有共价键的是______________(填序号,下同);只含有离子键的是____________;既含有共价键又含有离子键的是________________;不存在化学键的是__________________。
(2)将NaHSO4溶于水,破坏了NaHSO4中的___________,写出其电离方程式_________;
20.新型高能钠硫电池以熔融的钠、硫为电极,以钠离子导电的陶瓷为固体电解质。该电池放电时为原电池,充电时为电解池,反应原理为2Na+xS Na2Sx。
(1)放电时S发生______反应,Na作______极。
(2)充电时Na所在电极与直流电源______极相连。
(3)充电时阳极反应式为_______________,放电时负极反应式为____________。
(4)若此电池作电源电解饱和NaCl溶液,当阳极产生11.2L(标准状况下)气体时,消耗金属钠______g。
21、某种燃料电池的工作原理示意图如图所示,a、b均为惰性电极。
(1)使用时,空气从________(填“A”或“B”)口通入。
(2)假设使用的“燃料”是甲醇(CH3OH),总反应式为2CH3OH+4OH-+3O2===2CO+6H2O,则A口通入的气体为______________(填名称)。
(3)b极反应式为____________________________________________。
(4)当电路中通过0.3 mol电子时,消耗甲醇的质量为______ g。
“山江湖”协作体2018-2019学年第二学期高一年级第一次月考化学试题(自招班)
一、选择题
1-5 B D C C C 6-10 C A D D A 11-16 C D D D C B
二、 非选择题
17、 (1)20; CaCl2 (2)硫; 碳
(3) B (4)BD
18、 (1) A (2) A
(4) 放热反应 (4) Cl2
19、(1)①②④; ③; ⑤⑥⑦⑨⑩; ⑧;
(2)离子键和共价键; NaHSO4===Na++H++SO42-
20、(1)还原; 负 (2)负
(3)Sx2- -2e-=xS ; 2Na - 2e-= 2Na+;
(4)23
21、 (1)B (2)甲醇
(3) O2+4e-+2H2O===4OH- (4)1.6