- 2021-08-06 发布 |
- 37.5 KB |
- 9页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2019-2020学年四川省南充高级中学高二12月月考化学试题 word版
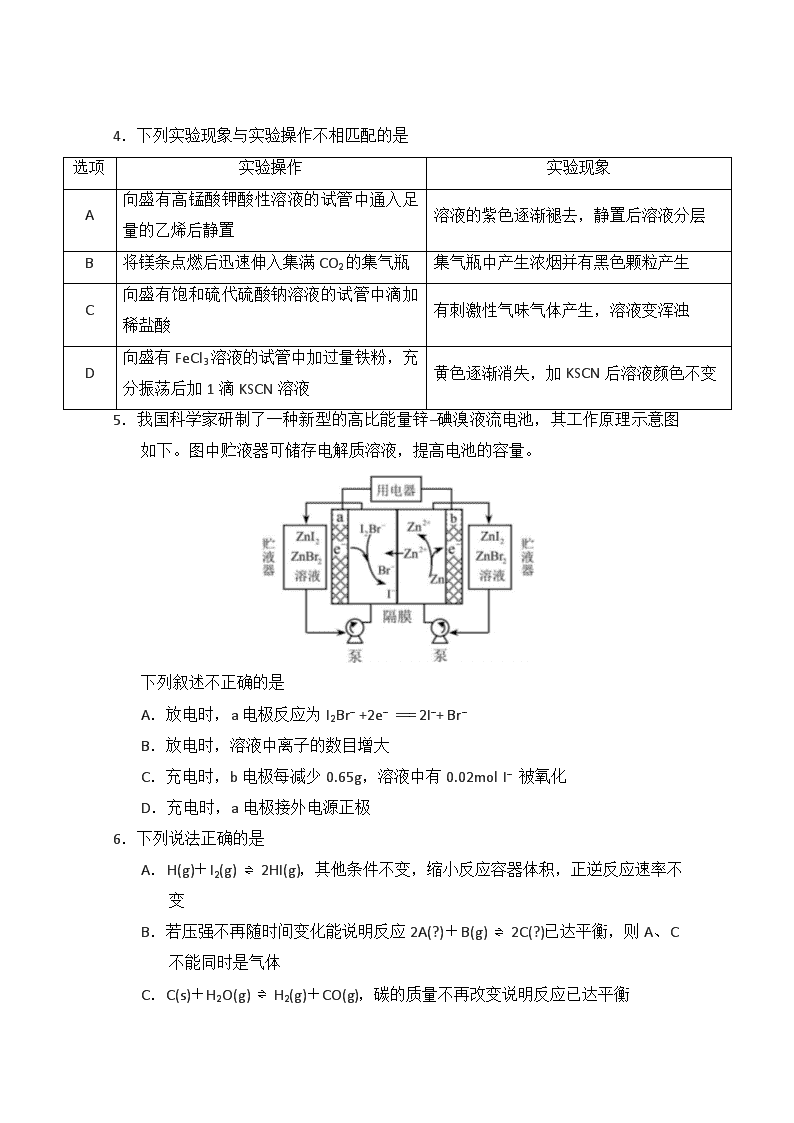
南充高中2019-2020学年度上期 高2018级第二次月考化学试卷 第Ⅰ卷(选择题 共40分) 可能用到的相对原子质量:H—1 O—16 S—32 Cl—35.5 Cu—64 Zn—65 一、选择题(每小题只有一个选项符合题意,每小题4分,共40分) 1.化学在人类社会发展中发挥着重要作用,下列事实不涉及化学反应的是 A.利用废弃的秸秆生产生物质燃料乙醇 B.利用石油生产塑料、化纤等高分子材料 C.利用基本的化学原料生产化学合成药物 D.利用反渗透膜从海水中分离出淡水 2.碘在地壳中主要以NaIO3的形式存在,在海水中主要以I-的形式存在,几种微粒之间的转化关系如图所示。已知:淀粉遇单质碘变蓝。下列说法中,不正确的是 A.氧化性的强弱顺序为:Cl2 >IO3-- >I2 B.一定条件下, I--与IO3--反应可能生成I2 C.向含I--的溶液中通入Cl2,所得溶液加入淀粉溶液一定变蓝 D.途径Ⅱ中若生成1mol I2,消耗5mol NaHSO3 3.设NA为阿伏加德罗常数的值,下列说法不正确的是 A.32 g S8(分子结构:)中的共价键数目为NA B.2 g由H218O和2H2O组成的物质中含有的质子数为NA C.8 g CuO与足量H2充分反应生成Cu,该反应转移的电子数为0.2NA D.标准状况下,22.4 L 辛烷在O2中完全燃烧产生的CO2的分子数为8NA 4.下列实验现象与实验操作不相匹配的是 选项 实验操作 实验现象 A 向盛有高锰酸钾酸性溶液的试管中通入足量的乙烯后静置 溶液的紫色逐渐褪去,静置后溶液分层 B 将镁条点燃后迅速伸入集满CO2的集气瓶 集气瓶中产生浓烟并有黑色颗粒产生 C 向盛有饱和硫代硫酸钠溶液的试管中滴加稀盐酸 有刺激性气味气体产生,溶液变浑浊 D 向盛有FeCl3溶液的试管中加过量铁粉,充分振荡后加1滴KSCN溶液 黄色逐渐消失,加KSCN后溶液颜色不变 5.我国科学家研制了一种新型的高比能量锌−碘溴液流电池,其工作原理示意图如下。图中贮液器可储存电解质溶液,提高电池的容量。 下列叙述不正确的是 A.放电时,a电极反应为I2Br-- +2e-- === 2I-- + Br-- B.放电时,溶液中离子的数目增大 C.充电时,b电极每减少0.65g,溶液中有0.02mol I-- 被氧化 D.充电时,a电极接外电源正极 6.下列说法正确的是 A.H(g)+I2(g) ⇌ 2HI(g),其他条件不变,缩小反应容器体积,正逆反应速率不变 B.若压强不再随时间变化能说明反应2A(?)+B(g) ⇌ 2C(?)已达平衡,则A、C不能同时是气体 C.C(s)+H2O(g) ⇌ H2(g)+CO(g),碳的质量不再改变说明反应已达平衡 D.1 mol N2和3 mol H2反应达到平衡时H2转化率为10%,放出的热量为Q1;在相同温度和压强下,当2 mol NH3分解为N2和H2的转化率为10%时,吸收的热量为Q2,Q2≠Q1 7.环之间共用一个碳原子的化合物称为螺环化合物,螺[2,2]戊烷()是最简单的一种,在一定条件下可与H2发生加成反应。下列关于该化合物的说法不正确的是 A.与环戊烯互为同分异构体 B.所有碳原子不可能处于同一平面 C.二氯代物有四种 D.生成1 molC5H12至少需要2 molH2 8.有5种元素X、Y、Z、Q、T。X原子M层上有2个未成对电子且无空轨道;Y原子的特征电子构型为3d64s2;Z原子的L电子层的p能级上有一个空轨道;Q原子的L电子层的P能级上只有一对成对电子;T原子的M电子层全充满,N电子层只有一个电子。下列叙述不正确的是 A.X和Q组成的化合物为共价化合物 B.T是该元素所在周期中金属性最强的元素 C.Y和X可形成化合物YX或YX2 D.ZX2是极性键构成的非极性分子 9.下列说法不正确的是 A. 的σ键和π键比例为4:1 B.某元素气态基态原子的逐级电离能(kJ•mol﹣1)分别为738、1451、7733、10540、13630、17995、21703,当它与氯气反应时可能生成的阳离子是X2+ C.Na、P、Cl的电负性依次增大 D.CH3CH(OH)COOH分子中有手性碳原子 10.科学家合成出了一种新化合物(如图所示),其中W、X、Y、Z为同一短周期元素,Z核外最外层电子数是X核外电子数的一半。下列叙述正确的是 A.WZ的水溶液呈中性 B.Y的最高价氧化物的水化物是强酸 C.元素非金属性的顺序为Z>Y>X D.该新化合物中Y不满足8电子稳定结构 第Ⅱ卷(非选择题 共60分) 二、填空题(共4个小题,共60分) 催化剂 11.(16分)氯化法是合成硫酰氯(SO2Cl2)的常用方法,实验室合成硫酰氯(SO2Cl2)的反应和实验装置如下: SO2(g)+Cl2(g) SO2Cl2(l) ΔH=- 92.7 kJ/mol 。 碱石灰 有关信息如下:硫酰氯通常条件下为无色液体,熔点为-54.1 ℃,沸点为69.1 ℃,密度为1.67g /cm3,在潮湿空气中“发烟”;100℃以上开始分解,生成二氧化硫和氯气,长期放置也会发生分解。回答下列问题: (1) 装置甲中仪器A的名称为___________,甲中活性炭的作用是________,B的作用为 ; (2)装置丁中发生反应的离子方程式为 ; (3)装置丙中的试剂为 ,若缺少装置乙,氯气和二氧化硫可能发生反应的化学方程式为 ; (4)为提高本实验中硫酰氯的产率,在实验操作中需要注意的事项有 (填序号)。 ①先通冷凝水,再通气 ②控制气流速率,宜慢不宜快 ③若三颈烧瓶发烫,可适当降温 ④加热三颈烧瓶 (5)本实验中通入SO2的体积为11.2 L(已折算成标准状况),Cl2充足,实验最终收集到硫酰氯27.0 mL,则硫酰氯的产率为_________________(结果保留一位小数)。 12.(16分)C、N、Ti、Mn、Cu都是重要的材料元素,其单质及化合物在诸多领域中都有广泛的应用。 (1)Mn位于元素周期表的_________区,Mn2+的价层电子排布图为_____。 (2)N原子核外有______种空间运动状态不同的电子。NO2+ 的立体构型是_________,与它互为等电子体的分子有________(写出一种)。 (3)Cu2+与NH3可形成[Cu(NH3)4]2+配离子,0.5 mol [Cu(NH3)4]2+中含有σ键的个数为_____。已知NF3与NH3具有相同的空间构型,但NF3不易与Cu2+形成配离子,其原因是___________________________________________________________。 (4)纳米TiO2是一种应用广泛的催化剂,其催化的一个实例如图所示。化合物甲中碳原子的杂化方式为___________,乙中所有原子的第一电离能由大到小的顺序为___________。化合物乙的沸点明显高于化合物甲,主要原因是______。 HClO HCN 13.(14分)一种高分子化合物(Ⅵ)是目前市场上流行的墙面涂料之一,其合成路线如下(反应均在一定条件下进行): 回答下列问题: (1)化合物I中所含官能团的名称是_____________,由CH2=CH2生成化合物Ⅰ的反应类型是__________。 (2)分别写出合成线路从化合物Ⅰ到Ⅱ、从化合物Ⅳ到Ⅴ的化学方程式_______________________________、_______________________________。 (3)化合物Ⅲ在一定条件下可生成环状化合物C3H4O2 ,请写出该化合物的结构简式_______________。 (4)下列关于化合物Ⅲ、Ⅳ和Ⅴ的说法中,正确的是_____________。 A.化合物Ⅲ可以发生氧化反应 B.化合物Ⅲ不可以与NaOH溶液反应 C.化合物Ⅳ能与氢气发生加成反应 D.化合物Ⅲ、Ⅳ均可与金属钠反应生成氢气 E.化合物Ⅳ和Ⅴ均可以使溴的四氯化碳溶液褪色 (5)与化合物V具有相同官能团的V的同分异构体有_________种(不包括化合物V本身,且不考虑立体异构)。 14.(14分)铬是一种银白色金属,化学性质稳定,在化合物中常见+2、+3和+6价等价态。工业上以铬铁矿(主要成分为FeO·Cr2O3,含有Al2O3、SiO2等杂质)为主要原料生产金属铬和重铬酸钠Na2Cr2O7·2H2O(已知Na2Cr2O7是一种强氧化剂),其主要工艺流程如下: 查阅资料得知:常温下,NaBiO3不溶于水,有强氧化性,在碱性条件下,能将Cr3+转化为CrO。回答下列问题: (1)滤渣D的化学式为________,溶液A中加入过量H2O2的离子方程式是_____________。 (2)工业上常采用热还原法制备金属铬,写出以Cr2O3为原料,利用铝热反应制取金属铬的化学方程式_______________。 (3)酸化滤液D时,不选用盐酸的原因是_____________。 (4)固体E的主要成分是Na2SO4,根据如图分析操作a为蒸发浓缩、__________、洗涤、干燥。 (5)已知含+6价铬的污水会污染环境,某电镀厂废水中往往含有一定量的Cr2O,可用下列方法进行处理。(已知Cr2O的浓度为1.0×10-3 mol /L) 方法一:电解法——向废水(酸性)中通入直流电,在阴极上,+6价的铬变为低毒的+3价。 ①写出该阴极的电极反应_____________________。 方法二:某研究性学习小组为了变废为宝,在废水中加入绿矾(FeSO4·7H2O)处理得到磁性材料 CrFe2O4(Cr的化合价为+3,Fe的化合价为+3、+2)。 ②欲使1 m3该废水中的Cr2O完全转化为CrFe2O4 ,理论上需要加入________g绿矾 。(已知FeSO4·7H2O摩尔质量为278g/mol) 化学月考参考答案 1.D 2.C 3.D 4.A 5.C 6.C 7.C 8.B 9.A 10.C 11.(每空2分,共16分) (1)冷凝管(蛇形冷凝管或环形冷凝管) 催化剂 防止水蒸气进入,吸收尾气(1个作用1分) (2)Cl−+ClO−+2H+=Cl2↑+H2O (3)饱和食盐水(或饱和氯化钠溶液) SO2+Cl2+2H2O=H2SO4+2HCl (4)①②③ (未选全得1分,选错不得分) (5)66.8% 12.(共16分,除标注外每空2分) (1)d(1分) 3d (1分) ↑ ↑ ↑ ↑ ↑ (2)5(1分) 直线形(1分) CO2(或N2O、CS2 ,其他答案合理即可) (3)8NA (或8×6.02×1023或4.816×1024) F 的电负性比 N 大,N—F 成键电子对偏向 F,导致 NF3 中氮原子核对其孤电子对的吸引能力增强,难于给出孤电子对形成配位键。(答题要点:F的电负性大、N原子不易给出孤电子对。答到一个要点给一分,其他答案合理可酌情给分) (4)sp3 和sp2杂化(答对1个给1分,答错不给分) N>O>C >H 化合物乙分子间存在氢键 13.(每空2分,共14分) (1)羟基、氯原子(1个官能团1分,“氯原子”写成“氯 ”扣1分) 加成反应 一定条件 (2)CH2(OH)CH2Cl + HCN → CH2(OH)CH2CN + HCl CH2=CH-COOH + CH3OH CH2=CH-COOCH3+H2O (3)CH2—CH2 (写成键线式不扣分) O — C==O (4)ACDE(未选全得1分,选错不得分) 4 14.(每空2分,共14分) (1)Al(OH)3 H2O2 + 2Fe2++2H+ == 2Fe3++2H2O (2)Cr2O3+2AlAl2O3+2Cr(条件写成“加热”不扣分) (3)Cr2O会氧化Cl−生成氯气,造成污染(其他答案合理可酌情给分) (4)趁热过滤 (其他答案不得分) (5)Cr2O+6e−+14 H+ == 2 Cr3++7 H2O (6)1112 方程式评分说明:化学式错误、物质缺少、未配平不给分,不写反应条件或写错反应条件扣1分,有机反应条件写成“一定条件”、用箭头连接不扣分,有机反应用键线式不扣分,无气体符号不扣分。查看更多