- 2021-08-06 发布 |
- 37.5 KB |
- 9页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2017-2018学年贵州省思南中学高二上学期期末考试化学试题 Word版
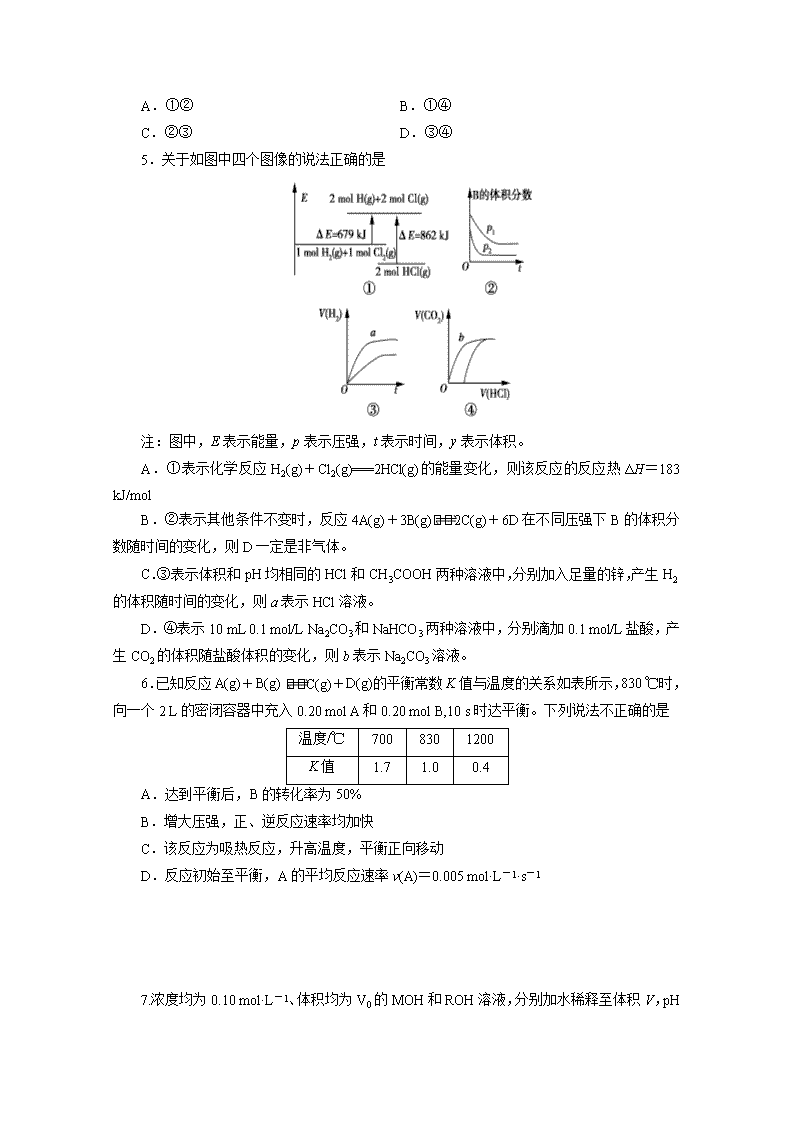
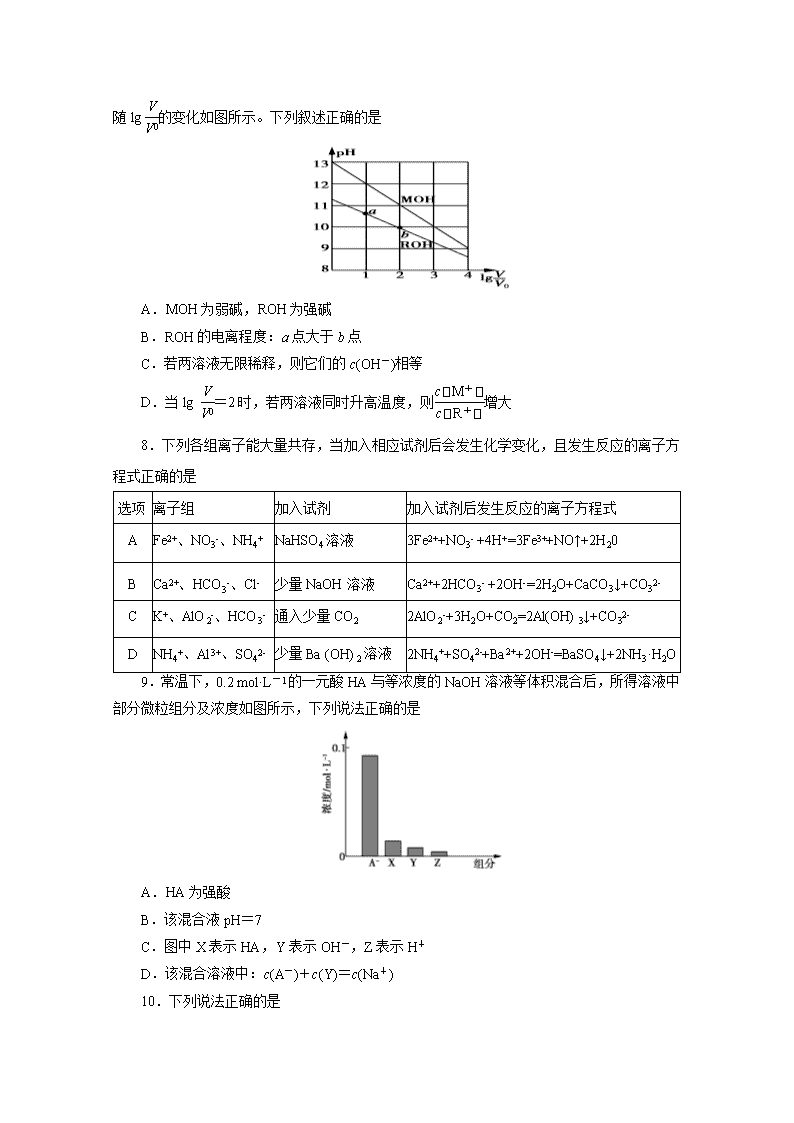
贵州省思南中学2017-2018学年度第一学期期末考试 高二化学(选修4) 考试说明:1.考试时间120分钟,总分100分。 2.可能用到的相对原子量:H 1 O 16 Cu 63.5 3.考生务必将答案答在答题卡上的指定区域内。 一、选择题(本题包括18个小题,每小题3分,共54分) 1.新能源的特点是资源丰富,在使用时对环境无污染或污染很小,且可以再生。下列属于新能源的是 ①煤 ②火力发电 ③太阳能 ④生物质能 ⑤石油 ⑥氢能 A.①②③ B.③④⑥ C.②③⑤ D.②④⑤ 2.某化学反应的能量变化如下图所示。下列有关叙述正确的是 A.该反应的反应热ΔH=E2-E1 B.a、b分别对应有催化剂和无催化剂的能量变化。 C.催化剂不能改变反应的活化能。 D.催化剂能改变反应路径,但不能改变反应的焓变。 3.已知热化学方程式:H+(aq)+OH-(aq)===H2O(l) ΔH1=-57.3 mol·L-1; H2SO4(浓)+NaOH(aq)===Na2SO4(aq)+H2O(l) ΔH2=m,下列说法不正确的是 A.上述热化学方程式中的计量数表示分子数。 B.ΔH1>ΔH2 C.ΔH2应为H2SO4(浓)溶于水的能量变化与中和热之和。 D.|ΔH1|〈|ΔH2| 4.一定条件下,在恒容密闭容器中,能表示反应X(气)+2Y(气)2Z(气)一定达到化学平衡状态的是 ①X、Y、Z的物质的量之比为1∶2∶2 ②X、Y、Z的浓度不再发生变化 ③容器中的压强不再发生变化 ④单位时间内生成n mol Z,同时生成2n mol Y A.①② B.①④ C.②③ D.③④ 5.关于如图中四个图像的说法正确的是 注:图中,E表示能量,p表示压强,t表示时间,y表示体积。 A.①表示化学反应H2(g)+Cl2(g)===2HCl(g)的能量变化,则该反应的反应热ΔH=183 kJ/mol B.②表示其他条件不变时,反应4A(g)+3B(g)2C(g)+6D在不同压强下B的体积分数随时间的变化,则D一定是非气体。 C.③表示体积和pH均相同的HCl和CH3COOH两种溶液中,分别加入足量的锌,产生H2的体积随时间的变化,则a表示HCl溶液。 D.④表示10 mL 0.1 mol/L Na2CO3和NaHCO3两种溶液中,分别滴加0.1 mol/L盐酸,产生CO2的体积随盐酸体积的变化,则b表示Na2CO3溶液。 6.已知反应A(g)+B(g) C(g)+D(g)的平衡常数K值与温度的关系如表所示,830 ℃时,向一个2 L的密闭容器中充入0.20 mol A和0.20 mol B,10 s时达平衡。下列说法不正确的是 温度/℃ 700 830 1200 K值 1.7 1.0 0.4 A.达到平衡后,B的转化率为50% B.增大压强,正、逆反应速率均加快 C.该反应为吸热反应,升高温度,平衡正向移动 D.反应初始至平衡,A的平均反应速率v(A)=0.005 mol·L-1·s-1 7.浓度均为0.10 mol·L-1、体积均为V0的MOH和ROH溶液,分别加水稀释至体积V,pH 随lg的变化如图所示。下列叙述正确的是 A.MOH为弱碱,ROH为强碱 B.ROH的电离程度:a点大于b点 C.若两溶液无限稀释,则它们的c(OH-)相等 D.当lg =2时,若两溶液同时升高温度,则增大 8.下列各组离子能大量共存,当加入相应试剂后会发生化学变化,且发生反应的离子方程式正确的是 选项 离子组 加入试剂 加入试剂后发生反应的离子方程式 A Fe2+、NO3-、NH4+ NaHSO4溶液 3Fe2++NO3- +4H+=3Fe3++NO↑+2H20 B Ca2+、HCO3-、Cl- 少量NaOH溶液 Ca2++2HCO3- +2OH-=2H2O+CaCO3↓+CO32- C K+、AlO2-、HCO3- 通入少量CO2 2AlO2-+3H2O+CO2=2Al(OH) 3↓+CO32- D NH4+、Al3+、SO42- 少量Ba (OH) 2溶液 2NH4++SO42-+Ba2++2OH-=BaSO4↓+2NH3·H2O 9.常温下,0.2 mol·L-1的一元酸HA与等浓度的NaOH溶液等体积混合后,所得溶液中部分微粒组分及浓度如图所示,下列说法正确的是 A.HA为强酸 B.该混合液pH=7 C.图中X表示HA,Y表示OH-,Z表示H+ D.该混合溶液中:c(A-)+c(Y)=c(Na+) 10.下列说法正确的是 A.水的离子积常数KW只与温度有关,但若外加酸、碱会抑制水的电离,若外加盐则可能促进水的电离或不影响水的电离。 B.Ksp不仅与难溶电解质的性质和温度有关,还与溶液中相关离子的浓度有关。 C.常温下,在0.10 mol·L-1的NH3·H2O溶液中加入少量NH4Cl晶体,能使溶液的pH减小,c(NH)/c(NH3·H2O)的值增大,故使NH3·H2O的Kb会减小。 D.室温下,CH3COOH的Ka=1.7×10-5,NH3·H2O的Kb=1.7×10-5,CH3COOH溶液中的c(H+)与NH3·H2O中的c(OH-)相等 11.常温下,将浓度均为0.1 mol/L HA溶液和NaOH溶液等体积混合,混合溶液的pH=9,下列说法正确的是 A.该混合溶液中:c(A-)>c(Na+)>c(OH-)>c(H+) B.该混合溶液中:c(HA)+c(A-)=0.1 mol/L C.常温下,0.1 mol/L HA溶液的pH=1 D.0.1 mol/L HA溶液中:c(HA)>c(A-) 12.已知:25 ℃时,Mg(OH)2的Ksp=5.61×10-12,MgF2的Ksp=7.42×10-11。下列判断不正确的是 A.25 ℃时,饱和Mg(OH)2溶液与饱和MgF2溶液相比,前者的c(Mg2+)较小。 B.25 ℃时,在Mg(OH)2的悬浊液中加入少量的NH4Cl固体,c(Mg2+)增大。 C.25 ℃时,Mg(OH)2固体在20 mL 0.01 mol/L的氨水中的Ksp与在20 mL 0.01 mol/L NH4Cl溶液中的Ksp相同,但前者的溶解度比后者小。 D.25 ℃时,在Mg(OH)2的悬浊液中加入NaF溶液后,Mg(OH)2不可能转化为MgF2。 13.碱性锌锰电池获得了广泛的使用,根据电池的电极反应,下列判断正确的是 A.Zn为负极,MnO2为正极。 B.Zn为正极,MnO2为负极。 C.工作时电子由MnO2经外电路流向Zn极。 D.Zn电极发生还原反应,MnO2电极发生氧化反应。 14.为保护地下钢管不受腐蚀,可使它与 A.交流电源火线相连 B.铜板相连 C.锌板相连 D.直流电源正极相连 15.根据如图回答,下列说法正确的是 A.此装置若用于铁表面镀铜时,a为铁。 B.此装置若用于电镀铜时,硫酸铜溶液的浓度逐渐变小。 C.燃料电池中正极反应为:O2+4e-+2H2O===4OH- D.若用该装置进行粗铜的精炼,当有1 mol水生成时,b电极上增重63.5 g,a电极下方有部分重金属泥。 16.纯净物X、Y、Z转化关系如图所示,下列判断不正确的是 A.X可能是金属铜 B.Y可能是氢气 C.Z可能是氯化钠 D.Z不可能是三氧化硫 17.温度为T时,向2.0 L恒容密闭容器中充入2.0 mol X, 反应X(g) Y(g)+Z(g)经一段时间后达到平衡。反应过程中测定的部分数据见下表: t/s 0 50 150 250 350 n(Y)/mol 0 0.32 0.38 0.40 0.40 下列说法不正确的是 A.反应在前250 s的平均速率为v(Y)=0.000 8 mol·L-1·s-1 B.保持其他条件不变,升高温度,平衡时c(Y)=0.21 mol·L-1,则反应的ΔH>0 C.相同温度下,起始时向容器中充入4.0 mol Y、4.0 mol Z,达到平衡时,则此反应的化学平衡常数为1/20 D.相同温度下,若起始时向容器中充入2.0 mol X、0.40 mol Y和0.80 mol Z,则达到平衡前v(正)>v(逆) 18.用标准盐酸滴定未知浓度的氨水,下列操作引起实验误差分析不正确的是 A.用蒸馏水洗净碱式滴定管后,装入未知浓度的氨水,再移取10.00 mL氨水至锥形瓶,最终会使实验结果偏低。 B.用蒸馏水洗净锥形瓶后,再用氨水润洗,后装入氨水,然后进行滴定,最终会使实验结果偏高。 C.用酸式滴定管盛放盐酸溶液,滴定前开始调节液面时,仰视读数,最终会使实验结果偏低。 D.用酚酞作指示剂滴至红色刚变无色后,要等半分钟,若溶液红色不褪去,表明达到滴定终点。 二、非选择题(本题包括5个小题,共46分)。 19.(10分)判断正误(对的打“√”;错的打“×”)。 (1)明矾和高铁酸钠(Na2FeO4)都可用于水的消毒净化。 (2)硫酸钡和碳酸钡都难溶于水,故都可用于钡餐透视。 (3)液氨是纯净物,氨常用作制冷剂,是因为其沸点较高,很容易液化;氨水呈碱性,是因为氨溶于水生成一水合氨电离产生OH-,使溶液中c(OH-)>c(H+),故溶液呈碱性,同时也抑制了水的电离。 (4)硅的提纯与应用,促进了半导体元件与集成芯片的发展,可以说“硅是信息技术革命的催化剂”; 高纯度的二氧化硅广泛用于制作光导纤维,光导纤维遭遇强碱会“断路”;SiCl4在战争中常用作烟雾弹,是因为它水解时生成白色烟雾。 (5)在硫酸亚铁铵的制备实验中,为了得到硫酸亚铁铵晶体,应小火加热蒸发皿,直到有大量晶体析出时停止加热。 (6)通电时,溶液中溶质离子分别向两极移动,胶体中胶粒向某一极移动。 (7) 可用稀盐酸、碳酸钠溶液、硅酸钠溶液设计实验来验证氯、碳、硅三种元素的非金属性。 (8) 同主族元素的简单阴离子还原性越强,水解程度越大。 (9) 已知次磷酸(H3PO2)是一元弱(中强)酸,且Ka(H3PO2)>Kb(NH3.H2O)。则NH4H2PO2是正盐,且其水溶液呈酸性。 (10) Al2O3在工业上用于制作耐高温材料,也用于电解法治炼铝;工业上也常用电解钠、镁的氧化物来制备相应的金属单质。 20.(6分)钢铁是目前应用最广泛的金属材料,了解钢铁腐蚀的原因与防护方法具有重要意义,对钢铁制品进行抗腐蚀处理,可适当延长其使用寿命。 (1)抗腐蚀处理前,生产中常用盐酸来除铁锈。现将一表面生锈的铁件放入盐酸中,当铁锈除尽后,溶液中发生的化合反应的化学方程式为:________________________。 (2)利用右图装置,可以模拟铁的电化学防护。 ①开关K断开时,且若为生铁,则铁件主要发生 腐蚀;若X为碳棒,为减缓铁件的腐蚀,开关K应置于________处。 ②若X为锌,开关K置于M处,该电化学防护法称为________。 (3)上图中若X为粗铜(含锌等杂质),容器中海水替换为硫酸铜溶液,开关K置于N处,一段时间后,当铁件质量增加127 g时,X电极溶解的铜的质量________127 g(填“<”“>”或“=”)。铁件表面镀铜可有效防止铁被腐蚀,如果铁件部分未镀上铜,或镀层破损,镀铜铁比镀锌铁反而更易被腐蚀,请简要说明原因:__________________________。 21.(13分)合成氨工业对国民经济和社会发展具有重要的意义。其原理为: N2(g)+3H2(g)2NH3(g) ΔH=-Q kJ/mol(Q>0) 据此回答以下问题: (1)①该反应的化学平衡常数表达式为K=________。 ②根据温度对化学平衡的影响规律可知,对于该反应,温度越高,其平衡常数的值越________。 (2) 对于合成氨反应而言,下列有关图像一定正确的是(选填序号)________。 (3) 某温度下,若把2 mol N2与6 mol H2置于体积为1 L的密闭容器内,反应达到平衡状态时,测得混合气体中氨的体积分数为20%,则该温度下反应的K=________(可用分数表示)。 (4)相同温度下,有恒容密闭容器A和恒压密闭容器B,两容器中均充入1 mol N2和3 mol H2,此时两容器的体积相等。在一定条件下反应达到平衡状态,A中NH3的体积分数为a,放出热量Q1 kJ;B中NH3的体积分数为b,放出热量Q2 kJ。则:a________b(填“>”、“=”或“<”,下同),Q1________Q2,Q1_______Q。 22.(10分)环境监测测定水中溶解氧的方法是: ①量取a mL水样,迅速加入固定剂MnSO4溶液和碱性KI溶液(含KOH),立即塞好瓶塞,反复振荡,使之充分反应,其反应式为:2Mn2++O2+4OH-===2MnO(OH)2(该反应极快)。 ②测定:开塞后迅速加入1~2 mL浓硫酸(酸化,提供H+),使之生成I2,再用b mol/L的Na2S2O3溶液滴定(以淀粉为指示剂),消耗V mL。有关反应式为:MnO(OH)2+2I-+4H+===Mn2++I2+3H2O、I2+2S2O===2I-+S4O。 试回答: (1)滴定过程中用到的玻璃仪器除了酸式滴定管、碱式滴定管外还缺少_____________。 (2)滴定操作时,左手控制滴定管,右手________,眼睛要注视________。 (3) 水中溶解氧的计算式是______(以g/L为单位)。 (4) 滴定(I2和S2O反应)以淀粉为指示剂,终点时溶液由________色变为________ 色,且半分钟内不褪色。 23.(7分)(1)已知常温时,0.1 mol/L某一元酸HA在水中有0.1%发生电离,则该溶液的pH=________,此酸的电离平衡常数K=________,由HA电离出的H+的浓度约为水电离出的H+的浓度的________倍。 (2)含有弱酸HA和其钠盐NaA的混合溶液,在化学上用作缓冲溶液。向其中加入少量酸或碱时,溶液的酸碱性变化不大。 ①向该溶液中加入少量盐酸时,发生反应的离子方程式是________________,向其中加入少量KOH溶液时,发生反应的离子方程式是________________。 ②现将0.02 mol·L-1 HA溶液和0.01 mol·L-1 NaOH溶液等体积混合,得到缓冲溶液。 a.若HA为HCN,该溶液显碱性,则溶液中c(Na+)__ ______c(CN-)(填“<”、“=”或“>”)。 b.若HA为CH3COOH,该溶液显酸性,则溶液中所有的离子按浓度由大到小排列的顺序是____________________________。 贵州省思南中学2017-2018学年度第一学期期末考试 高二化学(选修4)参考答案: 一、选择题(本题包括18个小题,每小题3分,共54分) 1-5 BDACB 6-10 CCADA 11-15 DDACD 16-18 CDD 二、非选择题(本题包括5个小题,共46分)。 19.(10分)(每小题1分) 题号 1 2 3 4 5 6 7 8 9 10 答案 × × √ √ √ √ × × √ × 20.(6分)(每空1分) (1)2FeCl3+Fe===3FeCl2 (2)①吸氧 N ②牺牲阳极的阴极保护法(或牺牲阳极保护法) (3)< 在潮湿的环境中构成原电池,铁是负极,加速腐蚀 21.(13分)(除标注外每空2分) (1)①(1分) ②小 (2) a、c (3) 1/48 (4)< < < 22.(10分) (除标注外每空2分) (1)锥形瓶、烧杯 (2)不断振荡锥形瓶 锥形瓶内溶液颜色的变化 (3) 8bV/a (4) 蓝 无 (每空1分) 23.(7分) (每空1分) (1)4 10-7 106 (2)①A-+H+===HA HA+OH-===A-+H2O ②a. > b. c(CH3COO-)>c(Na+)>c(H+)>c(OH-)查看更多