- 2021-08-06 发布 |
- 37.5 KB |
- 6页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020年高考考前45天大冲刺卷理综化学部分十三(全国1卷)
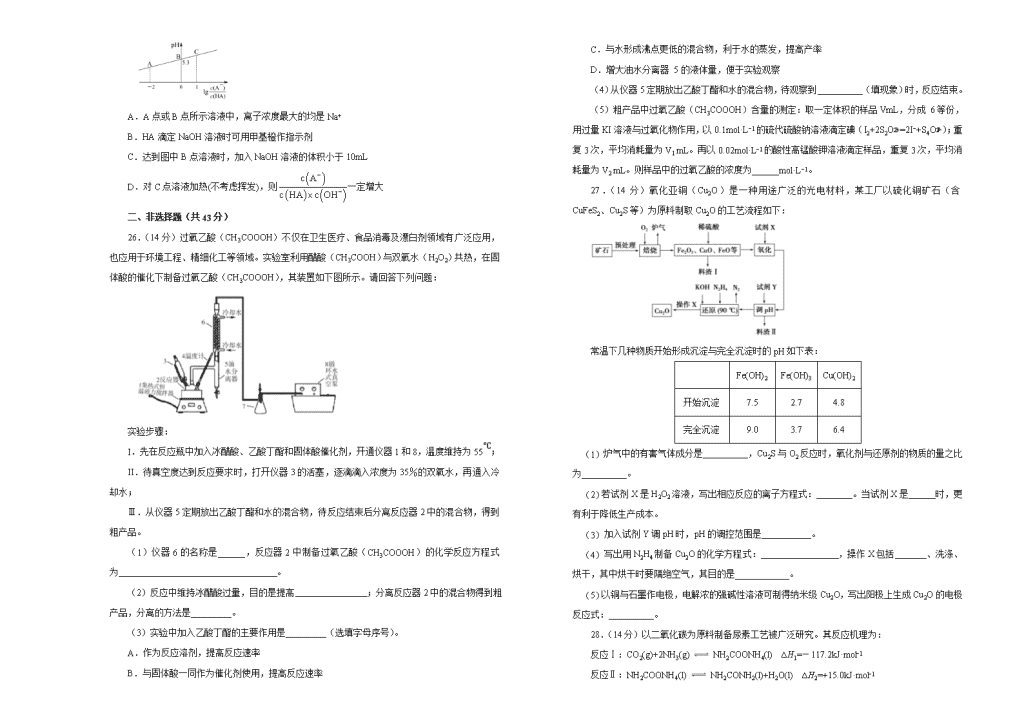
2020年高考考前45天大冲刺卷 理综综合(化学部分)(十三) 注意事项: 1.答题前,先将自己的姓名、准考证号填写在试题卷和答题卡上,并将准考证号条形码粘贴在答题卡上的指定位置。 2.考试结束后,请将本试题卷和答题卡一并上交。 可能用到的相对原子质量:H 1 C 12 N 14 O 16 Na 23 S 32 Cl 35.5 K 39 一、选择题(每题6分,共42分。) 7.造纸术是中国古代四大发明之一。古法造纸是将竹子或木材经过蒸解、抄纸、漂白等步骤制得。下列说法正确的是 A.“文房四宝”中的宣纸与丝绸的化学成分相同 B.“竹穰用石灰化汁涂浆,入木桶下煮”,蒸解过程中使纤维素彻底分解 C.“抄纸”是把浆料加入竹帘中,形成薄层,水由竹帘流出,其原理与过滤相同 D.明矾作为造纸填充剂,加入明矾后纸浆的pH变大 8.实验室石蜡催化裂化的装置如图所示,关于实验操作或叙述错误的是 A.试管Ⅲ中溶液颜色变浅甚至褪色可说明有乙烯生成 B.装置Ⅱ中冷水的作用是冷凝收集裂化油 C.试管Ⅰ连的玻璃导管加长是为使气态石蜡冷凝回流 D.酸性KMnO4溶液若倒吸可加快褪色速率 9.加巴喷丁可以治疗全身强直阵发性癫痫,其结构简式如下。下列关于加巴喷丁的叙述正确的是 A.分子式为C9H12NO2 B.可以发生取代反应、缩聚反应 C.分子中最多有7个碳原子共面 D.易与H2发生加成反应 10.某锂离子电池充电时的工作原理如图所示,LiCoO2中的Li+穿过聚内烯微孔薄膜向左迁移并嵌入石墨(C6表示)中。下列说法错误的是 A.充电时,阳极电极反应式为LiCoO2-xe−=xLi++Lil-xCoO2 B.放电时,该电池将化学能转化为电能 C.放电时,b端为负极,发生氧化反应 D.电池总反应为LixC6+Lil-xCoO2C6+LiCoO2 11.X、Y、Z均为短周期主族元素,Y的核电荷数为奇数,Z的核电荷数为X的2倍。X的最外层电子数等于Y与Z的最外层电子数之和。Y与Z同周期且Y的原子半径大于Z。下列叙述正确的是 A.单质的熔点:Y>Z B.X的最高价氧化物的水化物为弱酸 C.Y、Z的氧化物均为离子化合物 D.气态氢化物稳定性:X>Z 12.某含铬废水中铬的存在形式有三价铬和六价铬两种,其中以六价铬的毒性最大。工业常用还原沉淀法处理含Cr2O和CrO的废水,其工艺流程如下: 下列叙述不正确的是 A.“转化”过程中溶液由橙色变为黄色 B.“还原”反应的离子方程式为Cr2O+6Fe2++14H+=2Cr3++6Fe3++7H2O C.在酸性条件下,用铁板作阳极电解含铬废水也可以将Cr2O还原为Cr3+ D.还原沉淀法产生的污泥是混合污泥不利于回收利用 13.25℃时,向20mL 0.1mol/L一元弱酸HA溶液中滴加0.1mol/L NaOH溶液,溶液中lg与pH关系如图所示。下列说法正确的是 A.A点或B点所示溶液中,离子浓度最大的均是Na+ B.HA滴定NaOH溶液时可用甲基橙作指示剂 C.达到图中B点溶液时,加入NaOH溶液的体积小于10mL D.对C点溶液加热(不考虑挥发),则一定增大 二、非选择题(共43分) 26.(14分)过氧乙酸(CH3COOOH)不仅在卫生医疗、食品消毒及漂白剂领域有广泛应用,也应用于环境工程、精细化工等领域。实验室利用醋酸(CH3COOH)与双氧水(H2O2)共热,在固体酸的催化下制备过氧乙酸(CH3COOOH),其装置如下图所示。请回答下列问题: 实验步骤: I.先在反应瓶中加入冰醋酸、乙酸丁酯和固体酸催化剂,开通仪器1和8,温度维持为55℃; II.待真空度达到反应要求时,打开仪器3的活塞,逐滴滴入浓度为35%的双氧水,再通入冷却水; Ⅲ.从仪器5定期放出乙酸丁酯和水的混合物,待反应结束后分离反应器2中的混合物,得到粗产品。 (1)仪器6的名称是______,反应器2中制备过氧乙酸(CH3COOOH)的化学反应方程式为 。 (2)反应中维持冰醋酸过量,目的是提高 ;分离反应器2中的混合物得到粗产品,分离的方法是_________。 (3)实验中加入乙酸丁酯的主要作用是_________(选填字母序号)。 A.作为反应溶剂,提高反应速率 B.与固体酸一同作为催化剂使用,提高反应速率 C.与水形成沸点更低的混合物,利于水的蒸发,提高产率 D.增大油水分离器 5的液体量,便于实验观察 (4)从仪器5定期放出乙酸丁酯和水的混合物,待观察到__________(填现象)时,反应结束。 (5)粗产品中过氧乙酸(CH3COOOH)含量的测定:取一定体积的样品VmL,分成 6等份,用过量KI溶液与过氧化物作用,以0.1mol·L−1的硫代硫酸钠溶液滴定碘(I2+2S2O=2I−+S4O);重复3次,平均消耗量为V1 mL。再以0.02mol·L−1的酸性高锰酸钾溶液滴定样品,重复3次,平均消耗量为V2 mL。则样品中的过氧乙酸的浓度为______mol·L−1。 27.(14分)氧化亚铜(Cu2O)是一种用途广泛的光电材料,某工厂以硫化铜矿石(含CuFeS2、Cu2S等)为原料制取Cu2O的工艺流程如下: 常温下几种物质开始形成沉淀与完全沉淀时的pH如下表: Fe(OH)2 Fe(OH)3 Cu(OH)2 开始沉淀 7.5 2.7 4.8 完全沉淀 9.0 3.7 6.4 (1) 炉气中的有害气体成分是__________,Cu2S与O2反应时,氧化剂与还原剂的物质的量之比为__________。 (2) 若试剂X是H2O2溶液,写出相应反应的离子方程式:________。当试剂X是______时,更有利于降低生产成本。 (3) 加入试剂Y调pH时,pH的调控范围是___________。 (4) 写出用N2H4制备Cu2O的化学方程式: ,操作X包括_______、洗涤、烘干,其中烘干时要隔绝空气,其目的是____________。 (5) 以铜与石墨作电极,电解浓的强碱性溶液可制得纳米级Cu2O,写出阳极上生成Cu2O的电极反应式:__________。 28.(14分)以二氧化碳为原料制备尿素工艺被广泛研究。其反应机理为: 反应Ⅰ:CO2(g)+2NH3(g) NH2COONH4(l) ∆H1=-117.2kJ·mol−1 反应Ⅱ:NH2COONH4(l) NH2CONH2(l)+H2O(l) ∆H2=+15.0kJ·mol−1 (1)反应Ⅰ平衡常数K的表达式为_____________。 (2)由CO2(g)和NH3(g)合成尿素NH2CONH2(l)的热化学方程式是__________。 (3)在恒容容器中按物质的量之比1∶2通入CO2和NH3,下列不能说明合成尿素反应达平衡状态的是_________。 A.容器中气体平均相对分子质量不再变化 B.容器中气体密度不再变化 C.NH3的体积分数不再变化 D.容器内压强不再变化 (4)通过实验发现,其他条件不变时,改变NH3、CO2的物质的量之比可增加尿素的产率,如图为与尿素产率的关系曲线。通过曲线可知:__________过量对尿素产率的影响比较小。若在固定容器中按等于3.0通入CO2和NH3,则合成尿素反应达平衡后,混合气体中CO2的物质的量分数为________(精确到0.1%)。 (5)探究发现,温度、压强、n(H2O)条件对合成尿素反应的影响如图1、图2,根据图像回答下列问题: ①其他条件不变时,对于合成尿素的反应,若通入CO2物质的量一定,按三种投料比[分别为 3.0、3.5、4.0]投料时,得到如图1的横轴对CO2的平衡转化率的影响曲线。曲线A对应的投料比是________。 ②图2中a、b、c、d四条曲线中的两条代表压强分别为20MPa、25MPa时CO2平衡转化率曲线,其中表示20MPa的是_________(填字母)。在实际生产中采用图2中M点而不是N点对应的反应条件,运用化学反应速率和平衡知识,同时考虑生产实际,说明选择该反应条件的主要原因是________。 三、选考题(共15分,请考生从以下题中任选一题作答,如果多做,则按所做的第一题计分。) 35.【化学——选修3:物质结构与性质】(15分) 据世界权威刊物《自然》最近报道,我国科学家选择碲化锆(ZrTe2)和砷化镉(Cd3As2)为材料验证了三维量子霍尔效应,并发现了金属-绝缘体的转换。回答下列问题: (1)锌和镉位于同副族,而锌与铜相邻。现有4种铜、锌元素的相应状态,①锌:[Ar]3d104s2、②锌:[Ar]3d104s1、③铜:[Ar]3d104s1、④铜:[Ar]3d10。失去1个电子需要的能量由大到小排序是______(填字母)。 A.④②①③ B.④②③① C.①②④③ D.①④③② (2)硫和碲位于同主族,H2S的分解温度高于H2Te,其主要原因是_______。在硫的化合物中,H2S、CS2都是三原子分子,但它们的键角(立体构型)差别很大,用价层电子对互斥理论解释:_________;用杂化轨道理论解释:_________。 (3)Cd2+与NH3等配体形成配离子。[Cd(NH3)4]2+中2个NH3被2个Cl-替代只得到1种结构,它的立体构型是___________。1mol [Cd(NH3)4]2+含___________mol σ键。 (4)砷与卤素形成多种卤化物。AsCl3、AsF3、AsBr3的熔点由高到低的排序为__________。 (5)锆晶胞如图所示,1个晶胞含_______个Zr原子;这种堆积方式称为__________。 (6)镉晶胞如图所示。已知:NA是阿伏加德罗常数的值,晶体密度为d g·cm-3。在该晶胞中两个镉原子最近核间距为______nm(用含NA、d的代数式表示),镉晶胞中原子空间利用率为________(用含π的代数式表示)。 36. 【化学——选修5:有机化学基础】(15分) 两种重要的有机化工合成中间体F和Y可用甲苯为主要原料采用以下路线制得: 已知:① ②2CH3CHOCH3CH(OH)CH2CHOCH3CH=CHCHO 请回答下列问题: (1)写出A的结构简式___________。 (2)B→C的化学方程式是 。 (3)C→D的反应类型为__________。 (4)1mol F最多可以和________mol NaOH反应。 (5)在合成F的过程中,设计B→C步骤的目的是_________。 (6)写出符合下列条件的3种A的同分异构体的结构简式_________、______、_______。 ①苯环上只有两种不同化学环境的氢原子 ②能发生银镜反应 (7)以X和乙醇为原料通过3步可合成Y,请设计合成路线______(无机试剂及溶剂任选)。 参考答案 7. 【答案】C 8. 【答案】A 9. 【答案】B 10. 【答案】D 11. 【答案】D 12. 【答案】A 13. 【答案】C 26. 【答案】(1)(蛇形)冷凝管 CH3COOH+H2O2CH3COOOH+H2O (2) 双氧水的转化率(利用率) 过滤 (3) C (4) 仪器5“油水分离器”水面高度不变 (5) 27. 【答案】(1)SO2 2∶1 (2)2Fe2++2H++H2O2=2Fe3++2H2O 空气或氧气 (3)3.7≤pH<4.8 (4)4CuSO4+N2H4+8KOH2Cu2O+N2↑+4K2SO4+6H2O 过滤 防止Cu2O被空气中氧气氧化 (5)2Cu-2e−+2OH−=Cu2O+H2O 28. 【答案】(1)K= (2) CO2(g)+2NH3(g) ⇌NH2CONH2(l)+H2O(l) ΔH=-102.2 kJ·mol−1 (3) AC (4) CO2 18.2% (5) 4.0 a 与300℃相比,200℃时CO2的平衡转化率更高;虽然压强越大、温度越高反应速率越快,但200℃、20MPa条件下,对设备要求低,有利于降低成本 35. 【答案】(1)A (2) S原子半径小于Te,H-S键的键能较大 H2S分子中S原子价层有2个孤电子对,孤电子对对成键电子对排斥力大于成键电子对之间排斥力,所以键角较小;CS2分子中C原子价层没有孤电子对,成键电子对之间排斥力相同且较小 H2S中S采用sp3杂化,CS2中C采用sp杂化 (3) 正四面体 16 (4) AsBr3>AsCl3>AsF3 (5) 6 六方最密堆积 (6) 36. 【答案】(1) (2) +(CH3CO)2O→+CH3COOH (3) 氧化反应 (4) 3 (5) 氨基易被氧化,在氧化反应之前需先保护氨基 (6) (7) CH3CH2OHCH3CHO 查看更多