2021高考化学全国通用一轮习题:第四章 微题型25 海水资源的综合利用(提取Br2、I2) Word版含解析
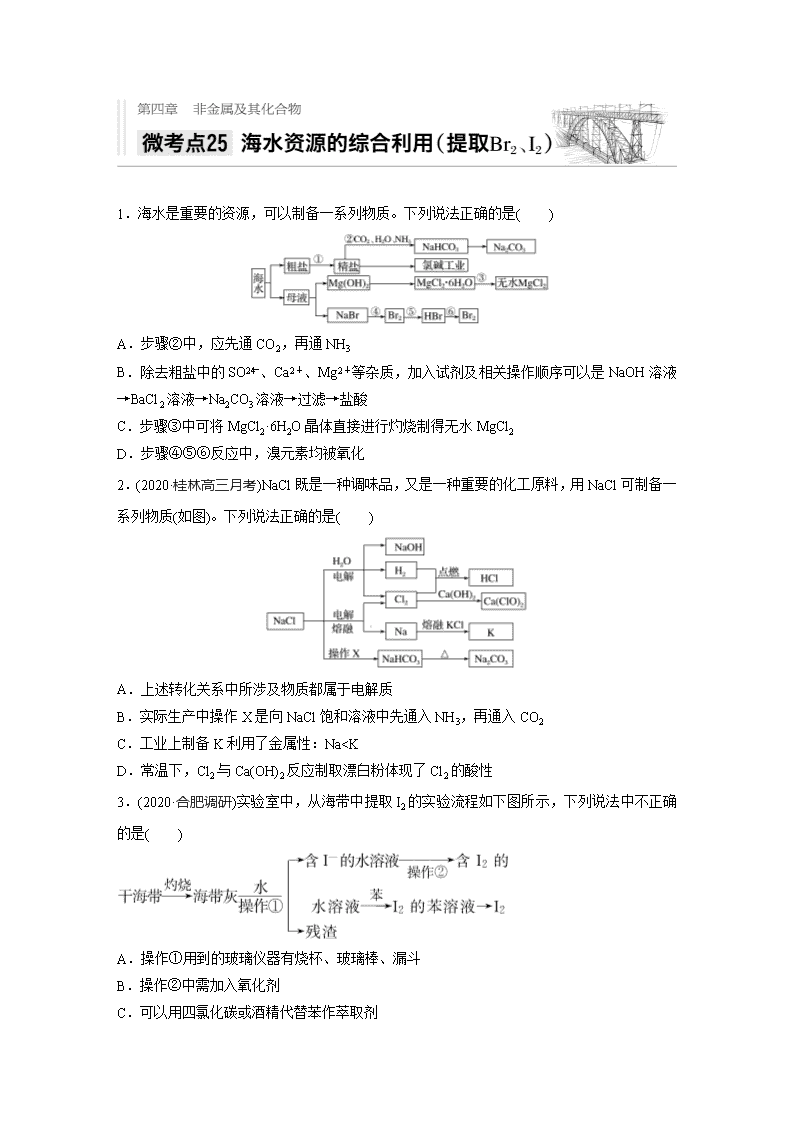
1.海水是重要的资源,可以制备一系列物质。下列说法正确的是( )
A.步骤②中,应先通CO2,再通NH3
B.除去粗盐中的SO、Ca2+、Mg2+等杂质,加入试剂及相关操作顺序可以是NaOH溶液→BaCl2溶液→Na2CO3溶液→过滤→盐酸
C.步骤③中可将MgCl2·6H2O晶体直接进行灼烧制得无水MgCl2
D.步骤④⑤⑥反应中,溴元素均被氧化
2.(2020·桂林高三月考)NaCl既是一种调味品,又是一种重要的化工原料,用NaCl可制备一系列物质(如图)。下列说法正确的是( )
A.上述转化关系中所涉及物质都属于电解质
B.实际生产中操作X是向NaCl饱和溶液中先通入NH3,再通入CO2
C.工业上制备K利用了金属性:Na
I2>IO
C.足量Cl2能使湿润的KI淀粉试纸变白,其原因可能是5Cl2+I2+6H2O===2HIO3+10HCl
D.途径Ⅱ中若生成1 mol I2,反应中转移的电子数为10NA
5.在已经提取氯化钠、溴、镁等化学物质的富碘卤水中,采取下面的工艺流程生产单质碘。
根据以上转化关系,下列说法正确的是( )
A.根据流程,可知甲为AgI,乙为FeI3,丙为Ag2SO4,丁为FeCl2
B.第③步操作中,Fe屑和甲反应的离子方程式为2Ag++Fe===Fe2++2Ag
C.第④步操作用稀H2SO4浸洗的目的是除去Ag中未反应的Fe
D.第⑦步提纯操作为过滤、洗涤、干燥
6.(2020·海口质检)实验室从含Br-的废液中提取溴单质,下列说法中能达到实验目的的是( )
A.用装置甲氧化废液中的Br-
B.用装置乙分离CCl4层和水层
C.用装置丙分离CCl4和液溴
D.用仪器丁长期贮存液溴
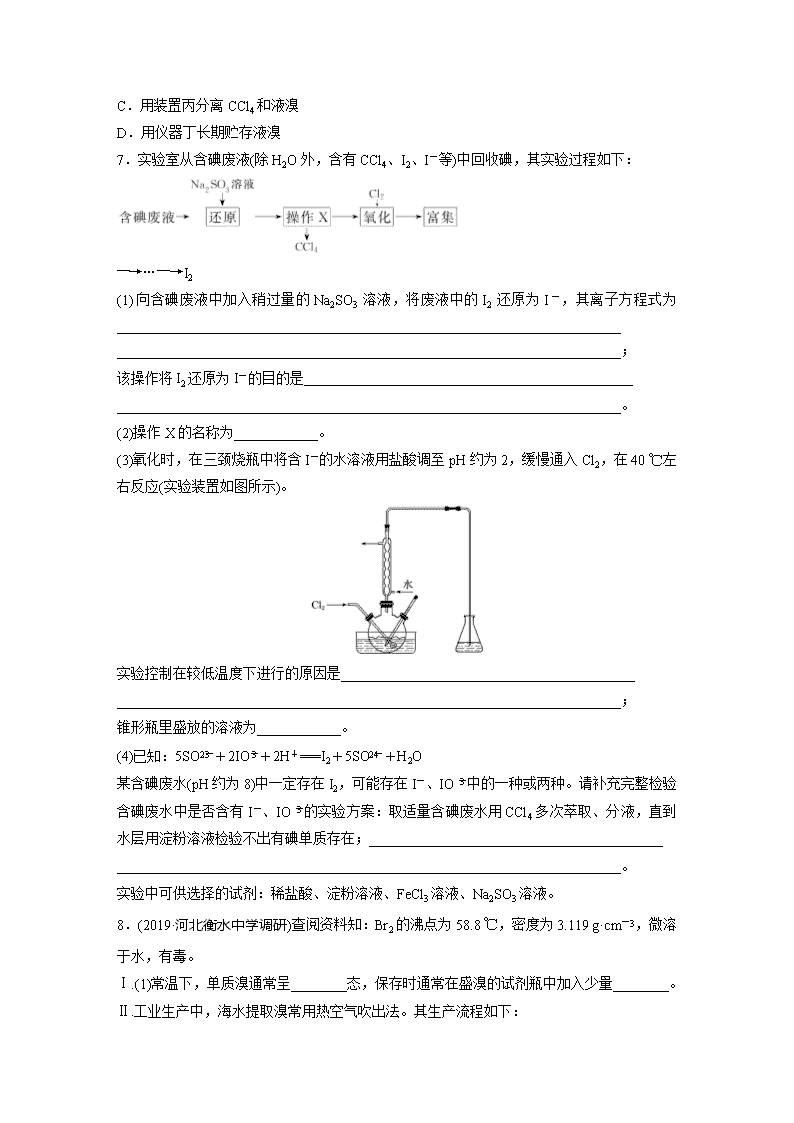
7.实验室从含碘废液(除H2O外,含有CCl4、I2、I-等)中回收碘,其实验过程如下:
―→…―→I2
(1)向含碘废液中加入稍过量的Na2SO3溶液,将废液中的I2还原为I-,其离子方程式为________________________________________________________________________
________________________________________________________________________;
该操作将I2还原为I-的目的是_______________________________________________
________________________________________________________________________。
(2)操作X的名称为____________。
(3)氧化时,在三颈烧瓶中将含I-的水溶液用盐酸调至pH约为2,缓慢通入Cl2,在40 ℃左右反应(实验装置如图所示)。
实验控制在较低温度下进行的原因是__________________________________________
________________________________________________________________________;
锥形瓶里盛放的溶液为____________。
(4)已知:5SO+2IO+2H+===I2+5SO+H2O
某含碘废水(pH约为8)中一定存在I2,可能存在I-、IO中的一种或两种。请补充完整检验含碘废水中是否含有I-、IO的实验方案:取适量含碘废水用CCl4多次萃取、分液,直到水层用淀粉溶液检验不出有碘单质存在;__________________________________________
________________________________________________________________________。
实验中可供选择的试剂:稀盐酸、淀粉溶液、FeCl3溶液、Na2SO3溶液。
8.(2019·河北衡水中学调研)查阅资料知:Br2的沸点为58.8 ℃,密度为3.119 g·cm-3,微溶于水,有毒。
Ⅰ.(1)常温下,单质溴通常呈________态,保存时通常在盛溴的试剂瓶中加入少量________。
Ⅱ.工业生产中,海水提取溴常用热空气吹出法。其生产流程如下:
某化学实验小组模拟该法设计了如下实验装置(夹持装置略去)从浓缩的海水中提取液溴。
实验步骤如下:
①关闭活塞b、d,打开活塞a、c,向A中缓慢通入Cl2至反应结束;
②关闭a、c,打开b、d,向A中鼓入足量热空气;
③关闭b,打开a,再通过A向B中通入足量的Cl2;
④将B中所得液体进行蒸馏,收集液溴。
(2)当观察到A中液面上方出现____________(实验现象)时即可判断步骤①中反应已经结束。
(3)X试剂可以是________(填字母,下同),尾气处理选用________。
a.H2O b.饱和食盐水
c.氢氧化钠溶液 d.饱和Na2SO3溶液
B中X试剂发生反应的离子方程式为_________________________________________
________________________________________________________________________。
(4)蒸馏时应该选择________________(填序号),操作中应控制的关键实验条件为________________________________________________________________________。
Ⅲ.该实验小组利用制得的单质溴研究H2与Br2生成HBr的反应,实验装置如下:
(5)E装置可用来检验反应产物HBr,则D装置的作用是____________________。若要检验E中收集的HBr,图示装置检验HBr还不够完善,请结合原有实验装置予以改进:________________________________________________________________________
________________________________________________________________________。
�
答案精析
1.B 2.B 3.C 4.B
5.C [依据流程,向卤水中加入AgNO3生成的甲应为AgI,AgI和Fe反应的离子方程式为2AgI+Fe===2Ag+Fe2++2I-,在此反应中AgI为沉淀,不能拆分,生成的乙应为FeI2,故A、B项错误;第③步反应生成的Ag中可能混有未反应的Fe,加稀H2SO4是除去未反应的Fe,故C项正确;从碘水中提取单质I2可采取有机溶剂萃取法、升华法提纯,而不能用过滤法,故D项错误。]
6.B
7.(1)SO+I2+H2O===2I-+SO+2H+ 使CCl4中的碘进入水层
(2)分液
(3)使氯气在溶液中有较大的溶解度(或防止I2升华或防止I2进一步被氧化) NaOH溶液
(4)从水层取少量溶液,加入1~2 mL淀粉溶液,加盐酸酸化,若溶液变蓝,则说明废水中同时存在I-和IO,若不变蓝则另从水层取少量溶液于两支试管中,加盐酸酸化,其一滴加FeCl3溶液,若溶液变蓝,说明废水中含有I-,若溶液不变蓝,说明废水中不含有I-;另一支试管滴加Na2SO3溶液,若溶液变蓝,说明废水中含有IO,若溶液不变蓝,说明废水中不含有IO
8.(1)液 水 (2)黄绿色气体 (3)d c Br2+SO+H2O===SO+2Br-+2H+ (4)①③⑤⑥⑦ 控制温度在59 ℃(或58.8 ℃)
(5)除去未反应完的溴蒸气 在D与E之间增加一盛有CCl4的洗气装置
解析 (1)Br2易挥发,密度大于水,微溶于水,所以保存时通常在盛溴的试剂瓶中加入少量水进行水封。(2)当反应完成时,多余Cl2逸出,使A液面上方出现黄绿色气体。(3)Br2能与Na2SO3反应生成Br-,可以用饱和Na2SO3溶液吸收Br2;溴蒸气、Cl2均有毒,可以用NaOH溶液吸收。(4)Br2的沸点为58.8 ℃,则应控制温度在59 ℃(或58.8 ℃)。(5)生成的HBr中混有溴蒸气,由于Br2的沸点较低,通过D装置可以除去溴化氢中的溴蒸气;由于D装置无法完全除去HBr中的Br2,所以该方案不够完善,应该在D和E之间增加一盛有CCl4的洗气装置,确保将HBr中的Br2完全除去。