化学卷·2019届福建省德化一中、永安一中、漳平一中高二上学期联考(2017
“永安一中、德化一中、漳平一中”三校联考
2017—2018学年第一学期第一次月考
高二化学试题
(考试时间:90分钟 总分:100分)
命题人:永安一中 李 影 德化一中 郑妙龄 漳平一中 黄丽惠
本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分
可能用到的相对原子质量:H-1 C-12 N-14 O-16 Na-23 Cu-64 Ag-108
第Ⅰ卷(选择题,共48分)
一、选择题(本大题共16题,每小题3分,共48分。在每小题列出的四个选项中,只有一项是最符合题目要求的。)
1.巴黎气候大会揭开了发展低碳经济的宏伟序幕,下列有关说法不正确的是( )
A.太阳能、地热能、核能、化石燃料等均属于“新能源”
B.减少含碳物质作燃料符合“低碳”理念
C.图中转化途径能体现“节能减排”的思想
D.节约用电能减少CO2的排放量
2.下列说法正确的是( )
A.同温同压下,H2(g)+Cl2(g)===2HCl(g)在光照和点燃条件下的ΔH不同
B.已知4P(红磷,s)===P4(白磷,s)△H=+17 kJ/mol ,则白磷比红磷更稳定
C.已知2H2(g)+O2(g) ===2H2O(l) △H=-571.6kJ/mol,则氢气的燃烧热为285.8 kJ/mol
D.稀溶液中:H+(aq)+OH-(aq)===H2O(l) ΔH=-53.7 kJ/mol ,将含1 mol CH3COOH与含1 molNaOH的稀溶液混合,放出的热量等于53.7 kJ
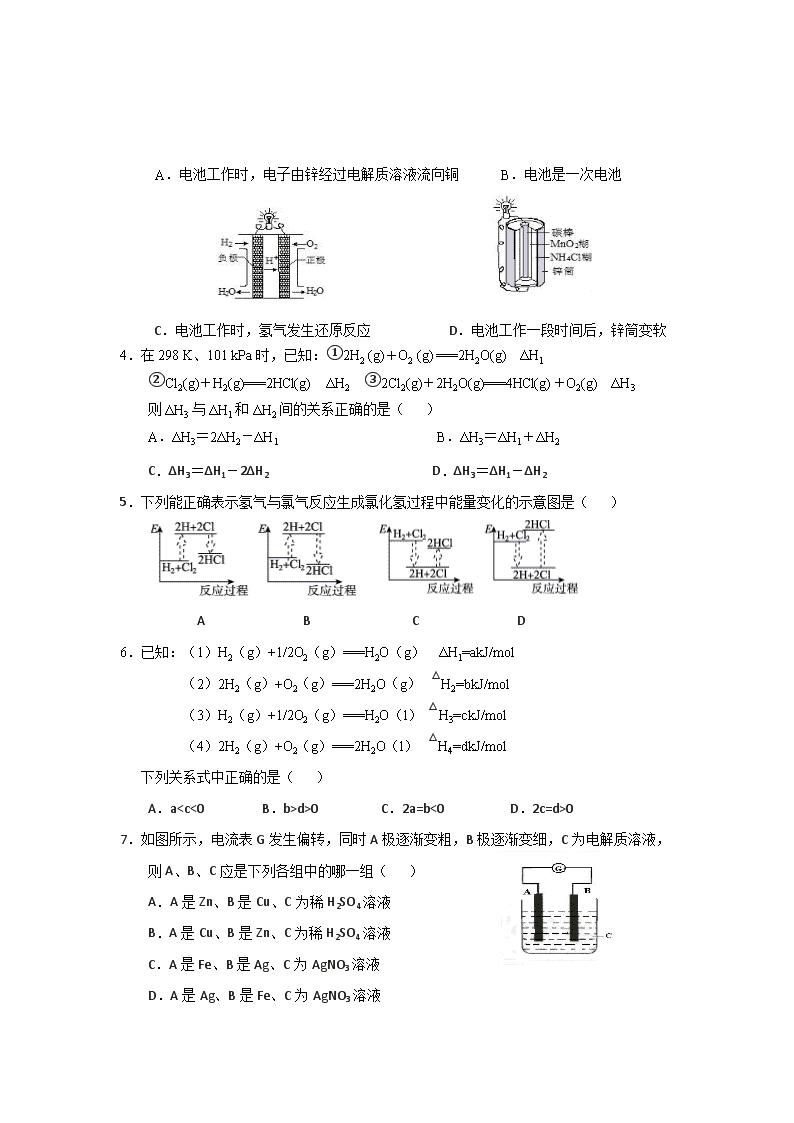
3.下列关于化学能转化为电能的四种装置的说法正确的是( )
A.电池工作时,电子由锌经过电解质溶液流向铜 B.电池是一次电池
C.电池工作时,氢气发生还原反应 D.电池工作一段时间后,锌筒变软
4.在298 K、101 kPa时,已知:①2H2 (g)+O2 (g) ===2H2O(g) ΔH1
②Cl2(g)+H2(g)===2HCl(g) ΔH2 ③2Cl2(g)+2H2O(g)===4HCl(g)+O2(g) ΔH3
则ΔH3与ΔH1和ΔH2间的关系正确的是( )
A.ΔH3=2ΔH2-ΔH1 B.ΔH3=ΔH1+ΔH2
C.ΔH3=ΔH1-2ΔH2 D.ΔH3=ΔH1-ΔH2
5.下列能正确表示氢气与氯气反应生成氯化氢过程中能量变化的示意图是( )
A B C D
6.已知:(1)H2(g)+1/2O2(g)===H2O(g) ΔH1=akJ/mol
(2)2H2(g)+O2(g)===2H2O(g) △H2=bkJ/mol
(3)H2(g)+1/2O2(g)===H2O(l) △H3=ckJ/mol
(4)2H2(g)+O2(g)===2H2O(l) △H4=dkJ/mol
下列关系式中正确的是( )
A.a
d>0 C.2a=b<0 D.2c=d>0
7.如图所示,电流表G发生偏转,同时A极逐渐变粗,B极逐渐变细,C为电解质溶液,
则A、B、C应是下列各组中的哪一组( )
A.A是Zn、B是Cu、C为稀H2SO4溶液
B.A是Cu、B是Zn、C为稀H2SO4溶液
C.A是Fe、B是Ag、C为AgNO3溶液
D.A是Ag、B是Fe、C为AgNO3溶液
8.在电解水制取H2和O2时,为了增强溶液的导电性,常加入一些电解质。下列物质中最合适的是( )
A.NaCl B.CuCl2 C.Na2SO4 D.AgNO3
9.用惰性电极电解M(NO3)x的水溶液,当阴极上增重ag时,在阳极上同时产生b L氧气(标准状况),从而可知M的相对原子质量是( )
A. B. C. D.
10.如右图所示的两个实验装置中,溶液的体积均为200mL,开始时电解质溶液的浓度均为0.1mol/L,工作一段时间后,测得导线中均通过0.02mol电子,若不考虑溶液体积的变化,则下列叙述中正确的是( )
A.①②产生气体的物质的量相等
B.电极上析出物质的质量:①>②
C.溶液的pH变化:①增大,②减小
D.电极反应式②中负极:2H++2e-=H2↑
11.将反应Cu(s)+2Ag+(aq)Cu2+(aq)+2Ag(s)设计成如右图所示的原电池,
下列叙述正确的是( )
A.KNO3盐桥中的K+移向Cu(NO3)2溶液
B.该原电池可使用KCl盐桥
C.工作一段时间后,Cu(NO3)2溶液中c(Cu2+)增大
D.取出盐桥后,电流计的指针依然发生偏转
12.铁镍蓄电池又称爱迪生电池,放电时的总反应为:
Fe+Ni2O3+3H2O Fe(OH)2+2Ni(OH)2,下列有关该电池的说法不正确的是( )
A.电池的电解液为碱性溶液,正极为Ni2O3、负极为Fe
B.电池充电过程中,阴极附近溶液的酸性增强
C.电池放电时,负极反应为Fe+2OH--2e-=Fe(OH)2
D.电池充电时,阳极反应为2Ni(OH)2+2OH--2e-=Ni2O3+3H2O
13.如图所示是一种酸性燃料电池酒精检测仪,具有自动吹气流量侦测与控制的功能,非常适合进行现场酒精检测。下列说法不正确的是( )
A.电流由O2所在的铂电极流出
B.O2所在的铂电极处发生还原反应
C.该电池的负极反应式为:
CH3CH2OH+3H2O-12e-===2CO2↑+12H+
D.微处理器通过检测电流大小可计算出被测气体中酒精的含量
14. 图中X为电源,Y为浸透饱和食盐水和酚酞试液的滤纸,滤纸中央滴有一滴KMnO4溶液,通电后Y中央的紫红色斑向d端扩散。下列判断正确的是( )
A.Z中溶液的pH增大
B.Cu电极质量减小,Pt电极质量增大
C.溶液中的SO向Cu电极定向移动
D.滤纸上c点附近会变红色
15.有一整套电化学装置如右图,关于该装置说法正确的是( )
A.甲池中Mg极为正极,电极反应式为:Mg-2e-═Mg2+
B.甲池中C电极发生氧化反应
C.乙池中将化学能转化为电能
D.乙池左侧石墨电极附近变蓝,右侧石墨电极附近变红
16.利用右图装置进行实验,甲乙两池均为1 mol·L-1的AgNO3溶液,A、B均为Ag电极。实验开始先闭合K1,断开K2。一段时间后,断开K1,闭合K2,形成浓差电池,电流计指针偏转(Ag+浓度越大氧化性越强)。下列说法不正确的是( )
A.闭合K1,断开K2后,A电极增重
B.闭合K1,断开K2后,乙池溶液浓度上升
C.断开K1,闭合K2后,A电极发生氧化反应
D.断开K1,闭合K2后,NO3-向B电极移动
第Ⅱ卷(非选择题,共52分)
二.非选择题(本卷有4小题,共52分)
17.(12分)
(1)卫星发射时可用肼(N2H4)作燃料,8gN2H4(l)在O2(g)中燃烧,生成N2(g)和H2O(l),放出155.5 kJ热量,写出反应的热化学方程式 。
(2) 以CO2与NH3为原料可合成化肥尿素[化学式为CO(NH2)2]。已知:
①2NH3(g)+CO2(g)=NH2CO2NH4(s) △H=-159.5 kJ/mol
②NH2CO2NH4(s)= CO(NH2)2(s) +H2O(g) △H=+116.5 kJ/mol
③H2O(l)=H2O(g) △H=+44 kJ/mol
写出CO2与NH3合成尿素和液态水的热化学方程式____________ ____。
(3)断裂1 mol化学键所需的能量如表所示:
共价键
H—N
H—O
N≡N
O==O
断裂1 mol化学键所需能量/kJ
393
463
941
496
计算1molN2(g)与H2O(g)反应生成NH3(g)和O2(g)的反应热△H = _______________。
(4)氨气在纯氧中燃烧,生成一种单质和水。科学家利用此原理,设计成氨气-氧气燃料电池,则通入氨气的电极在碱性条件下发生反应的电极反应式为 。
18.(12分)
某甲烷燃料电池工作时的装置如图所示,乙池中的两个电极一个是石墨电极,一个是铁电极,工作时M、N两个电极的质量都不减少。请回答下列问题:
(1)铁电极为乙池中 电极(填“M”或“N”);
N极的电极反应式为 ;
通入甲烷的铂电极的电极反应式为 。
(2)在此过程中,乙池中某一电极析出金属银4.32g时,甲池中理论上消耗氧气 L
(标准状况下);若此时乙池溶液的体积为400mL,则乙池中溶液的c(H+)为 mol·L-1。
19.(16分)
电解原理在化学工业中有广泛应用。
I.右图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。请完成以下问题:
(1)若X、Y都是惰性电极,a是饱和NaCl溶液,实验
开始时,同时在两边各滴入几滴酚酞试液,则:
①在X极附近观察到的现象是_________________;
②电解一段时间后,该反应总离子方程式_______________________________;
若用该溶液将阳极产物全部吸收,反应的离子方程式__________________________。
(2)若用该装置电解精炼铜,电解液a选用CuSO4溶液,则:X电极的材料是____________,电解一段时间后,CuSO4溶液浓度_________(填“增大”、减小”或“不变”)。
(3)若X、Y都是惰性电极,a是溶质为Cu(NO3)2和X(NO3)3,
且均为0.1 mol的混合溶液,通电一段时间后,阴极析出固体
质量m(g)与通过电子的物质的量n(mol)关系如图所示,则
Cu2+、X3+、H+氧化能力由大到小的顺序是 。
II.右图为模拟工业离子交换膜法电解饱和食盐水制备烧碱的工作原理。
下列说法正确的是 。
A.从E口逸出的气体是Cl2
B.从B口加入含少量NaOH的水溶液以增强导电性
C.标准状况下每生成22.4 L Cl2,便产生2 mol NaOH
D.电解一段时间后加适量盐酸可以恢复到电解前的浓度
20.(12分)
将V1 mL 1.0 mol·L-1 HCl溶液和V2 mL未知浓度的NaOH溶液混合均匀后,测量并记录溶液的温度,实验结果如下图所示,实验中始终保持V1+V2=50。
(1)对于反应:HCl+NaOH= NaCl+H2O,反应物所具有的总能量E1和生成物所具有的
总能量E2的关系为:E1 E2。(填“>”、“ <”或“=”)
(2)实验中所用NaOH溶液的浓度为 mol·L-1。
(3)若含有8.0 g NaOH的稀溶液与稍过量的1 L 0.21 mol·L-1的盐酸反应放出11.46 kJ的热量,
则表示中和热的热化学方程式为 。
(4)若取50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液置于如图所示的装置中进行中和热的测定实验,回答下列问题:
①从实验装置看,其中尚缺少的一种玻璃用品是_________;
实验序号
起始温度t1/℃
终止温度
(t2)℃
盐酸
NaOH溶液
平均值
1
25.1
24.9
25.0
28.0
2
25.1
25.1
25.1
28.2
3
25.1
25.1
25.1
28.3
4
25.1
25.1
25.1
27.4
②已知盐酸、NaOH溶液密度近似为1.00g/cm3,中和后混合液的比热容C=4.18kJ/(kg·K),
根据上表数据,求出该反应的中和热△H=____________ (保留2位小数) ;
③上述实验数值结果与57.3 kJ/mol有偏差,产生偏差的原因可能是_______________。
“永安一中、德化一中、漳平一中”三校联考
2017—2018学年第一学期第一次月考
高二化学试题参考答案
题号
1
2
3
4
5
6
7
8
答案
A
C
D
A
B
C
D
C
题号
9
10
11
12
13
14
15
16
答案
A
B
C
B
C
D
D
D
一、选择题(共16题,每小题3分,共48分)
二、选择题(共4小题,共52分)
(涉及化学方程式、热化学方程式及电极反应式书写物质表达错误或未配平得0分,其中热化学方程式反应热数据计算错误扣2分,其他瑕疵扣1分)
17.(12分)
(1)N2H4(l)+O2(g)=N2(g)+2H2O(l) △H=-622kJ/mol (3分)
(2) 2NH3(g)+CO2(g)= CO(NH2)2(s) +H2O(l) △H=-87kJ/mol (3分)
(3)+617 kJ/mol (3分)
(4)2NH3-6e-+6OH-= N2+6H2O (3分)
18.(12分)
(1)M(2分)
4OH--4e-===2H2O+O2↑ (3分)
CH4-8e-+10OH-=CO32—+7H2O (3分)
(2)0.224 (2分) 0.1 (2分)
19.(16分)
I.(1)①放出气体,溶液变红 (2分)
② 2Cl-+2H2O2OH-+Cl2↑+H2↑ (3分) Cl2+2OH-= Cl-+ClO-+H2O (3分)
(2)纯铜 (2分) 减小(2分) (3)Cu2+>H+>X3+ (2分)
II.BC (2分)
20. (12分)
(1) > (1分) (2)1.5 (2分)
(3)HCl(aq)+NaOH(aq)===NaCl(aq)+H2O(l) ΔH=-57.3 kJ/mol (3分)
(4)①环形玻璃搅拌棒(2) ②-51.83 kJ/mol (2分)
③实验装置保温、隔热效果差;分多次倒入NaOH溶液;混合溶液未充分搅拌等(2分)(其他合理答案均得分)