化学卷·2018届甘肃定西临洮二中高二上学期第三次月考(2016
班级 学号 姓名 考场
……………………………………………密…………………………………………封…………………………………线………………………………………………
2016—2017学年度第一学期高二年级第三次月考试卷
化 学
一、选择题(每小题2分,共52分。)
1.下列物质的分类组合全部正确的是( )
选项
强电解质
弱电解质
非电解质
A
NaCl
HCl
CO2
B
NaHCO3
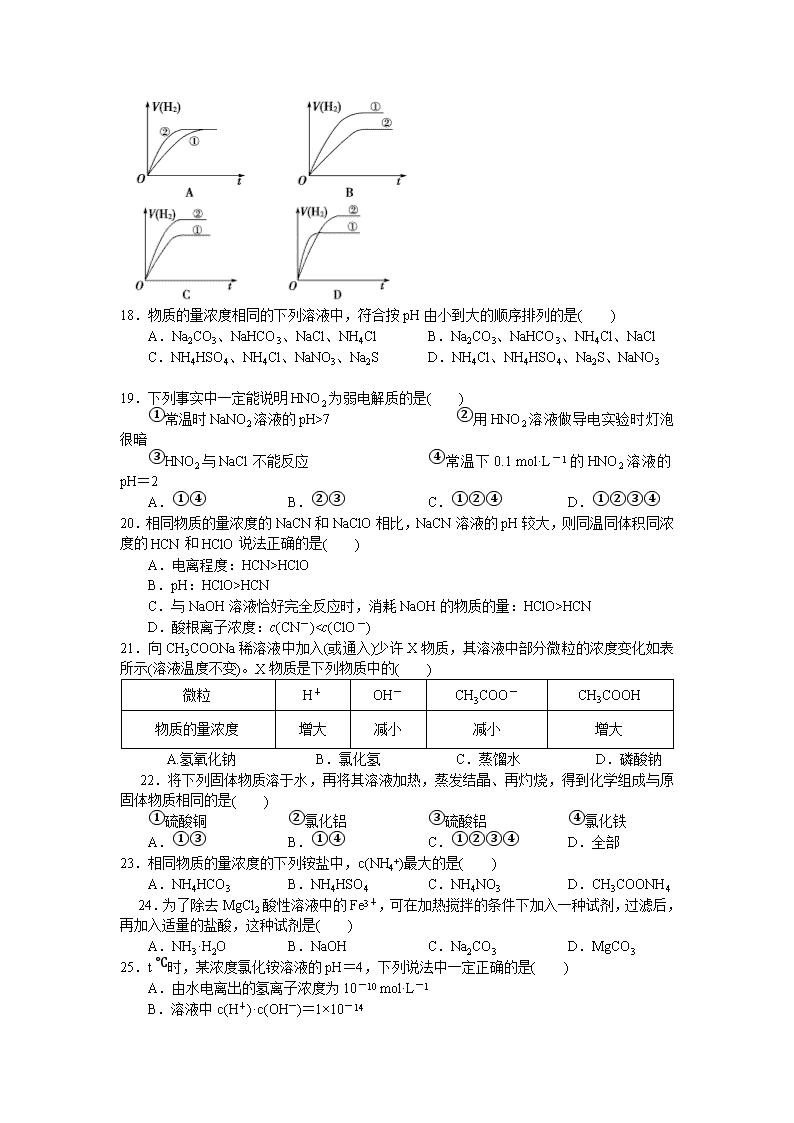
NH3·H2O
CCl4
C
Ba(OH)2
BaCO3
Cu
D
H2SO4
NaOH
C2H5OH
2.下列说法正确的是( )
A.pH=6的溶液一定显酸性
B.常温下由水电离的c(OH-)为1×10-8 mol·L-1的溶液一定呈酸性
C.c(H+)
7 ②用HNO2溶液做导电实验时灯泡很暗
③HNO2与NaCl不能反应 ④常温下0.1 mol·L-1的HNO2溶液的pH=2
A.①④ B.②③ C.①②④ D.①②③④
20.相同物质的量浓度的NaCN和NaClO相比,NaCN溶液的pH较大,则同温同体积同浓度的HCN和HClO说法正确的是( )
A.电离程度:HCN>HClO
B.pH:HClO>HCN
C.与NaOH溶液恰好完全反应时,消耗NaOH的物质的量:HClO>HCN
D.酸根离子浓度:c(CN-)c(NH4+)>c(H+)>c(OH-)
D.溶液中c(NH3·H2O)+c(NH4+)=c(Cl-)+c(OH-)
班级 学号 姓名 考场
WWW.ziyuanku.com
……………………………………………密…………………………………………封…………………………………线………………………………………………
26.把0.02 mol·L-1 CH3COOH溶液和0.01 mol·L-1 NaOH溶液以等体积混合后溶液显酸性,混合溶液中粒子浓度关系正确的是( )
A.c(CH3COO-)>c(Na+)
B.c(CH3COOH)>c(CH3COO-)
C.2c(H+)=c(CH3COO-)-c(CH3COOH)
D.c(CH3COOH)+c(CH3COO-)=0.02 mol·L-1
二、非选择题(共48分)
【来源:全,品…中&高*考+网】27、(12分) (1)写出下列物质发生水解反应的离子方程式,并判断溶液的酸碱性。
①Na2S:____________________________________( )
②NH4NO3:_____________________________________________( )
(2)写出下列各组盐溶液混合后发生反应的离子方程式。
①AlCl3和NaAlO2:
②Al2(SO4)3和NaHCO3:
28、(15分)室温下向10 mL NaOH溶液中加入0.1 mol·L-1 的CH3COOH溶液,溶液pH的变化曲线如图所示。
(1)NaOH溶液的浓度为_________________ mol·L-1
(2)a点溶液中离子浓度大小_____________________
【来源:全,品…中&高*考+网】电荷守恒关系______________________________
物料守恒关系______________________________
质子守恒关系______________________________
(3)当混合溶液pH=7时,溶液中离子浓度关系
___________________________________
(4)b点溶液中离子浓度大小
___________________________________
(5)a点溶液中c(A-)与c(HA)之和等于____________mol·L-1
29、(10分)pH=2的两种一元酸x和y,体积均为100 mL,稀释过程中pH与溶液体积的关系如图所示。分别滴加NaOH溶液(c=0.1 mol/L)至pH=7,消耗NaOH溶液的体积为Vx、Vy,则
(1)判断一元酸x__________、y____________(填“强酸”或“弱酸”)。
(2)c(x)与c(y)的相对大小_________________
(3)Vx与Vy的相对大小___________________
(4)物质的量浓度相同的x、y两种溶液中,c(H+)x和c(H+)y的相对大小__________________,pHx与pHy的相对大小_____________。
30、(11分)下图是用0.200 0 mol·L-1的盐酸滴定某未知浓度的NaOH溶液的示意图和某次滴定前、后盛放盐酸的滴定管中液面的位置。
请回答:
(1)仪器A的名称是________。
(2)盐酸的体积读数:滴定前读数为________mL,滴定后读数为________mL。
(3)当_______________________________________时,反应达到滴定终点。
(4)某实验小组同学的三次实验的实验数据如下表所示。根据表中数据计算出的待测NaOH溶液的平均浓度是________mol·L-1。(保留四位有效数字)
实验
编号
待测NaOH溶
液的体积(mL)
滴定前盐酸的
体积读数(mL)
滴定后盐酸的
体积读数(mL)
1
20.00
1.20
23.22
2
20.00
1.21
29.21
3
20.00
1.50
23.48
(5)对下列几种假定情况进行讨论:(填“无影响”、“偏高”、“偏低”)
①取待测液的滴定管,滴定前滴定管尖端有气泡,滴定后气泡消失________;
②若滴定前锥形瓶未用待测液润洗,对测定结果的影响是________;
③标准液读数时,若滴定前俯视,滴定后仰视,对测定结果的影响是________;
④取待测液时,滴定前仰视,滴定后俯视,对测定结果的影响是________。
2016—2017学年度第一学期高二年级第三次月考试卷
化学答案
一、选择题(每小题2分,共52分。)
题号
1
2
3
4
5
6
7
8
9
10
11
12
13
答案
B
C
D
B
A
C
B
B
A
D
D
C
A
题号
14
15
16
17
18
19
20
21
22
23
24
25
26
答案
A
C
C
C
C
A
D
B
A
B
D
C
A
二、非选择题(共48分)
27(1) ①S2-+H2OHS- + OH-,HS- + H2OH2S + OH- (2分) 碱性(1分)
②NH4+ + H2ONH3•H2O + H+ (2分) 酸性(1分)
(2) ①Al3+ + 3AlO2-+ 6H2O4Al(OH)3(3分)
②Al3+ + 3HCO3-Al(OH)3+ CO2(3分)
28(1)0.1mol/L(1分)
(2)c(Na+) > c(CH3COO-) > c(OH-) > c(H+)(2分)
c(Na+) + c(H+) = c(CH3COO-) + c(OH-) (2分)
c(Na+) = c(CH3COO-) + c(CH3COOH) (2分)
c(H+) + c(CH3COOH) = c(OH-) (2分)
(3)c(Na+) = c(CH3COO-) > c(OH-) = c(H+)(2分)
(4)c(CH3COO-) > c(Na+) > c(H+) > c(OH-) (2分)
(5)0.05(2分)
29、(10分)
(1) 强酸(1分) 弱酸(1分) (2)c(x) < c(y) (2分)
(3)Vx < Vy (2分)
(4) c(H+)x >c(H+)y (2分) pHx <pHy(2分)
30、(1) 酸式滴定管(1分) (2) 0.80 (1分) 22.80(1分)
(3)当最后一滴标准溶液滴入锥形瓶后,溶液的颜色发生明显变化,并且半分钟后不恢复原来的颜色时(2分)
(4) 0.2200(2分)
(5)①偏低(1分)②无影响(1分)③偏高(1分) ④偏高(1分)