2017-2018学年湖北省汉川二中高一下学期期末考试化学试卷
2017-2018学年湖北省汉川二中高一下学期期末考试化学试卷
可能用到的相对原子质量: H-1 C-12 N-14 O-16 Na-23 A1-27 S-32 Fe-56 Cl-35.5
第I卷(选择题 共48分)
一、选择题(本题共16小题,每小题3分,共48分。每小题只有一个正确答案)
1.下列说法错误的是
A.蔗糖、果糖和麦芽糖均为双糖
B.商代后期铸造出工艺精湛的司母戊鼎,该鼎属于铜合金制品
C.植物油含不饱和脂肪酸酯,能使Br₂/CCl4褪色
D.汉代烧制出“明如镜、声如磬”的瓷器,其主要原料为黏士
2.下列有关从海带中提取碘的实验原理和装置能达到实验目的的是
A.用装置甲灼烧碎海带
B.用装置乙过滤海带灰的浸泡液
C.用装置丙制备用于氧化浸泡液中I−的Cl2
D.用装置丁吸收氧化浸泡液中I−后的Cl2尾气
3.NA是阿伏加德罗常数的值,下列说法正确的是
A.16.25 g FeCl3水解形成的Fe(OH)3胶体粒子数为0.1 NA
B.标准状况下,11.2L甲烷和乙烯混合物中含氢原子数目为2NA
C.密闭容器中,2mol SO2 和1mol O2催化反应后分子总数为2NA
D.1.0 mol CH4与Cl2在光照下反应生成的CH3Cl分子数为1.0NA
4.下列有关物质性质的比较,结论正确的是
A.溶解度:Na2CO3
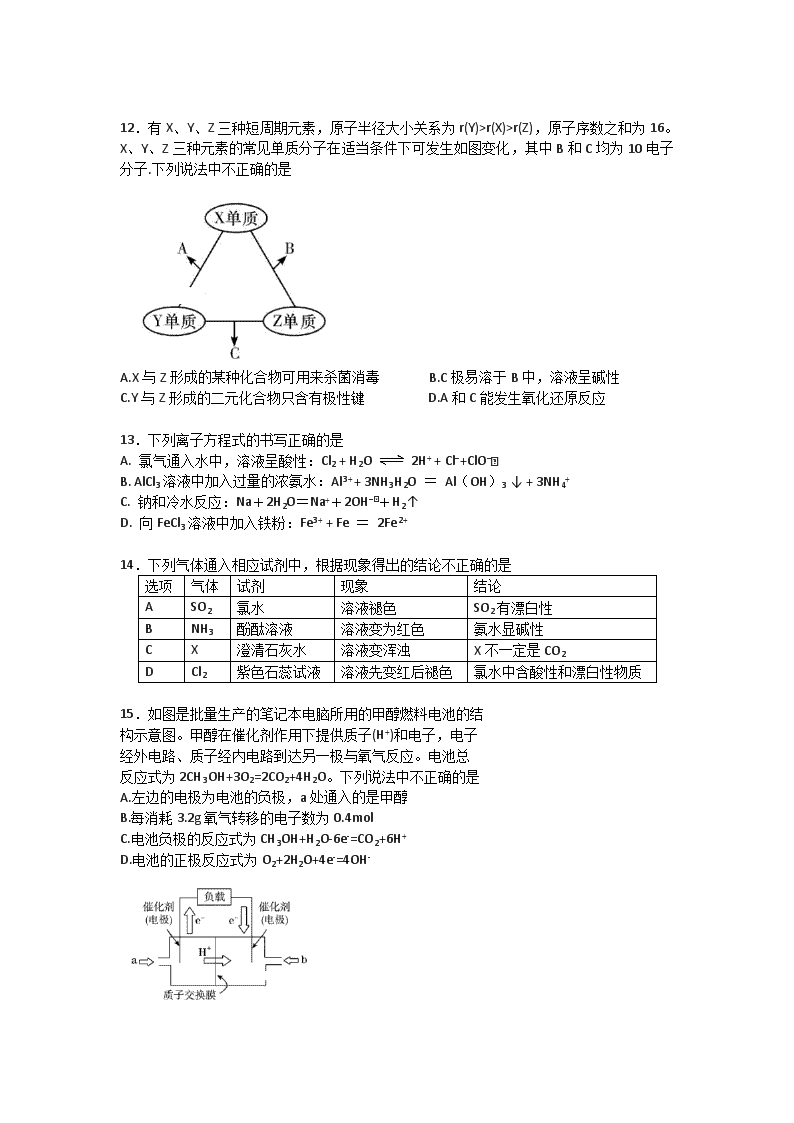
r(X)>r(Z),原子序数之和为16。X、Y、Z三种元素的常见单质分子在适当条件下可发生如图变化,其中B和C均为10电子分子.下列说法中不正确的是
A.X与Z形成的某种化合物可用来杀菌消毒 B.C极易溶于B中,溶液呈碱性
C.Y与Z形成的二元化合物只含有极性键 D.A和C能发生氧化还原反应
13.下列离子方程式的书写正确的是
A. 氯气通入水中,溶液呈酸性:Cl2 + H2O 2H+ + Cl−+ClO−-
B. AlCl3溶液中加入过量的浓氨水:Al3+ + 3NH3H2O = Al(OH)3 ↓ + 3NH4+
C. 钠和冷水反应:Na+2H2O=Na++2OH−-+H2↑
D. 向FeCl3溶液中加入铁粉:Fe3+ + Fe = 2Fe2+
14.下列气体通入相应试剂中,根据现象得出的结论不正确的是
选项
气体
试剂
现象
结论
A
SO2
氯水
溶液褪色
SO2有漂白性
B
NH3
酚酞溶液
溶液变为红色
氨水显碱性
C
X
澄清石灰水
溶液变浑浊
X不一定是CO2
D
Cl2
紫色石蕊试液
溶液先变红后褪色
氯水中含酸性和漂白性物质
15. 如图是批量生产的笔记本电脑所用的甲醇燃料电池的结
构示意图。甲醇在催化剂作用下提供质子(H+)和电子,电子
经外电路、质子经内电路到达另一极与氧气反应。电池总
反应式为2CH3OH+3O2=2CO2+4H2O。下列说法中不正确的是
A.左边的电极为电池的负极,a处通入的是甲醇
B.每消耗3.2g氧气转移的电子数为0.4mol
C.电池负极的反应式为CH3OH+H2O-6e-=CO2+6H+
D.电池的正极反应式为O2+2H2O+4e-=4OH-
16.在372K时,把0.5molN2O4 通入体积为5L的真空密闭容器中,立即出现红棕色。反应进行到2s时,NO2的浓度为0.02mol/L。在60s时,体系已达平衡,此时容器内压强为开始时的1.6倍.下列说法正确的是
A.前2s以N2O4的浓度变化表示的平均反应速率为0.01mol/(L·s)
B.在2s时体系内压强为开始时的1.1倍
C.在平衡时体系内含有N2O40.25mol
D.平衡时,N2O4的转化率为40%
第II卷(非选择题共52分)
第II卷(非选择题,本题包括5小题,共52分。)
17.(10分)A、B、C、X均为中学常见的纯净物,它们之间有如下转化关系(反应条件及副产物已略去)。
(1)若A、B、C均为含有同种非金属元素的化合物,A为使湿润的红色石蕊试纸变蓝的气体,B接触空气立刻变为C,则反应①的化学方程式为_______________________。
(2)若A、B、C为焰色反应均呈黄色的化合物,X为无色无味气体,则反应②的离子方程式为_____________________________________________。
(3)若A、B、C均为含有同种金属元素的化合物,X是强碱,则反应②的离子方程式为________________________________________________。
(4)若A为单质Fe,X为稀硝酸,若向B的溶液中加入氢氧化钠溶液,现象为________________________________________。
(5)若A和X均为单质,B为可使品红溶液褪色的气体,则反应②的化学方程式为
_______________________________________________________________。
18.(12分)(1)研究SO2的性质对改善空气质量具有重要意义。某化学兴趣小组为探究SO2的化学性质进行以下实验,如下图装置(加热及固定装置已略去)。
①以上实验中,体现SO2具有氧化性的实验现象为____________,对应化学方程式为_____________________。
② D装置的作用是__________,写出该装置中发生的离子方程式______________。
③ A中反应开始后,试管B中始终无明显现象。现将试管B中溶液分成两份,分别滴加一定量的氯水和氨水,均出现白色沉淀,任选其中一个实验,结合离子方程式进行解释:_____________________________________________。
(2)硫酸工厂的烟气中含有SO2,有多种方法可实现烟气脱硫。
① “钠碱法”用NaOH溶液作吸收剂,向 100 mL 0.3 mol·L-1的NaOH溶液中通入标准状况下0.448 L SO2气体,所得溶液中的溶质是_______________________________(填化学式)。
② 某硫酸厂拟用含Cr2O72--的酸性废水处理烟气中SO2,反应后的铬元素以Cr3+形式存在,则反应中氧化剂和还原剂的物质的量之比是__________________。
19.(12分)某温度时,在2L的密闭容器中,X、Y、Z(均为气体)三种物质的量随时间的变化曲线如图所示。
(1)由图中所给数据进行分析,该反应的化学方程式为__________。
(2)反应从开始至2分钟,用Z的浓度变化表示的平均反应速率为V(Z)= __________。
(3)2min反应达平衡,容器内混合气体的平均相对分子质量比起始时______(填增大、减小或不变);混合气体密度比起始时_______(填增大、减小或不变).
(4)将amolx与bmolY的混合气体发生上述反应,反应到某时刻各物质的量恰好满足:n(X)=n(Y)=n(Z),则原混合气体中a:b=__________。
(5)下列措施能加快反应速率的是_________。
A.恒压时充入He; B.恒容时充入He; C.恒容时充入X; D.及时分离出Z;
E.升高温度; F.选择高效的催化剂
(6)下列说法正确的是__________。
A.升高温度改变化学反应的限度
B.已知正反应是吸热反应,升高温度平衡向右移动,正反应速率加快,逆反应速率减慢
C.化学反应的限度与时间长短无关
D.化学反应的限度是不可能改变的
E.增大Y的浓度,正反应速率加快,逆反应速率加快,正反应速率大于道反应速率
F.加入高效催化剂可加快正、逆反应速率,化学平衡正向移动
20.(7分)某工厂的工业废水中含有大量的FeSO4、较多的Cu2+和少量的Na+。为了减少污染并变废为宝,工厂计划从该废水中回收硫酸亚铁和金属铜。请根据流程图,回答下列问题:
(1)操作Ⅰ的名称为_________,所需要的玻璃仪器有_________、玻璃棒、烧杯;
(2)加入试剂C的目的是将Cu2+全部转化为Cu,以便回收铜单质,发生的离子方程式为__________________________________;
(3)操作Ⅲ为加热浓缩、__________、过滤、洗涤、干燥;
(4)由于硫酸亚铁溶液露置于空气中容易变质,请设计一个简单的实验方案验证硫酸亚铁是否变质?(请写出必要的实验步骤、现象和结论)____________________。
21.(11分)从煤和石油中可以提炼出化工原料A和B,A是一种果实催熟剂,它的产量用来衡量一个国家的石油化工发展水平。B是一种比水轻的油状液态烃,0.1 mol该烃在足量的氧气中完全燃烧,生成0.6 mol CO2和0.3 molH2O;回答下列问题:
(1)A的电子式________,B的结构简式________。
(2)与A相邻的同系物C使溴的四氯化碳溶液褪色的化学反应方程式:____________________,反应类型:______________。
(3)在碘水中加入B物质的现象:________________________。
(4)B与浓硫酸和浓硝酸在50~60℃反应的化学反应方程式:____________________,
反应类型:______________。
(5)等质量的A、B完全燃烧时消耗O2的物质的量________(填“A>B”、“A<B”或“A=B”)。
2017-2018学年汉川二中高一下学期期末考试
化学试题参考答案
一、选择题
1
2
3
4
5
6
7
8
A
B
B
C
D
D
B
B
9
10
11
12
13
14
15
16
B
B
D
C
B
A
D
B
17. (10分)(1)
(2)CO32- + CO2 + H2O = 2HCO3-。
(3)Al(OH)3 + OH- = AlO2- + 2H2O
(4)先产生白色沉淀,迅速变为灰绿色,最终变为红褐色
(5)
18. (12分)(1)① H2S溶液变浑浊; SO2 + 2H2S = 3S↓¯ + 2H2O
② 吸收SO2,防止污染环境; SO2 + 2OH- = SO32- + H2O
③ Ba2+ + SO2 + 2NH3H2O = BaSO3↓¯ + 2NH4+ + H2O
或 Ba2+ + SO2 + Cl2 + 2H2O = BaSO4↓¯ + 2Cl- + 4H+
(2)① Na2SO3和NaHSO3② 1 : 3
19(12分)(1) 3X(g)+Y(g)2Z(g) (无可逆号不给分,无气体给1分)(2分) ;
(2) 0.05mol/(L·min)(2分)
(3)增大(1分);不变(1分)
(4) 5:3 (2分)
(5) CEF(对1给1分有错不给分)2分
(6) ACE(对1给1分有错不给分) 2分
20(7分)(1)过滤 ; 普通漏斗 (填“漏斗”也得分)
(2)Fe + Cu2+ = Fe2+ + Cu
(3)冷却结晶
(4)取少量FeSO4溶液于试管中,滴加几滴KSCN溶液,若溶液变红,则证明FeSO4溶液已变质(其它合理答案均可得分)
21(11分)
(2)CH2=CH—CH3+Br2→CH2Br—CHBr—CH3 加成反应
(3)溶液分层,下层无色,上层紫红色
(4) +H2O 取代反应
(5)A>B