- 2021-08-06 发布 |
- 37.5 KB |
- 4页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
元素周表及其应用(教案,苏教必修)
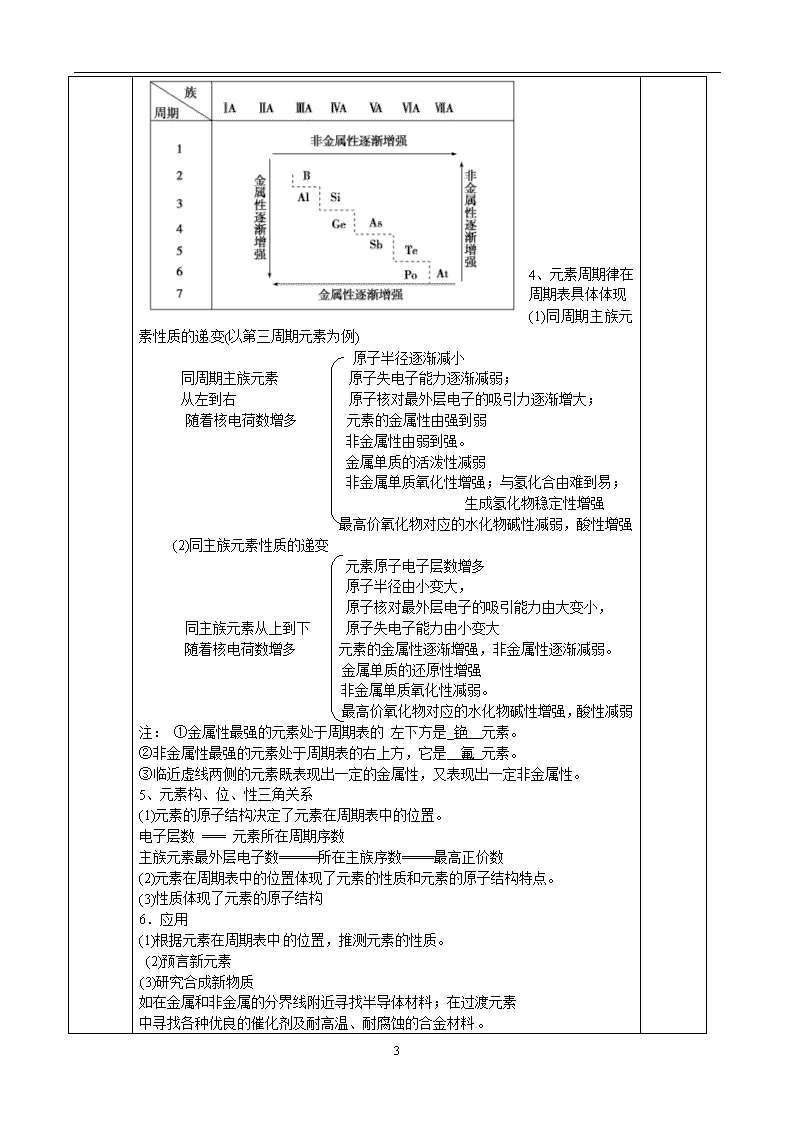
年级 组别 高一化学 审阅 (备课组长) 审阅 (学科校长) 主备人 使用人 授课时间 课 题 苏教版 化学 必修二 专题一第一单元 元素周表及其应用 课 型 新授课 课标 要求 1、知道周期与族的概念,能描述元素周期表的结构。认识元素在周期表中的位置与其原子的电子层结构的关系:元素的原子序数=元素的核电荷数=原子核内质子数=原子核外电子数;元素所在周期序数=原子核外电子层数;主族元素所在的族序数=原子核外最外层电子数=主族元素的最高正化合价数;ⅣA ~ⅦA族元素的负化合价的绝对值=8-元素最高正化合价的绝对值。 2、知道金属、非金属在元素周期表中的位置及其性质的递变规律。 3、感受元素周期律与周期表在化学学习、科学研究和生产实践中的重要作用与价值。 教 学 目 标 知识与能力 1、知道周期与族的概念,能描述元素周期表的结构,了解元素周期表的编排原则。 2、认识元素在周期表中的位置与其原子的电子层结构的关系 3、知道金属、非金属在元素周期表中的位置及其性质的递变规律,初步了解元素周期表与元素周期律的关系 过程与方法 情感、态度与价值观 感受元素周期律与周期表在化学学习、科学研究和生产实践中的重要作用与价值 教学 重点 学习掌握元素周期表的结构 教学 难点 学习掌握元素周期表的结构 教学 方法 三学一教 四步教学法 教学程序设计 教 学 过 程 及 方 法 环节一 明标自学 过程设计 二次备课 1、知道周期与族的概念,能描述元素周期表的结构,了解元素周期表的编排原则。 2、认识元素在周期表中的位置与其原子的电子层结构的关系 3、知道金属、非金属在元素周期表中的位置及其性质的递变规律,初步了解元素周期表与元素周期律的关系 教 环节二 合作释疑 环节三 点拨拓展 (备注:合作释疑和点拨拓展可以按照顺序先后进行,也可以根据教学设计交叉进行设计) 4 学 过 程 及 方 法 过程设计 二次备课 元素周期表是元素周期律的具体表现形式,直观反映出元素的原子结构及元素性质随元素原子核电荷数的递增所呈现出的周期性变化规律,是我们学习化学的重要工具,下面我们来学习元素周期表的有关知识。本节课重点解决二个问题 (1)周期表的编排原则 (2) 元素周期表的结构(概 况) 元素周期表的结构 1、编排原则 把电子层数相同的元素按原子序数由小到大从左到右排列成一个横行(得许多个横行) ,再把不同横行中的元素原子最外层电子数相同的元素按电子层数由小到大从上至下排成一个纵行 2、认识元素周期表--------结构 第1周期 2种 2 3个短周期 第2周期 8种 10 第3周期 8种 18 7个周期 3个长周期 第4周期 18种 36 第5周期 18种 54 第6周期 32种 86 1个不完全周期 第7周期 26种未填满 周期表 7个主族-(第1, 2, 13, 14, 15, 16, 17) IA----------VIIA) 7个副族----(第3~7, 11, 12) (IIIB---VIIB IB IIB) 16个族 1个O族--------------------第18行 1个第VIII族--------------第-8,9,10行 注:由长周期元素和短周期元素共同构成的族叫主族 ⅢB族元素种类最多,共有32种;第6周期元素种类最多,共有32种。 ⅡA族全部是金属元素,ⅦA族全部是非金属元素。 3.金属元素和非金属元素的分区-------------------分界线 4 4、元素周期律在周期表具体体现 (1)同周期主族元素性质的递变(以第三周期元素为例) 原子半径逐渐减小 同周期主族元素 原子失电子能力逐渐减弱; 从左到右 原子核对最外层电子的吸引力逐渐增大; 随着核电荷数增多 元素的金属性由强到弱 非金属性由弱到强。 金属单质的活泼性减弱 非金属单质氧化性增强;与氢化合由难到易; 生成氢化物稳定性增强 最高价氧化物对应的水化物碱性减弱,酸性增强 (2)同主族元素性质的递变 元素原子电子层数增多 原子半径由小变大, 原子核对最外层电子的吸引能力由大变小, 同主族元素从上到下 原子失电子能力由小变大 随着核电荷数增多 元素的金属性逐渐增强,非金属性逐渐减弱。 金属单质的还原性增强 非金属单质氧化性减弱。 最高价氧化物对应的水化物碱性增强,酸性减弱 注: ①金属性最强的元素处于周期表的 左下方是_铯 元素。 ②非金属性最强的元素处于周期表的右上方,它是 氟 元素。 ③临近虚线两侧的元素既表现出一定的金属性,又表现出一定非金属性。 5、元素构、位、性三角关系 (1)元素的原子结构决定了元素在周期表中的位置。 电子层数 === 元素所在周期序数 主族元素最外层电子数=====所在主族序数====最高正价数 (2)元素在周期表中的位置体现了元素的性质和元素的原子结构特点。 (3)性质体现了元素的原子结构 6.应用 (1)根据元素在周期表中的位置,推测元素的性质。 (2)预言新元素 (3)研究合成新物质 如在金属和非金属的分界线附近寻找半导体材料;在过渡元素 中寻找各种优良的催化剂及耐高温、耐腐蚀的合金材料。 4 教 学 过 程 及 方 法 环节四 当堂检测 二次备课 例1 已知某元素原子序数为16 请推测该元素在周期表中的位置,是何种元素?最高正价是多少?写出其最高价氧化物对应水化物的分子式(构----位推断) 法一:原子结构示意图法 3个电子电子层:第3周期 最外层6个电子 第六主族 表示符号为:VIA 硫 +6 H2SO4 思路:当最外3-----7个电子时定为主族且和主族序数相对应 法二:元素核电荷数法 某元素原子序数依次减去各周期元素种类数或惰性元素原子序数推位置 16 – 2 – 8 = 6 第1周期 第2周期 第3周期 思路:前3周期 差值==1---7 IA------VIIA 第4、5、6周期 差值==1,2 IA,IIA 13-----17 –10 = 3, 4, 5, 6, 7 第IIIA IVA VA VIA VIIA 练习:53号元素,88号元素分别在周期表中的位置 (第5周期第ⅦA族;第7周期第ⅡA族。) 例2、下列排列顺序,错误的是---------------------------------------------------( ) A.原子半径:O查看更多
相关文章
- 当前文档收益归属上传用户