- 2021-08-06 发布 |
- 37.5 KB |
- 7页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2017-2018学年山东省新泰二中高一上学期第一次月考化学试卷
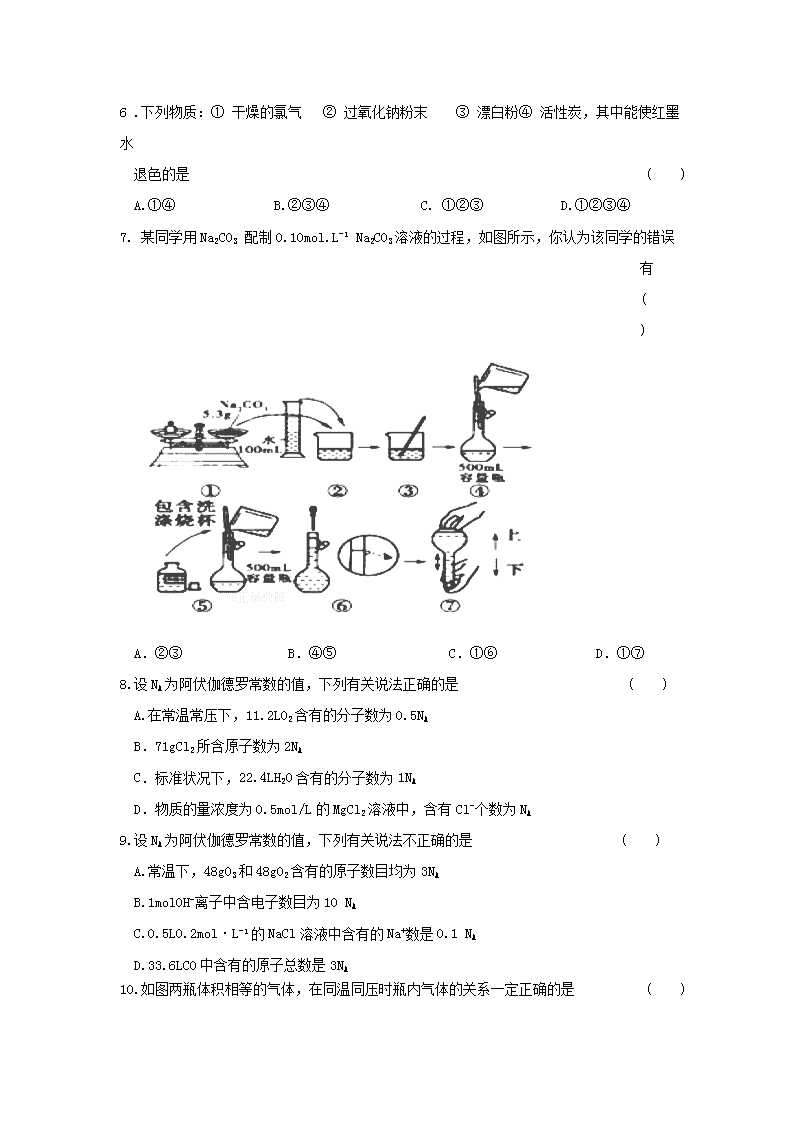
2017-2018学年山东省新泰二中高一上学期第一次月考化学试卷 2017.10 可能用到的相对原子质量:H--1 O--16 S—32 Cu--64 Na—23 C--12 Fe--56 Mg—24 N--14 K--39 第I卷(选择题 共60分) 一、选择题(本题共20小题,每小题只有一个选项,每小题3分,共60分) 1.下面是人们对于化学科学的各种常见认识,其中正确的是 ( ) A.实验是认知化学的唯一手段 B.化学是一门具有较强实用性的科学 C.化学支持高新技术的快速发展,但面对伪科学和人体健康等问题却显得无能为力 D.分子是化学变化中的最小微粒 2.下列说法中不正确的是 ( ) ① 钠、氢气都能在氯气中燃烧生成白色烟雾 ② 铜丝在氯气中燃烧,生成蓝绿色的氯化铜 ③ 液氯就是氯气的水溶液,它能使干燥的有色布条退色 ④ 久置的氯水,因氯气几乎完全挥发掉,剩下的只有水 A.① B. ①② C. ①④ D.①②③④ 3. 下面关于金属钠的描述中不正确的是 ( ) A.钠的化学性质很活泼,在自然界里不能以单质形式存在 B.钠是电和热的良导体 C.将一块钠放置在空气中最终会变成NaOH D.钠钾的合金于室温下呈液态,可作原子反应堆的导热剂 4. 可以用氯气灌洞的方法来消灭田鼠,这是利用了氯气的哪些性质 ( ) ① 密度比空气的大 ② 易液化 ③ 能溶于水 ④ 有毒 A.①④ B.①② C.③④ D.①③④ 5. 下列说法中不正确的是 ( ) A.Na2O2可用作呼吸面具中氧气的来源 B.Na2O 和Na2O2投入水中都能生成NaOH C.Na2O2和Na2O 均可以露置在空气中保存 D.NaCl的性质稳定,可用作调味品 6 .下列物质:① 干燥的氯气 ② 过氧化钠粉末 ③ 漂白粉④ 活性炭,其中能使红墨水 退色的是 ( ) A.①④ B.②③④ C. ①②③ D.①②③④ 7. 某同学用Na2CO3 配制0.10mol.L-1 Na2CO3溶液的过程,如图所示,你认为该同学的错误有 ( ) A.②③ B.④⑤ C.①⑥ D.①⑦ 8.设NA为阿伏伽德罗常数的值,下列有关说法正确的是 ( ) A.在常温常压下,11.2LO2含有的分子数为0.5NA B.71gCl2所含原子数为2NA C.标准状况下,22.4LH2O含有的分子数为1NA D.物质的量浓度为0.5mol/L的MgCl2溶液中,含有Cl-个数为NA 9.设NA为阿伏伽德罗常数的值,下列有关说法不正确的是 ( ) A.常温下,48gO3和48gO2含有的原子数目均为3NA B.1molOH-离子中含电子数目为10 NA C.0.5L0.2mol·L-1的NaCl溶液中含有的Na+数是0.1 NA D.33.6LCO中含有的原子总数是3NA 10.如图两瓶体积相等的气体,在同温同压时瓶内气体的关系一定正确的是 ( ) A.所含原子数相等 B.气体密度相等 C.气体质量相等 D.摩尔质量相等 11.下列溶液中阴离子浓度最大的是 ( ) A.0.5 mol.L-1HNO3溶液50mL B.0.6mol.L-1A12(SO4)3溶液35 mL C.1.8mol.L-1NaCl溶液70ml D. 0.7mol.L-1 FeC13溶液60 mL 12.为配制0.01mol.L-1 的KMn04 消毒液,下列操作导致所配溶液浓度偏高的是 ( ) A.溶解搅拌时有液体飞溅 B.取KMnO4样品时不慎在表面沾了点蒸馏水 C.定容时俯视容量瓶刻度线 D.定容摇匀后见液面下降,再加水至刻度线 13.将钠、镁、铝0.3mol分别放入100 mL 1mol.L-1 的盐酸中,在同温、同压下产生的气体体积比是 ( ) A.3:1:1 B.6:3:2 C. 1:2:3 D. 1:1:1 14.同温、同压下等质量的SO2气体和CO2气体,下列有关比较的叙述中,正确的是 ( ) ①分子数比为11∶16 ②密度比为11∶16 ③体积比为16∶11 ④原子个数比为11∶16 A. ①③ B. ①④ C. ②③ D. ②④ 15.下列说法中正确的是 ( ) A.1mol 任何气体的体积都约是22.4L B.lmolH2和O2的混合气体,在标准状况下的体积也是22.4L C.lmol H2气态物质,当体积为22.4L 时,该气体一定处于标准状 D.2mol 气体体积约为44.8L 16.如图所示,A处通入干燥的Cl2,打开B阀后,C处的红布条逐渐褪色,关闭B阀时,C处的红布条看不到明显现象,则D瓶中装的是 ( ) A.浓硫酸 B.NaOH溶液 C.浓盐酸 D.饱和NaCl溶液 17. 己知3.01×1023个X 气体分子的质量为16g,则X气体的摩尔质量是 ( ) A.16g B.32g C.64g.mol-1 D.32g.mol-1 18. 在一定温度下,向饱和烧碱溶液中加入一定量的过氧化钠,充分反应后恢复到原温度,下列说法正确的是 ( ) A.溶液中有晶体析出,Na+ 数目不变 B.溶液中有气体逸出,Na+ 数目增加 C.溶质的质量分数增大 D.溶液中Na+ 数目减少,溶质质量分数未变 19.下列各组物质中分子数相同的是 ( ) A.2LCO和2LCO2 B.9gH2O和标准状况下11.2LCO2 C.标准状况下1molO2和22.4LH2O D.0.2molH2和4.48LHCl气体 20.在一定温度、压强下,1体积X2气体和3体积Y2气体化合生成2体积的气体化合物,则该气体化合物的化学式为 ( ) A.XY3 B.XY C.X3Y D.X2Y3 第II卷(非选择题 共40分) 二、 填空题 21.(14分)回答下列问题: (1)在①②③④处的横线上填写适当的内容。 (2)在质量分数为28%的KOH水溶液中,K+与H2O的数目之比是 (3)2 mol O3和3 mol O2的质量之比为 (4)在标准状况下,体积为8.96 L的CO和CO2的混合气体共14.4 g。 ①CO的质量为g。 ②CO的体积为L。 ③在标准状况下,该混合气体中,碳与氧两种原子的数目之比为 22. ( 14 分)目前,世界上多采用电解熔融氯化钠的方法来生产金属 钠:2NaCl(熔融)2Na + Cl2 。己知物质A 、B 、C、D 、E 、F 有如下图所小转化关系: (1)试根据上述变.化写出A 、B 、C 、D 、E 、F 的化学式: A___________________,B____________________,C ________________________, D____________________,E ___________________,F_________________________. (2)请写出A→C 以及B →D 两个反应的化学方程式。 ① A → C ___________________________________________________, ② B →D ____________________________________________________. (3)过氧化钠可用作制氧剂,写出过氧化钠与二氧化碳反应的化学方程式:_______________________________________________________. (4)工业上制取漂白粉的化学方程式:_______________________________________________________. 23. ( 12 分)某同学欲配制480 mL 物质的量浓度为0.1mol.L-1的CuSO4溶液。 (1)完成该实验用到的仪器主要有:托盘天平、胶头滴管、____________________,烧杯、玻璃棒、药匙。 (2)如果用CuSO4固体来配制,应该称量固体的质量为_________________。 如果用CuSO4.5H2O来配制,应该称量固体的质量为____________________。 (3)写出整个实验简单的操作过程:计算→__________________→溶解→转移→洗涤→_____________________→摇匀。 (4) 定容时的正确操作是:待容量瓶中的液体液面距离容量瓶的刻度线1 ~2 cm时,改用______________滴加,并且目光要平视刻度线,至____________________________________,定容完成。 (5)下列操作对溶液的浓度有何影响?用“偏大”“偏小”或“无影响”填空。 ① 配制的过程中有少量的液体溅出烧杯。 ( ) ② 使用前容量瓶用蒸馏水洗涤,且没有干燥。 ( ) ③ 定容时俯视液面。 ( ) 2017级高一上学期第一次月考 化学试题参考答案 1-5、BDCAC 6-10、DCBDA 11-16、DCABB 16-20、BDDBA 21. (1)①9.03×1023(或1.5NA) ②1.5mol ③1.5 ④3(每空1分) (2)1:8 (2分) (3) 1:1(2分) (4)①5.6(2分) ②4.48(2分) ③2:3(2分) 22..(1)Na Cl2 NaOH FeCl3 Na2CO3 CaCl2(每空1分) (2) ①2Na+2H2O=2 NaOH+H2↑ ②2Fe+3Cl2 2FeCl3 ③2Na2O2 +2CO2=2Na2CO3+O2↑ ④2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O(每空2分) 23. (1)500mL容量瓶(1分) (2)8.0g 12.5g(每空2分) (3)称量定容(每空1分) (4)胶头滴管凹液面的最低处与刻度线相切(每空1分) (5)①偏小②无影响③偏大(每空1分)查看更多