- 2021-08-06 发布 |
- 37.5 KB |
- 9页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
化学卷·2018届黑龙江省牡丹江市一中高二上学期期末考试(2017
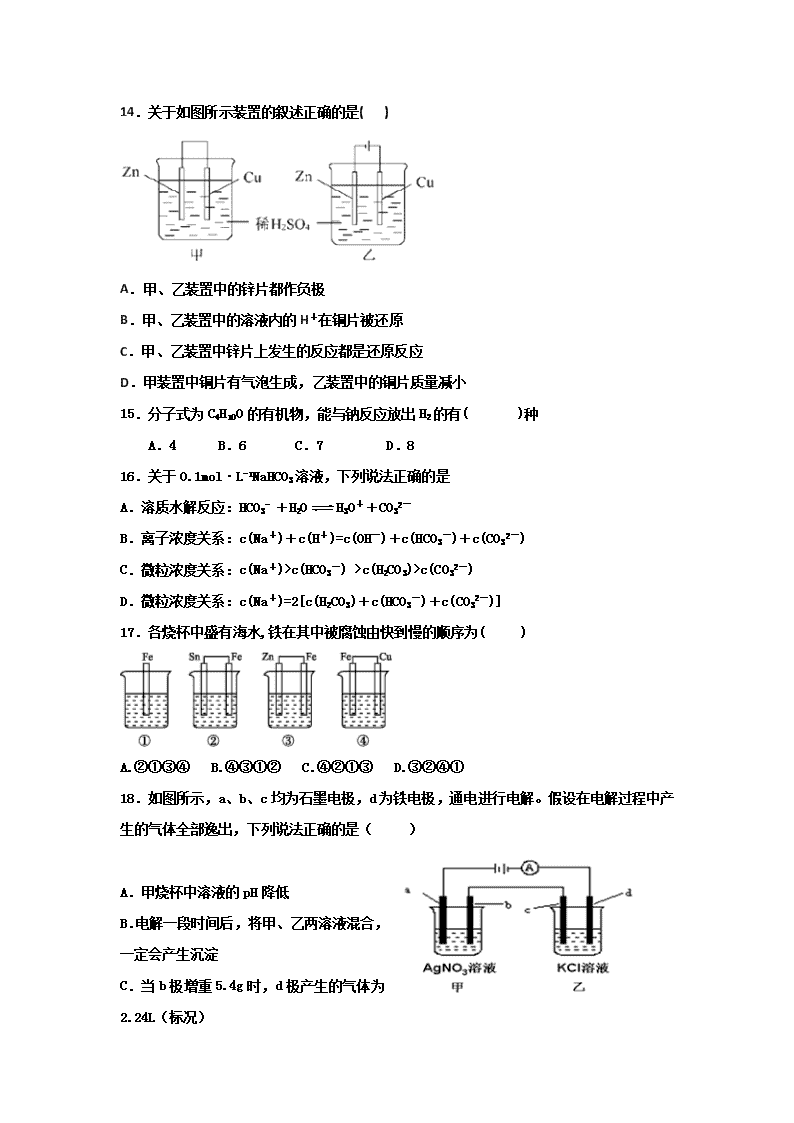
高二学年期末考试化学试卷 可能用到的原子量:H :1 O:16 C:12 N:14 Cu:64 一、选择题(每小题只有一个正确选项,1-15题每题2分,16-23题每题3分,共计54分) 1.下列不属于有机高分子化合物的是( ) A.油脂 B.蛋白质 C.淀粉 D.纤维素 2.下列电离方程式书写正确的是( ) A.H2S2H++S2- B.H2S + H2OH3O++HS- C.HCl H+ + Cl- D. HClO=====H++ClO- 3.下列物质中能抑制水的电离且使溶液呈现出酸性的是 A.Na2CO3 B.Al2(SO4)3 C.K2SO4 D.H2SO4 4.下列装置中能构成原电池产生电流的是( ) 5.关于电解NaCl水溶液,下列叙述正确的是 A.若在阴极附近的溶液中滴入酚酞试液,溶液呈无色 B.若在阳极附近的溶液中滴入KI溶液,溶液呈棕黄色 C.电解时在阳极得到氯气,在阴极得到金属钠 D.电解一段时间后,将全部电解液转移到烧杯中,充分搅拌后溶液呈中性 6.下列有关金属腐蚀与防护的说法不正确的是( ) A.纯银器的表面在空气中因化学腐蚀渐渐变暗 B.当镀锡铁制品的镀层破损时,镀层不能对铁制品起保护作用 C.在海轮外壳连接锌块保护外壳不受腐蚀是采用了牺牲阳极的阴极保护法 D.可将地下输油钢管与外加直流电源的正极相连以保护它不受腐蚀 7.下列有关实验及现象、原理的描述正确的是 A.光照条件下,甲烷通入氯水中,发生了取代反应使黄绿色变浅 B.乙烯能使酸性高锰酸钾溶液褪色,也能使溴水褪色,两者反应原理一样 C.乙醛与新制氢氧化铜溶液混合好后,加热,得到砖红色沉淀 D.将一小粒钠投入盛有无水乙醇的小烧杯中,有气泡产生,比钠在水中的反应更剧烈 8.下列说法正确是 A.糖类、油脂、蛋白质完全燃烧只生成CO2和H2O B.丁烷(C4H10)和二氯甲烷都存在同分异构体 C.向溴水中加入苯,振荡静置后观察下层几乎无色 D.汽油、柴油、植物油都是碳氢化合物 9.能证明氢氟酸是弱酸的实验事实是 A.HF溶液与Zn反应放出H2 B.0.1mol/LNaF溶液的pH大于7 C.HF溶液与Na2CO3反应生成CO2 D.0.1mol/LHF溶液可使紫色石蕊变红 10.在0.1 mol·L-1 CH3COOH溶液中存在如下电离平衡: CH3COOHCH3COO-+H+对于该平衡,下列叙述正确的是( ) A.加入水时,平衡向逆反应方向移动 B.加入少量NaOH固体,平衡向正反应方向移动 C.加入少量0.1 mol·L-1 HCl溶液,溶液中c(H+)减小 D.加入少量CH3COONa固体,平衡向正反应方向移动 11.关于铅蓄电池Pb+PbO2+2H2SO4PbSO4+2H2O的说法正确的是 A.在放电时,正极发生的反应是Pb(s)+SO42—(aq)=PbSO4(s)+2e— B.在放电时,该电池的负极材料是铅板 C.在充电时,电池中硫酸的浓度不断变小 D.在充电时,阳极发生的反应是PbSO4(s)+2e—=Pb(s)+SO42—(aq) 12.把0.05molNaOH固体分別加入下列100mL溶液中,溶液的导电能力变化不大的是 A.自来水 B.0.5 mol·L-1KOH 溶液 C.0.5 mol·L-1醋酸 D.0.5 mol·L-1NH4Cl溶液 13.下列对沉淀溶解平衡的描述正确的是( ) A.反应开始时,溶液中各离子浓度相等 B.沉淀溶解达到平衡时,沉淀的速率和溶解的速率相等 C.沉淀溶解达到平衡时,溶液中溶质的离子浓度相等,且保持不变 D.沉淀溶解达到平衡时,如果再加入难溶性的该沉淀物,将促进溶解 14.关于如图所示装置的叙述正确的是( ) A.甲、乙装置中的锌片都作负极 B.甲、乙装置中的溶液内的H+在铜片被还原 C.甲、乙装置中锌片上发生的反应都是还原反应 D.甲装置中铜片有气泡生成,乙装置中的铜片质量减小 15.分子式为C4H10O的有机物,能与钠反应放出H2的有( )种 A.4 B.6 C.7 D.8 16.关于0.1mol·L-1NaHCO3溶液,下列说法正确的是 A.溶质水解反应:HCO3- +H2OH3O++CO32- B.离子浓度关系:c(Na+)+c(H+)=c(OH-)+c(HCO3-)+c(CO32-) C.微粒浓度关系:c(Na+)>c(HCO3-) >c(H2CO3)>c(CO32-) D.微粒浓度关系:c(Na+)=2[c(H2CO3)+c(HCO3-)+c(CO32-)] 17.各烧杯中盛有海水,铁在其中被腐蚀由快到慢的顺序为( ) A.②①③④ B.④③①② C.④②①③ D.③②④① 18.如图所示,a、b、c均为石墨电极,d为铁电极,通电进行电解。假设在电解过程中产生的气体全部逸出,下列说法正确的是( ) A.甲烧杯中溶液的pH降低 B.电解一段时间后,将甲、乙两溶液混合,一定会产生沉淀 C.当b极增重5.4g时,d极产生的气体为2.24L(标况) D.乙烧杯中的d电极反应式为Fe-2e-=Fe2+ 19.下列各组中的反应,属于同一反应类型的是( ) A.溴丙烷和氢氧化钠溶液反应制丙醇;丙烯与水反应制丙醇 B.甲苯硝化制对硝基甲苯;甲苯和高锰酸钾反应制苯甲酸 C.1—氯环己烷制环己烯;丙烯与溴反应制1,2—二溴丙烷 D.苯甲酸乙酯水解制苯甲酸和乙醇;乙酸和乙醇制乙酸乙酯 20.下列有关问题,与盐的水解有关的是( ) ①NH4Cl与ZnCl2溶液可作焊接金属中的除锈剂 ②用NaHCO3与Al2(SO4)3两种溶液可作泡沫灭火剂 ③草木灰与铵态氮肥不能混合施用 ④实验室盛放碳酸钠溶液的试剂瓶不能用磨口玻璃塞 ⑤加热蒸干AlCl3溶液得到Al(OH)3固体 ⑥HF水溶液不能用玻璃试剂瓶盛装 A.①②③ B.②③④ C.①②③④⑤ D.①②③④⑤⑥ 21.下图有关电化学的示意图正确的是 22.从葡萄籽中提取的原花青素结构为: 有关原花青素的下列说法不正确的( ) A.该物质既可看作醇类,也可看作酚类 B.1mol该物质可与4mol Br2反应 C.1mol该物质可与7mol Na反应 D.1mol该物质可与7mol NaOH反应 23.下列八种物质:①丙烯、②甲苯、③聚氯乙烯、④乙醇、⑤丙炔、⑥乙酸乙酯、⑦环己烯、⑧溴乙烷中既能使酸性高锰酸钾溶液褪色,又能使溴水因反应而褪色的是( ) A.①③④⑤⑦ B.②④⑤⑦ C.④⑤ D.①⑤⑦ 二、填空题 24.(10分)依据反应:2Ag+(aq)+Cu(s)=Cu2+ (aq)+2Ag(s)设计的原电池如下图所示。 请回答下列问题: (1)电极X的材料是___________,电解质溶液Y是___________; (2)银电极为电池的___________极,发生的电极反应为___________;X电极上发生的电极反应为___________。 (3)外电路中的电子是从___________电极流向_________电极。 (4)硫酸铜溶液PH<7的原因是 (用离子方程式解释) 25.(8分)苹果醋(ACV)是一种由苹果发酵而成的酸性饮品,具有解毒、降脂等药效。苹果醋是一种常见的有机酸,其结构简式为。 (1)苹果醋中含有的官能团的名称是________、_____________。 (2)苹果醋的分子式为__________________。 (3)1 mol苹果醋与足量金属钠反应,能生成标准状况下的氢气________L。 (4)苹果醋可能发生的反应是________。 A.与NaOH溶液反应 B.与石蕊溶液作用 C.与乙酸在一定条件下酯化 D.与乙醇在一定条件下酯化 26.(4分)糖类、油脂、蛋白质都是人体必需的营养物质.请回答: (1).下列物质中①葡萄糖②麦芽糖③蔗糖④纤维素⑤淀粉,互为同分异构体的是 ;具有还原性,能发生银镜反应的是 .(填序号) (2)油脂在酸性环境下的水解产物为 (写名称) (3)向蛋白质溶液中加入饱和(NH4)2SO4溶液可使蛋白质 (填“盐析”或“变性”). 27.(12分)某化学小组采用类似制乙酸乙酯的装置(如图1),以环己醇制备环己烯 已知: 密度(g/cm3) 熔点(℃) 沸点(℃) 溶解性 环己醇 0.96 25 161 能溶于水 环己烯 0.81 ﹣103 83 难溶于水 (1)制备粗品将12. 5mL环己醇加入试管A中,再加入1mL浓硫酸,摇匀后放入碎瓷片,缓慢加热至反应完全,在试管C内得到环己烯粗品. ①A中碎瓷片的作用是 ,导管B除了导气外还具有的作用是 ②试管C置于冰水浴中的目的是 . (2)制备精品 ①环己烯粗品中含有环己醇和少量酸性杂质等.加入饱和食盐水,振荡、静置、分层,环己烯在 层(填上或下),分液后用 (填入编号)洗涤. a.KMnO4溶液 b.稀H2SO4 c.Na2CO3溶液 ②再将环己烯按图2所示装置蒸馏,冷却水从 口进入,目的是 ③收集产品时,控制的温度应在 左右,实验制得的环己烯精品质量低于理论产量,可能的原因是 a.蒸馏时从70℃开始收集产品 b.环己醇实际用量多了 c.制备粗品时环己醇随产品一起蒸出 (3)以下区分环己烯精品和粗品的方法,合理的是 . a.用酸性高锰酸钾溶液 b.用金属钠 c.测定沸点. 28.(12分)如右图所示,p、q为直流电源的两极,A由金属单质X制成,B、C、D为铂电极,接通电源,金属X沉积于B极,同时C、D上产生气泡,试回答: (1)p为________极,A极发生了_____ ___反应。 (2)C为________极,可收集到_____ ___; D为____ ____极,可收集到___ _ ____。 (3)C极的电极反应式为________________________________________________。 (4)在电解过程中,测C、D两极上产生气体的体积,实验数据如下表: 时间(min) 1 2 3 4 5 6 7 8 9 10 阴极产生气体的体积(cm3) 6 12 20 29 39 49 59 69 79 89 阳极产生气体的体积(cm3) 2 4 7 11 16 21 26 31 36 41 仔细分析以上实验数据,请说出变化的可能原因是 _______________________________________________________________________。 (5) 当电路中通过0.004 mol电子时,B极上沉积的金属X为0.128 g,则此金属的摩尔质量为____________ 高二学年期末考试化学答案 一、选择题(54分) 1 2 3 4 5 6 7 8 9 10 11 12 A B D B B D C C B B B D 13 14 15 16 17 18 19 20 21 22 23 B D A C C A D C D D D 二、填空题(46分) 24. (10分) 【答案】(1)Cu;AgNO3溶液 (2)正;Ag++e-=Ag;(2分)Cu-2e-=Cu2+(2分) (3)X(Cu);Ag (4)Cu2+ + 2H2O Cu(OH)2 + 2H+ (其余每空1分) 25.(8分)(1)羟基、羧基 (2)C4H6O5 (3)33.6 (4)ABCD(每小题2分) 26、(4分)②③; ①②. 高级脂肪酸、甘油 盐析(每空1分) 27、(12分) (1)①防止暴沸, 冷凝. ②进一步冷却,防止环己烯挥发. (2) ①上层 ,c ②g口,冷却水与气体形成逆流,冷凝效果更好;更容易将冷凝管充满水;以防蒸汽入口处骤冷骤热使冷凝管破裂.(答对一点就给2分)③83℃,c (3)bc.(2分) (除标注外,均1分) 28.(12分) (1)正 氧化 (2)阳 氧气 阴 氢气 (各1分) (3)4OH--4e-===O2↑+2H2O(2分) (4)在开始反应的1~4 min内,由于生成的氧气和氢气在水中的溶解没有达到饱和,氧气的溶解度大于氢气,故氢气和氧气的体积比大于2∶1;随着反应的进行,到4 min后,由于生成的氧气和氢气在水中的溶解均达到饱和,故体积比约等于2∶1 (2分) (5) 64 g/mol (2分)查看更多