- 2021-08-06 发布 |
- 37.5 KB |
- 11页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020年高一化学人教版必修1练习 (24)
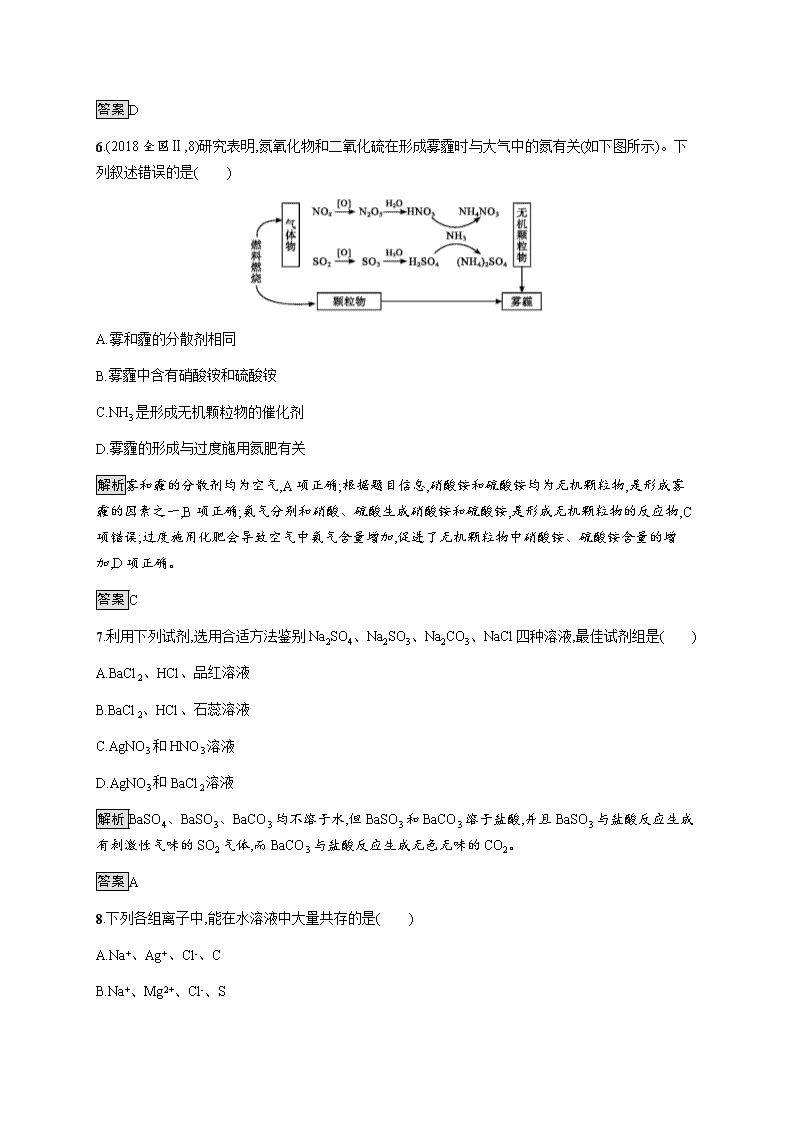
第四章测评 (时间:90分钟 满分:100分) 可能用到的相对原子质量:H—1 O—16 S—32 Ba—137 一、选择题(本题包括12小题,每小题4分,共48分。每小题只有1个选项符合题意) 1.下列叙述正确的是( ) A.SO2具有还原性,故可作漂白剂 B.Na的金属活动性比Mg强,故可用Na与MgCl2溶液反应制Mg C.浓硝酸中HNO3见光会分解,故有时在实验室看到的浓硝酸呈黄色 D.Fe在Cl2中燃烧生成FeCl3,故在与其他非金属反应的产物中的Fe也显+3价 解析A项,SO2可作漂白剂是因为SO2可与有色物质结合成不稳定的无色物质,并不是因其具有还原性;B项,金属单质Mg的制取应用电解法;D项,Fe与强氧化剂反应得到的产物中铁元素显+3价,与弱氧化剂反应得到的产物中铁元素显+2价,如Fe与S反应生成FeS。 答案C 2.下列有关氨水和氯水的说法正确的是( ) A.含有的物质种类相同 B.敞口放置后溶液的pH均可能减小 C.都能与SO2发生氧化还原反应 D.均具有强氧化性 解析氨水中含有NH3、H2O、NH3·H2O、H+、OH-、N,氯水中含有Cl2、H2O、HClO、H+、Cl-、ClO-、OH-,A项错误;敞口放置后氯水逐渐变成盐酸,酸性增强,pH减小;氨水中的氨挥发,碱性减弱,pH减小,B项正确;氨水中NH3·H2O与SO2发生复分解反应,氯水中Cl2与SO2发生氧化还原反应,C项错误;氨水不具有强氧化性,D项错误。 答案B 3.下列实验过程中,始终无明显现象的是( ) A.NO2通入FeSO4溶液中 B.CO2通入CaCl2溶液中 C.NH3通入AlCl3溶液中 D.SO2通入已酸化的Ba(NO3)2溶液中 解析A选项,NO2溶于水生成硝酸,具有强氧化性,能将Fe2+氧化成Fe3+(棕黄色)同时放出无色气体NO,NO遇空气变红棕色;B选项,CO2与CaCl2反应,无明显现象;NH3溶于水生成NH3·H2O,与Al3+作用产生Al(OH)3沉淀;在酸性条件下,N具有强氧化性,能将SO2氧化成S,S与Ba2+结合产生BaSO4白色沉淀。 答案B 4.下列说法正确的是( ) A.工业上用氯气与澄清石灰水反应制取漂白粉 B.氯气能与铁反应,所以液氯不宜贮存在钢瓶中 C.漂白粉露置于空气中会变质 D.工业上利用冷却结晶法提取海水中的食盐 解析漂白粉是用氯气与石灰乳(或石灰浆)反应制取,A项错误;常温下,氯气与铁不反应,故可用钢瓶贮存液氯,B项错误;漂白粉中的Ca(ClO)2能与空气中的CO2反应生成HClO,HClO不稳定易分解,因此漂白粉露置在空气中易变质,C项正确;NaCl的溶解度受温度影响变化不大,应采用蒸发结晶方法,D项错误。 答案C 5.下列实验中金属或氧化物可以完全溶解的是( ) A.1 mol Cu与含2 mol H2SO4的浓硫酸共热 B.1 mol MnO2与含2 mol H2O2的溶液共热 C.常温下1 mol Al投入足量的浓硫酸中 D.常温下1 mol Cu投入含4 mol HNO3的浓硝酸中 解析A中随着反应的进行浓硫酸逐渐变为稀硫酸,稀硫酸不与铜反应,根据Cu+2H2SO4(浓)CuSO4+SO2↑+2H2O,Cu不能完全溶解;B中MnO2作催化剂;C中铝会钝化;D中随着反应的进行浓硝酸逐渐变为稀硝酸,但稀硝酸也与铜反应,依Cu+4HNO3(浓)Cu(NO3)2+2H2O+2NO2↑、3Cu+8HNO3(稀)3Cu(NO3)2+4H2O+2NO↑,可知Cu可以完全溶解。 答案D 6.(2018全国Ⅱ,8)研究表明,氮氧化物和二氧化硫在形成雾霾时与大气中的氮有关(如下图所示)。下列叙述错误的是( ) A.雾和霾的分散剂相同 B.雾霾中含有硝酸铵和硫酸铵 C.NH3是形成无机颗粒物的催化剂 D.雾霾的形成与过度施用氮肥有关 解析雾和霾的分散剂均为空气,A项正确;根据题目信息,硝酸铵和硫酸铵均为无机颗粒物,是形成雾霾的因素之一,B项正确;氨气分别和硝酸、硫酸生成硝酸铵和硫酸铵,是形成无机颗粒物的反应物,C项错误;过度施用化肥会导致空气中氨气含量增加,促进了无机颗粒物中硝酸铵、硫酸铵含量的增加,D项正确。 答案C 7.利用下列试剂,选用合适方法鉴别Na2SO4、Na2SO3、Na2CO3、NaCl四种溶液,最佳试剂组是( ) A.BaCl2、HCl、品红溶液 B.BaCl2、HCl、石蕊溶液 C.AgNO3和HNO3溶液 D.AgNO3和BaCl2溶液 解析BaSO4、BaSO3、BaCO3均不溶于水,但BaSO3和BaCO3溶于盐酸,并且BaSO3与盐酸反应生成有刺激性气味的SO2气体,而BaCO3与盐酸反应生成无色无味的CO2。 答案A 8.下列各组离子中,能在水溶液中大量共存的是( ) A.Na+、Ag+、Cl-、C B.Na+、Mg2+、Cl-、S C.Fe3+、K+、S、OH- D.Fe2+、H+、S、N 解析Ag+与Cl-、C可以形成AgCl沉淀、Ag2CO3沉淀,该组离子不能在溶液中大量共存,A项错误;Na+、Mg2+、Cl-、S离子间既不能形成沉淀也无气体或水产生,该组离子可以在溶液中大量共存,B项正确;Fe3+与OH-可以形成Fe(OH)3沉淀,该组离子不能在溶液中大量共存,C项错误;酸性条件下N与Fe2+发生氧化还原反应而不能大量共存,D项错误。 答案B 9.如图装置,将溶液A逐滴加入固体B中,下列叙述正确的是( ) A.若A为浓盐酸,B为MnO2,C中盛品红溶液,则C中溶液褪色 B.若A为醋酸,B为贝壳,C中盛过量澄清石灰水,则C中溶液变浑浊 C.若A为浓氨水,B为生石灰,C中盛AlCl3溶液,则C中先产生白色沉淀后沉淀又溶解 D.若A为浓硫酸,B为Na2SO3固体,C中盛石蕊溶液,则C中溶液先变红后褪色 解析浓盐酸与MnO2反应需要加热,A项错误;Al(OH)3不与弱碱性的氨水反应,C项错误;SO2具有漂白性,但不能使石蕊溶液褪色,D项错误。 答案B 10.下列实验“操作和现象”与“结论”对应关系正确的是( ) 选项 实验操作和现象 实验结论 A 向某溶液中加入氯化钡溶液,有白色沉淀生成,再加盐酸酸化,沉淀不溶解 该溶液中一定含有S B 向某溶液中同时加入几滴KSCN溶液和少量新制的氯水,溶液变为红色 该溶液中一定含有Fe2+ C 向某溶液中加入稀盐酸,产生能使澄清石灰水变浑浊的无色气体 该溶液中一定含有C D 向某溶液加入NaOH溶液并微热,产生能够使湿润的红色石蕊试纸变蓝的无色气体 该溶液中一定含有N 解析向某溶液中先加入氯化钡溶液,再加盐酸,有白色沉淀生成,溶液中含有S或银离子中的至少一种,A项错误;向某溶液中同时加入几滴KSCN溶液和少量新制的氯水,溶液变为红色,也可能是原溶液中含有Fe3+,B项错误;向某溶液中加入盐酸,将产生的气体通入澄清石灰水,二氧化硫和二氧化碳均可以使石灰水变浑浊,说明溶液中可能有碳酸盐、碳酸氢盐、亚硫酸盐或亚硫酸氢盐中的一种或几种,C项错误;向某溶液中加入氢氧化钠,产生能使湿润的红色石蕊试纸变蓝的气体即为氨气,则证明该溶液含有铵根离子,D项正确。 答案D 11.下列说法不正确的是( ) A.活性炭、SO2、Na2O2都能使品红溶液褪色,但原理不同 B.非金属氧化物不一定是酸性氧化物,金属氧化物多数是碱性氧化物 C.同温同压下,两份相同质量的铁粉,分别与足量的稀硫酸和稀硝酸反应,产生气体的体积相同 D.将CO2气体通入BaCl2溶液中至饱和未见沉淀生成,继续通入NO2则有沉淀生成 解析选项A,活性炭能使品红溶液褪色是利用了活性炭的吸附性,SO2能使品红溶液褪色是利用了SO2可与品红生成不稳定的无色物质,Na2O2具有强氧化性,使品红溶液褪色,三者使品红溶液褪色的原理不同;选项B,如NO、CO不是酸性氧化物,大多数金属氧化物是碱性氧化物;选项C,根据反应:Fe+H2SO4FeSO4+H2↑,Fe+4HNO3(稀)Fe(NO3)3+NO↑+2H2O,同温同压下,等物质的量的Fe参与反应时生成的H2、NO的体积相等;选项D,继续通入NO2,NO2与水反应产生HNO3,但没有沉淀生成。 答案D 12.足量铜与一定量浓硝酸反应,得到硝酸铜溶液和NO2、N2O4、NO的混合气体,这些气体与1.68 L O2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸。若向所得硝酸铜溶液中加入5 mol·L-1 NaOH溶液至Cu2+恰好完全沉淀,则消耗NaOH溶液的体积是( ) A.60 mL B.45 mL C.30 mL D.15 mL 解析根据题意可知Cu与HNO3反应生成Cu(NO3)2,所失电子的物质的量与1.68 L O2(标准状况)所得电子的物质的量相等,则n(Cu2+)=2n(O2)=2×=0.15 mol,根据Cu2++2OH-Cu(OH)2↓可知,使所得Cu(NO3)2溶液中Cu2+恰好完全沉淀,消耗NaOH的物质的量为0.3 mol,需5 mol·L-1 NaOH溶液的体积为=0.06 L=60 mL。 答案A 二、非选择题(本题包括4小题,共52分) 13.(12分)A、B、C、D是中学化学常见的三种物质,它们之间的相互转化关系如下(反应条件及部分产物已略去): (1)若A是一种黄色固体单质,则反应②③的化学方程式分别为 ; 。 (2)若A是一种金属单质,C是淡黄色固体,则反应③的化学方程式为 。 (3)①②③三步反应中,一定属于氧化还原反应的是 (填序号)。 解析题给反应中包含常见的“连续氧化”。在中学教材中,这样的“连续氧化”有:C(或CH4等)→CO→CO2;Na→Na2O→Na2O2;S(或H2S)→SO2→SO3;N2(或NH3)→NO→NO2等。据此可知: (1)的路线为:S→SO2→SO3→H2SO4; (2)的路线为:Na→Na2O→Na2O2→NaOH; 根据上述分析可知,反应①②是单质或化合物被氧气氧化的反应,一定属于氧化还原反应,而③则不一定。 答案(1)2SO2+O22SO3 SO3+H2OH2SO4 (2)2Na2O2+2H2O4NaOH+O2↑ (3)①② 14.(18分)(1)分别向盛有等量铜片的四支试管中加入等体积的①浓硫酸;②稀硫酸;③浓硝酸;④稀硝酸,能随即发生剧烈反应的是(填序号,下同) ,常温下缓慢反应(或微热后能发生剧烈反应)的是 ,常温下不反应,但加热后发生剧烈反应的是 ,加热也不发生反应的是 。由此可以得到上述四种酸氧化性由强到弱的顺序是 。 (2)先将铜与浓硫酸加热时反应产生的气体X持续通入如图装置中,一段时间后再将铜与浓硝酸反应产生的大量气体Y也持续通入该装置中,可观察到的现象包括 。 A.通入X气体后产生白色沉淀 B.通入X气体后溶液中无明显现象 C.通入Y气体后开始沉淀 D.通入Y气体后沉淀溶解 E.通入Y气体后溶液中无明显现象 由此可得到的结论是 。 A.HNO3的酸性比H2SO4的强 B.盐酸的酸性比H2SO3的强 C.BaSO3能溶于盐酸 D.HNO3能氧化H2SO3(或SO2) E.BaSO4不溶于水也不溶于HNO3溶液 解析(2)因为盐酸的酸性比H2SO3的强,所以SO2不与BaCl2溶液反应,即持续通入X气体(SO2)后溶液中无明显现象。NO2与水反应生成HNO3,HNO3氧化H2SO3(或SO2)生成S,所以通入Y气体(NO2)后开始生成BaSO4沉淀。 答案(1)③ ④ ① ② ③>④>①>② (2)BC BCDE 15.(12分)有硫酸与硝酸的混合液,取出其中10 mL,加入足量的BaCl2溶液,将生成的沉淀过滤洗涤,干燥称得质量为9.32 g。另取这种溶液10 mL与4 mol·L-1的NaOH溶液25 mL恰好中和。则: (1)混合液中c(H2SO4)= mol·L-1,c(HNO3)= mol·L-1; (2)另取10 mL的混合液与0.96 g铜粉共热时,产生气体的体积为 L(标准状况)。 解析(1)由题意知: n(H2SO4)=n(BaSO4)==0.04 mol c(H2SO4)==4 mol·L-1 H+与OH-发生中和反应时,n(H+)=n(NaOH)=0.025 L×4 mol·L-1=0.1 mol,n(HNO3)=n(H+)-2n(H2SO4)=0.1 mol-0.04 mol×2=0.02 mol,c(HNO3)==2 mol·L-1。 (2)n(Cu)=0.015 mol,10 mL溶液中n(H+)=0.1 mol,n(N)=0.02 mol。 3Cu + 8H+ + 2N3Cu2++2NO↑+4H2O 3 mol 8 mol 2 mol 44.8 L 0.015 mol 0.1 mol 0.02 mol V(NO) 因0.1×3>0.015×8,故Cu与H+二者之中H+过量;又因0.02×3>0.015×2,故Cu 与N二者之中N过量。则Cu、H+、N三者之中H+与N均过量,Cu全部溶解,生成NO的体积应据Cu的物质的量来计算,V(NO)=0.015 mol×=0.224 L。 答案(1)4 2 (2)0.224 16.(10分)SO2是国内外允许使用的一种食品添加剂,在食品工业中发挥着护色、防腐、漂白和抗氧化的作用。我国对于SO2的添加量有明确规定:SO2残留量不得超过100毫克/千克。 某研究小组用如下图装置对市售黄花菜中的SO2进行测定。其中,溶液X为黄花菜进行充分浸泡后所得的浅黄色浸泡液,Y为加入的试剂(Y的浓度及体积均未标出)。查阅资料发现,在水溶液中正四价硫元素主要以S形式存在,且SO2与S化学性质相似。因此,该小组同学将SO2的测定问题转化为溶液中S的测定。 (1)结合化学知识解释浸泡液X中存在S的原因是 。 (2)甲同学预测可用Na2S溶液验证X中是否含有S,该预测应用的是Na2S的 性。查阅资料发现该反应较为复杂,因此未做进一步验证。 (3)乙同学为验证X中是否含有S,进行了实验ⅰ: 实验序号 试剂Y 现象 ⅰ 酸性KMnO4 ① 溶液 根据实验ⅰ的现象得出结论:溶液X中含有S。实验ⅰ的现象是 ,S在反应后转化为 。 (4)丙同学认为也可以用H2O2溶液来验证溶液X中是否含有S,进行了实验ⅱ: 实验序号 操作 现象 ⅱ a.向溶液X中加入适量H2O2溶液,振荡 无明显现象 b.继续滴加 ,振荡 无明显现象 c.再滴加 ,振荡 产生白 色沉淀 通过实验ⅱ可证明溶液X中含有S,写出操作b、c中滴加试剂的化学式 、 。 (5)丁同学认为丙的实验方案不严谨,设计了对比实验ⅲ,证明了溶液X中含有S。实验ⅲ的方案是 (从操作、现象、结论方面描述)。 (6)为测定市售黄花菜中SO2的含量,进行实验ⅳ: 实验序号 操作 ⅳ a.将50克黄花菜研碎,用一定浓度的氢氧化钠溶液浸泡; b.加稀硫酸酸化; c.加入淀粉指示剂; d.用浓度为0.01 mol·L-1的I2溶液滴定,消耗0.01 mol·L-1的I2溶液5.00 mL。 查阅资料发现:碘元素的常见价态有-1价,0价,+1价,+3价,+5价,+7价。 ①将黄花菜用氢氧化钠溶液浸泡的目的是(用化学方程式表示) 。 ②写出滴定反应的化学方程式: 。 ③该市售黄花菜中SO2的残留量是 毫克/千克。 解析(1)浸泡液X中存在S的原因是SO2与H2O反应生成H2SO3,H2SO3在溶液中可电离产生H+和S。 (2)因为Na2S与S可以发生反应2S2-+S+6H+3S↓+3H2O,该反应中Na2S作还原剂。 (3)溶液X中含有的S既有氧化性,又有还原性,所以与酸性KMnO4溶液反应,溶液会褪色,发生的反应为5S+2Mn+6H+5S+2Mn2++3H2O。S在反应后转化为S。 (4)溶液X中含有S,加入适量H2O2溶液后,发生的反应为S+H2O2S+H2O,再向溶液中加入稀盐酸,没有反应发生,再加BaCl2溶液,有白色沉淀产生,所以操作b、c中滴加的试剂分别为盐酸和BaCl2溶液。 (5)丁同学认为丙的实验方案不严谨,设计了对比实验ⅲ,证明了X中含有S。实验ⅲ的方案是:取溶液X,向其中滴加盐酸,再滴加氯化钡溶液,不产生白色沉淀,然后结合实验ⅱ,可证明溶液X中有S。 (6)①将黄花菜用氢氧化钠溶液浸泡是为了吸收黄花菜中的SO2,反应的化学方程式为SO2+2NaOHNa2SO3+H2O。②用浓度为0.01 mol·L-1的I2溶液滴定市售黄花菜的浸泡液,滴定反应的化学方程式为Na2SO3+I2+H2ONa2SO4+2HI。③用浓度为0.01 mol·L-1的I2溶液滴定,消耗0.01 mol·L-1的I2溶液5.00 mL,结合反应方程式:Na2SO3+I2+H2ONa2SO4+2HI,n(SO2)=n(Na2SO3)=n(I2)=0.01 mol·L-1×=5×10-5 mol,则浸泡液中SO2残留质量是5×10-5 mol×64 g·mol-1=3.2×10-3 g。所以市售黄花菜中SO2的含量是(3.2×10-3 g×1 000 mg·g-1)÷ kg=64 mg·kg-1。 答案(1)SO2与H2O反应产生H2SO3,H2SO3在溶液中可电离产生H+和S (2)还原 (3)溶液褪色 S (4)盐酸 BaCl2溶液 (5)取溶液X,滴加盐酸,再滴加氯化钡溶液,不产生白色沉淀,再结合实验ⅱ,证明溶液X中有S (6)①SO2+2NaOHNa2SO3+H2O ②Na2SO3+I2+H2ONa2SO4+2HI ③64查看更多