- 2021-08-06 发布 |
- 37.5 KB |
- 38页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020届二轮复习化学反应与能量课件(38张)(广西专用)
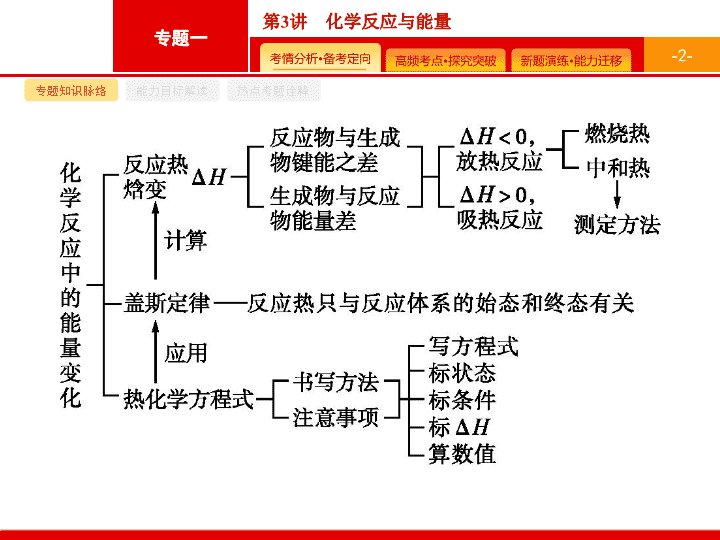
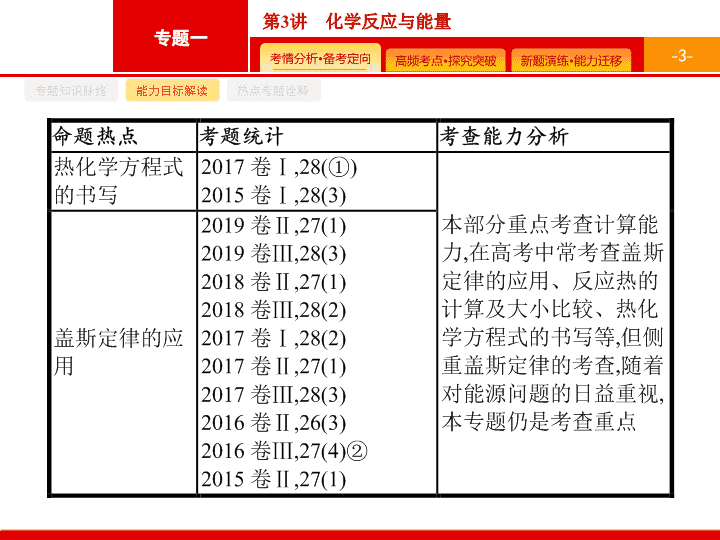
第 3 讲 化学反应与能量 - 2 - 专题知识脉络 能力目标解读 热点考题诠释 - 3 - 专题知识脉络 能力目标解读 热点考题诠释 - 4 - 专题知识脉络 能力目标解读 热点考题诠释 答案 89.3 解题要领 根据盖斯定律 , 将反应 ① 和 ② 叠加可得反应 ③ , 故 Δ H 3 =Δ H 1 +Δ H 2 =100.3 kJ · mol -1 +(-11.0 kJ · mol -1 )=89.3 kJ · mol -1 。 - 5 - 专题知识脉络 能力目标解读 热点考题诠释 答案 -116 解题要领 由盖斯定律可知 , 将题给催化过程的三个反应直接相加可得 : - 6 - 专题知识脉络 能力目标解读 热点考题诠释 3 .(2017 全国 Ⅰ , 节选 ) 如图是通过热化学循环在较低温度下由水或硫化氢分解制备氢气的反应系统原理。 通过计算 , 可知系统 ( Ⅰ ) 和系统 ( Ⅱ ) 制氢的热化学方程式分别为 、 , 制得等量 H 2 所需能量较少的是 。 - 7 - 专题知识脉络 能力目标解读 热点考题诠释 - 8 - 专题知识脉络 能力目标解读 热点考题诠释 Δ H 1 +Δ H 2 -Δ H 3 - 9 - 专题知识脉络 能力目标解读 热点考题诠释 2Δ H 1 -3Δ H 2 -Δ H 3 解题要领 将题给热化学方程式依次编号为 ① 、 ② 、 ③ , 根据盖斯定律 , ① ×2- ② ×3- ③ 可得目标热化学方程式 , 则 Δ H =2Δ H 1 -3Δ H 2 -Δ H 3 。 - 10 - 专题知识脉络 能力目标解读 热点考题诠释 答案 -99 +41 - 11 - 专题知识脉络 能力目标解读 热点考题诠释 解题要领 由反应 ① Δ H 1 = ∑ ( 反应物键能 )- ∑ ( 产物键能 ) 代入求得 Δ H 1 =(1 076+2×436-3×413-343-465) kJ · mol -1 =-99 kJ · mol -1 。 由盖斯定律 ,Δ H 3 =Δ H 2 -Δ H 1 =-58 kJ · mol -1 +99 kJ · mol -1 =+41 kJ · mol -1 。 - 12 - 命题热点一 命题热点二 命题热点三 反应热概念的正确理解 有关利用反应热概念解题的思维路径 - 13 - 命题热点一 命题热点二 命题热点三 问题探究 1 . 如何从微观和宏观的角度理解化学反应热效应 ? (1) 从微观的角度说 , 是旧化学键断裂吸收的能量与新化学键形成放出的能量的差值 , 如下图所示 : a 表示旧化学键断裂吸收的能量 ; b 表示新化学键形成放出的能量 ; c 表示反应热。 放热反应 Δ H <0 - 14 - 命题热点一 命题热点二 命题热点三 (2) 从宏观的角度说 , 是反应物自身的能量与生成物的能量差值 , 在上图中 : a 表示活化能 ; b 表示活化分子结合成生成物所释放的能量 ; c 表示反应热。 - 15 - 命题热点一 命题热点二 命题热点三 2 . 催化剂对活化能、焓变的影响是怎样的 ? 请用图表示出来。 催化剂能降低反应所需的活化能 , 但 Δ H 保持不变。如图所示 : 3 . 反应热的计算公式有哪些 ? Δ H = 生成物的总能量 - 反应物的总能量 Δ H = 反应物的键能之和 - 生成物的键能之和 - 16 - 命题热点一 命题热点二 命题热点三 例 1 某反应过程能量变化如图所示 , 下列说法不正确的是 ( ) A. 该反应反应物的总能量大于生成物的总能量 B. 该反应为放热反应 , 热效应等于 Δ H C. 改变催化剂 , 可改变该反应的活化能 D. 有催化剂条件下 , 反应的活化能等于 E 1 +E 2 - 17 - 命题热点一 命题热点二 命题热点三 分析推理 (1) 加入催化剂后反应历程有哪些变化 ? 催化剂使反应需要的能量降低 , 即活化能降低 , 反应速率会增大 , 所以 b 进程应该是加入了催化剂 , 但是催化剂并不能改变反应物能量和生成物的能量 , 所以反应热不改变。 (2) 该反应的活化能指的是哪一段能量 ? 活化能是使反应物分子变为活化分子吸收的能量 , 即反应物能量与最高能量之差。催化剂存在时 , 活化能为 E 1 。使用不同的催化剂 , 反应的活化能不同。 (3) 利用图像如何判断吸热反应与放热反应 ? 主要看反应物总能量和生成物总能量的相对大小。 答案 D - 18 - 命题热点一 命题热点二 命题热点三 题后反思 (1) 分析反应热效应时 , 只需用图像的起点 ( 反应物总能量 ) 和终点 ( 生成物总能量 ) 来判断反应是放热还是吸热 , 及反应热的大小。 (2) 加入催化剂 , 反应的活化能降低 , 图线应下降 , 但图像的起点和终点不变。 - 19 - 命题热点一 命题热点二 命题热点三 对点训练 1 已知化学反应 A 2 (g)+B 2 (g) 2AB(g) Δ H =+100 kJ·mol -1 的能量变化如图所示 , 判断下列叙述中正确的是 ( ) A. 加入催化剂 , 该反应的反应热 Δ H 将减小 B. 每形成 2 mol A—B 键 , 将吸收 b kJ 能量 C. 每生成 2 分子 AB 吸收 ( a-b ) kJ 能量 D. 该反应正反应的活化能大于 100 kJ·mol -1 D 解析 催化剂不能改变反应热的大小 ,A 项错 ; 形成化学键放出能量 ,B 项错 ; 热化学方程式的化学计量数表示物质的量 , 故每生成 2 mol AB 吸收 ( a-b ) kJ 的能量 ,C 项错。 - 20 - 命题热点一 命题热点二 命题热点三 热化学方程式的书写 有关热化学方程式书写的思维路径 - 21 - 命题热点一 命题热点二 命题热点三 问题探究 1 . 如何书写热化学方程式 ? 考查热化学方程式的书写一般是结合计算进行 , 所以应分两步 : (1) 写 : 首先根据题意书写热化学方程式。特别注意 : ① 要标明反应的温度和压强 , 若反应是在 25 ℃ 和 1.01×10 5 Pa 条件下进行的 , 可不注明 ; ② 要注明物质的聚集状态 ; ③ 虽然热化学方程式的计量数可以是分数 , 但在书写时一般选比较常规的 , 如最简整数比或与题中所给信息相同的 , 这样才能与标准答案相符。 - 22 - 命题热点一 命题热点二 命题热点三 (2) 算 : 根据题意计算反应热。注意 : ① 计算时 , 一般先把所给已知量换算成物质的量 , 然后进行计算 ; ② 热化学方程式中 Δ H 值一定要与方程式中的化学计量数成比例 ; ③ 要注明 Δ H 的单位和 “+”“-” 符号 ; ④ 对于可逆反应 ,Δ H 表示按照热化学方程式中物质的计量数完全反应时吸收或放出的热量。 - 23 - 命题热点一 命题热点二 命题热点三 2 . 如何书写表示物质燃烧热和中和热的热化学方程式 ? - 24 - 命题热点一 命题热点二 命题热点三 例 2 依据事实 , 写出下列反应的热化学方程式。 (1) 在 25 ℃ 、 101 kPa 下 ,1 g 甲醇燃烧生成 CO 2 和液态水时放热 22.68 kJ 。则表示甲醇燃烧热的热化学方程式为 。 (2) 若适量的 N 2 与 O 2 完全反应 , 每生成 23 g NO 2 需要吸收 16.95 kJ 热量 , 相关的热化学方程式为 。 (4) 在 25 ℃ 、 101 kPa 下 , 已知 SiH 4 气体在氧气中完全燃烧后恢复至原状态 , 平均每转移 1 mol 电子放热 190.0 kJ, 该反应的热化学方程式是 。 - 25 - 命题热点一 命题热点二 命题热点三 - 26 - 命题热点一 命题热点二 命题热点三 - 27 - 命题热点一 命题热点二 命题热点三 题后反思 (1) 在书写时易漏标状态 , 放热反应易丢负号 , 水易错写成气态 ; (2) 书写热化学方程式时物质的化学计量数应与反应热对应。 - 28 - 命题热点一 命题热点二 命题热点三 对点训练 2 几种物质的能量关系如下图所示。下列说法正确的是 ( ) C. 由图可知 , 甲烷的燃烧热为 779.7 kJ·mol -1 D. 通常由元素最稳定的单质生成 1 mol 化合物时的反应热称为该化合物的标准生成焓 , 由图可知 ,CH 4 (g) 的标准生成焓为 +74.8 kJ·mol -1 B - 29 - 命题热点一 命题热点二 命题热点三 解析 根据能量关系 , 无法计算出 C 和 O 2 生成 CO 2 的焓变 , 故 A 错误 ; 根据能量关系 , Δ H =(854.5-965.1) kJ · mol -1 =-110.6 kJ · mol -1 , 故 B 正确 ; 根据题图可知 , 甲烷的燃烧热为 890.3 kJ · mol -1 , 故 C 错误 ; 该反应为化合反应 , 属于放热反应 , 即 CH 4 (g) 的标准生成焓为 (890.3-965.1) kJ · mol -1 =-74.8 kJ · mol -1 , 故 D 错误。 - 30 - 命题热点一 命题热点二 命题热点三 盖斯定律及其应用 根据盖斯定律解题的思维路径 - 31 - 命题热点一 命题热点二 命题热点三 问题探究 1 . 如何运用盖斯定律求反应热 ? 参照目标热化学方程式 , 设计合理的反应途径 , 对原热化学方程式进行恰当 “ 变形 ”( 反写、乘除某一个数 ), 然后热化学方程式之间进行 “ 加减 ”, 从而得出新热化学方程式。 具体方法 :(1) 热化学方程式乘以某一个数时 , 反应热也必须乘上该数 ;(2) 热化学方程式 “ 加减 ” 时 , 同种物质之间可相 “ 加减 ”, 反应热也随之 “ 加减 ” 。 2 . 运用盖斯定律时 , 有哪些注意事项 ? (1) 将一个热化学方程式颠倒时 ,Δ H 的 “+”“-” 号也随之改变 , 但绝对值不变。 (2) 注意物质中共价键的数目 : 如 1 mol H 2 、 P 4 分别含有 1 mol H—H 键、 6 mol P—P 键 ,1 mol H 2 O 中含有 2 mol O—H 键 ,1 mol NH 3 中含有 3 mol N—H 键 ,1 mol CH 4 中含有 4 mol C—H 键。 - 32 - 命题热点一 命题热点二 命题热点三 例 3 已知 : - 33 - 命题热点一 命题热点二 命题热点三 分析推理 分两步 : 先观察总反应方程式中各物质的状态和化学计量数 , 反应物中有 1 mol C 2 H 4 (g) 和 1 mol H 2 O(g), ② 生成物中有 1 mol C 2 H 4 (g), 所以需要方程式 ② 颠倒过来 , 反应热 Δ H 2 前也需要加负号 , 生成物中有 1 mol C 2 H 5 OH(g), ③ 中 1 mol C 2 H 5 OH(g) 在反应物中 , 所以需要方程式 ③ 颠倒过来 , 反应热 Δ H 3 前也需要加负号 , 此时得到的方程式为 C 2 H 4 (g)+2H 2 O(g)+CH 3 OCH 3 (g) 2CH 3 OH(g)+ CH 3 CH 2 OH(g), 只要与 ① 相加即可。 计算反应热 :Δ H =Δ H 1 -Δ H 2 -Δ H 3 =-45.5 kJ · mol -1 答案 -45.5 题后反思 部分考生在写数值时丢了前面的负号 , 导致本空不得分 , 不少学生在运用盖斯定律计算时出错 , 计算能力需要在平时强化 , 在最后填空时还应注意是否需要写单位。 - 34 - 命题热点一 命题热点二 命题热点三 - 35 - A - 36 - 2 .H 2 与 ICl 的反应分 ①② 两步进行 , 且两步都为可逆反应 , 其能量曲线如图所示 , 下列有关说法错误的是 ( ) D - 37 - 答案 解析 解析 关闭 答案 解析 关闭 - 38 - 解析 将已知热化学方程式依次编号为 ① 、 ② , 根据盖斯定律可由 ② ×4- ① 得出待求的热化学方程式。查看更多