- 2021-08-06 发布 |
- 37.5 KB |
- 9页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
化学卷·2018届甘肃省武威第十八中学高二上学期期末考试(2017
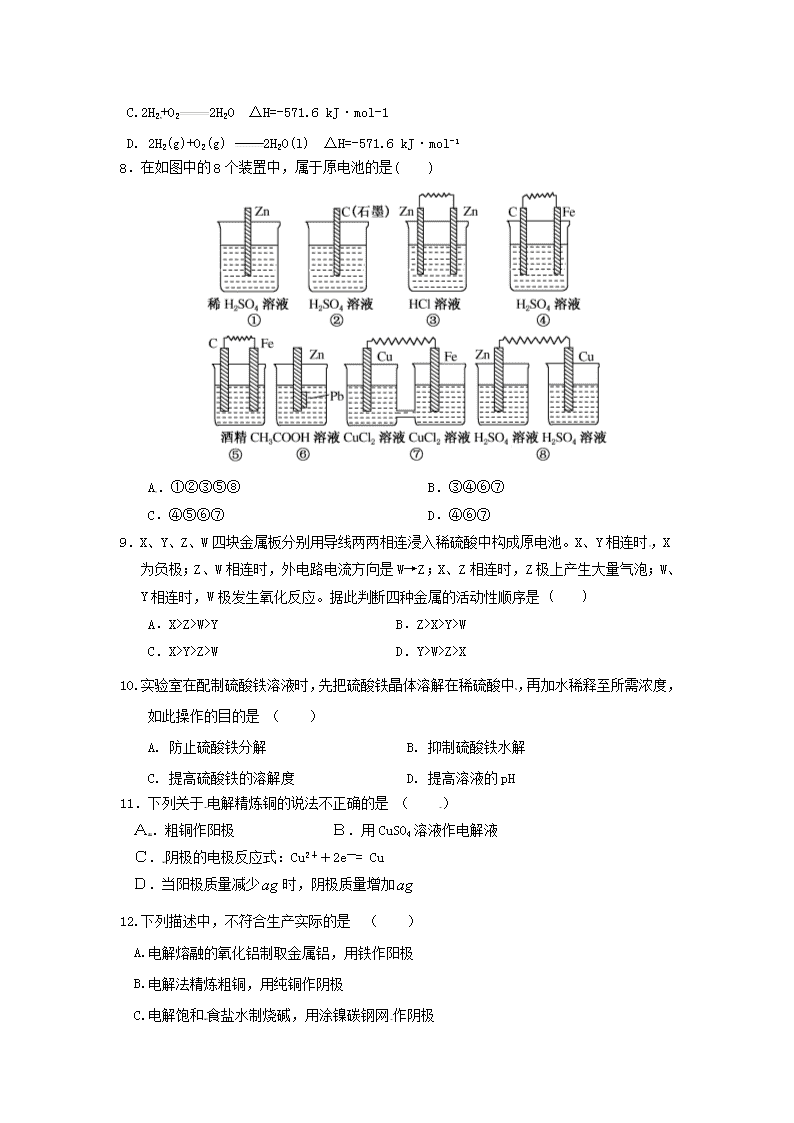
高二期末化学试题 本试卷分选择题和非选择题两部分。满分100分,考试时间90分钟 可能用到的相对原子质量:H-1 Ag-108 O-16 Na-23 Mg-24 K-39 Cu-64 S-32 一、 选择题:(每小题只有一个符合题意,共30题,每小题2分,共60分) 1. 25℃时,将稀氨水逐滴加入到稀硫酸中,当溶液的pH=7时,下列关系正确的是( ) A. c(NH4+) = c(SO42-) B. c(NH4+)=2c(SO42-) C. 2c(NH4+)=c(SO42-) D. c(OH-)+c(SO42-) = c(H+)+c(NH4+) 2. 下列叙述不正确的是( ) A. 金属的电化腐蚀比化学腐蚀普遍 B. 钢铁在干燥空气里不易腐蚀 C. 用铝质铆钉接铁板,铁板易被腐蚀 D. 原电池电路中电子由负极流入正极 3.在100 ℃时,水的离子积等于1.0×10-12,若该温度下某溶液中的 c(H+)=1×10-7 mol/L,则该溶液( ) A.呈碱性 B.呈酸性 C.呈中性 D.c(H+)=c(OH-) 4. 能说明溶液呈中性的可靠依据是( ) A. pH=7 B. c(H+)=c(OH-) C. pH试纸不变色 D. 石蕊试液不变色 5.下列过程通电后才能进行的是( ) ①电离 ②电解 ③电镀 ④电化学腐蚀 A.①②③ B.①②④ C.②③ D.全部 6、已知反应A2(g)+2B2(g)2AB2(g) △H<0,下列说法正确的是 ( ) A.升高温度,正向反应速率增加,逆向反应速率减小 B.升高温度有利于反应速率增加,从而缩短达到平衡的时间 C.达到平衡后,升高温度或增大压强都有利于该反应平衡正向移动 D.达到平衡后,降低温度或减小压强都有利于该反应平衡正向移动 7.1 mol H2燃烧生成液态水时放出285.8 kJ热量,下列表示该反应的热化学方程式正确的是 ( ) A.2H2(g)+O2(g) 2H2O(l) ΔH=-142.9 kJ·mol-1 B. 2H2(g)+O2(g) 2H2O(l) ΔH=+571.6 kJ·mol-1 C.2H2+O22H2O ΔH=-571.6 kJ·mol-1 D. 2H2(g)+O2(g) 2H2O(l) ΔH=-571.6 kJ·mol-1 8.在如图中的8个装置中,属于原电池的是( ) A.①②③⑤⑧ B.③④⑥⑦ C.④⑤⑥⑦ D.④⑥⑦ 9.X、Y、Z、W四块金属板分别用导线两两相连浸入稀硫酸中构成原电池。X、Y相连时,X为负极;Z、W相连时,外电路电流方向是W→Z;X、Z相连时,Z极上产生大量气泡;W、Y相连时,W极发生氧化反应。据此判断四种金属的活动性顺序是 ( ) A.X>Z>W>Y B.Z>X>Y>W C.X>Y>Z>W D.Y>W>Z>X 10. 实验室在配制硫酸铁溶液时,先把硫酸铁晶体溶解在稀硫酸中,再加水稀释至所需浓度,如此操作的目的是 ( ) A. 防止硫酸铁分解 B. 抑制硫酸铁水解 C. 提高硫酸铁的溶解度 D. 提高溶液的pH 11.下列关于电解精炼铜的说法不正确的是 ( ) A.粗铜作阳极 B.用CuSO4溶液作电解液 C.阴极的电极反应式:Cu2++2e—= Cu D.当阳极质量减少时,阴极质量增加 12.下列描述中,不符合生产实际的是 ( ) A.电解熔融的氧化铝制取金属铝,用铁作阳极 B.电解法精炼粗铜,用纯铜作阴极 C.电解饱和食盐水制烧碱,用涂镍碳钢网作阴极 D.在镀件上电镀锌,用锌作阳极 13、一定条件下,在体积不变的密闭容器中,能表示反应: X(g)+2Y(g) 2Z(g)一定达到化学平衡状态的是( ) ①X、Y、Z的物质的量之比为1∶2∶2 ②X、Y、Z的浓度不再发生变化 ③容器中的压强不再发生变化 ④单位时间内生成n mol Z,同时生成2n mol Y A.①② B.①④ C.②③ D.③④ 14、在一定体积的密闭容器中,进行如下的化学反应: CO2(g)+H2(g)CO(g)+H2O(g),K被称为化学平衡常数,其中K和温度的关系如下表: t/℃ 700 800 830 1 000 1 200 K 0.6 0.9 1.0 1.7 2.6 根据以上信息推断以下说法正确的是( )。 A、此反应为放热反应 B、此反应只有达到平衡时,密闭容器中的压强才不会变化 C、此反应在1 000 ℃时的反应速率比700 ℃时大 D、该反应的化学平衡常数越大,反应物的转化率越低 15.对于反应A(g)+2B(g)2C(g),在压强相同的条件下,若生成物C的含量w(C)与时间t的关系如图所示。则下列结论正确的是( ) A.T1>T2 ,正反应放热 B.T1<T2 ,正反应放热 C.T1>T2 ,正反应吸热 D.T1<T2 ,正反应吸热 16.下列叙述正确的是( ) A.稀醋酸中加入少量醋酸钠能增大醋酸的电离程度 B.25 ℃时,等体积等浓度的硝酸与氨水混合后,溶液pH=7 C.25 ℃时,0.1 mol·L-1的硫化氢溶液比等浓度的硫化钠溶液的导电能力弱 D.0.1 mol AgCl和0.1 mol AgI混合后加入1 L水中,所得溶液中c(Cl-)=c(I-) 17.下列关于化学能转化为电能的四种装置的说法正确的是( ) A.电池Ⅰ中锌是正极 B.电池Ⅱ是一次性电池 C.电池Ⅲ工作时,氢气发生还原反应 D.电池Ⅳ工作时,电子由锌通过导线流向碳棒 18.如图所示装置中,a、b都是惰性电极,通电一段时间后,b极附近溶液呈红色。下列说法正确的是( ) ①X是正极,Y是负极 ②X是负极,Y是正极 ③CuSO4溶液的pH逐渐减小 ④CuSO4溶液的pH不变 A.①③ B.②③ C.①④ D.②④ 19.镍—镉可充电电池可以发生反应: 该电池的负极材料是 ( ) A.Cd B.NiO(OH) C.Cd(OH)2 D.Ni(OH)2 20.如图所示装置中,观察到电流计指针偏转;M棒变粗;N棒变细,由此判断表中所列M、N、P物质,其中可以成立的是( ) M N P A Zn Cu 稀H2SO4溶液 B Cu Fe 稀HCl溶液 C Ag Zn AgNO3溶液 D Zn Fe Fe(NO3)3溶液 21. 分别放置在下图所示装置(都盛有0.1 mol·L-1的H2SO4溶液)中的四个相同的纯锌片,腐蚀最慢的是( ) 22. 已知下面三个数据:①7.2×10-4、②2.6×10-4、③4.9×10-10分别是三种酸的电离平衡常数,若已知这三种酸可发生如下反应:NaCN+HNO2==HCN+NaNO2 NaNO2+HF==HCN+NaF NaNO2+HF==HNO2+NaF 由此可判断下列叙述中正确的是( ) A. HF的电离常数是① B. HNO2的电离常数是① C. HCN的电离常数是② D. HNO2的电离常数是③ 23. 下列过程或现象与盐类水解无关的是( ) A. 纯碱溶液去油污 B. 铁在潮湿的环境下生锈 C. 加热氯化铁溶液颜色变深 D. 浓硫化钠溶液有臭鸡蛋味 24.下列离子方程式中,属于水解反应的是( ) A. HCOOH+H2OHCOO-+H3O+ B. CO2+H2OHCO3-+H+ C. CO32-+H2O HCO3- +OH- D. HS-+H2OS2-+H3O+] 25. 室温下,在pH=12的强碱溶液中,由水电离出的c(OH-)为 ( ) A. 1.0×10-7 mol•L-1 B.1.0×10-6 mol•L-1 C. 1.0×10-2 mol•L-1 D. 1.0×10-12 mol•L-1 26. 在由水电离产生的H+浓度为1×10-13mol·L-1的溶液中,一定能大量共存的离子组是( ) ① K+、Cl-、NO3-、S2- ② K+、Fe2+、I-、SO42- ③ Na+、Cl-、NO3-、SO42- ④Na+、Ca2+、Cl-、HCO3- ⑤ K+、Ba2+、Cl-、NO3- A.①③ B.③⑤ C.③④ D.②⑤ 27.下列肥料中,可跟草木灰混合施用的是( ) (A)(NH4)2SO4 (B)NH4Cl (C)KNO3 (D)Ca(H2PO4)2 28.为了除去MgCl2酸性溶液中的Fe3+,可在加热搅拌条件下加入一种试剂,过滤后,再加入适量盐酸,这种试剂是( ) (A)NH3·H2O (B)NaOH (C)Na2CO3 (D)MgCO3 29.将pH=3的硫酸溶液和pH=12的氢氧化钠溶液混和,若使混和后溶液的 pH=7,则硫酸溶液和氢氧化钠溶液的体积比是( ) A.1︰20 B.1︰10 C.20︰1 D.10︰1 30. 下列操作中,能使电离平衡H2OH++OH-,向右移动且溶液呈酸性的是( ) A.向水中加入NaHSO4溶液 B.向水中加入Al2(SO4)3固体 C.向水中加入Na2CO3溶液 D.将水加热到100℃,使pH=6 卷Ⅱ 二、非选择题(5题,共40分) 31.(9分)依据氧化还原反应Cu(s)+ 2Ag +(aq)= 2Ag(s) + Cu 2+(aq)设计的原电池如下面左图所示。请回答下列问题: (1)电极X的材料是 ;电解质溶液Y是 。 (2)银电极为电池的 极、发生的电极反应式为 X电极上发生的电极反应式为 (3)外电路中的电子是从 电极流向 电极(填化学式)。 32.(6分)美国阿波罗宇宙飞船上使用的氢氧燃料电池是一种新型化学电源,其构造如上图12-9所示:a、b两个极均由多孔性碳制成,通入的气体由孔隙中逸出,并在电极表面放电。 (1)a是__________极,电极反应式为_________________________; (2)b是_________极,电极反应式为_________________________。 33. (11分)右图中电极a、b分别为Ag电极和Pt电极,电极c、d都是石墨电极。通电一段时间后,在c、d两极上共收集到336mL(标准状态)气体。回答: (1)直流电源中,M为 极。 (2)Pt电极上生成的物质是 ,其质量为 g。 (3)电源输出的电子,其物质的量与电极b、c、d分别生成的物质的物质的量之比为: 2∶ ∶ ∶ 。 (4)AgNO3溶液的浓度(填增大、减小或不变。下同) ,AgNO3溶液的pH ,H2SO4溶液的浓度 ,H2SO4溶液的pH 。 34. (6分) 在一定温度下,向AgI的饱和溶液中:(填“增大”、“减小”或“不变”) (1)若加入AgNO3固体,c(I-) 。 (2)若加入更多的AgI固体,则c(Ag+) 。 (3)若加入固体AgBr,c(I-) 。 35. (8分).室温下,向一定量的稀氨水中逐滴加入物质的量浓度相同的盐酸,直至盐酸过量。请分析上述实验过程中,①所发生的反应;②溶液的成分;③溶液的PH变化。并回答下列问题: (1)该反应的离子方程式为 (2)在实验过程中水的电离程度变化趋势是先 后 (选填“大”“小”或“不变”) (3)在实验过程中,当溶液的PH恰好等于7时,溶液中对应溶质的化学式是 。 此时溶液中离子浓度的大小顺序是 。 高二期末化学答案 一、 选择题:(每小题只有一个符合题意,共30题,每小题2分,共60分) 1、 B C A B C 6、 B D D A B 11、D A C C A 16、 C D A A C 21、D A B C D 26、 B C D D B 二、非选择题(5题,共40分) 31. (9分) (1)铜; Ag NO3溶液 (2) 正; Cu—2e-= Cu 2+ (2分) Ag + + e- = Ag(2分) (3) 负(Cu); 正(Ag) 32、(6分)(1)负极 , 2H2 +4OH-- 4e- = 4H2O ; (2)正极, O2 + 2H2O + 4e-= 4OH- 33、(11分)(1)正(2分) (2)Ag、 2.16;(共3分) (3)2:0.5:1(2分) (4)不变、不变、增大、减小(各1分) 34. (6分,每空2分)(1)减小(2)不变(3)减小 35. (8分)(1) NH3·H2O+H+==NH4++H2O (2分) (2) 大 小(各1分) (3)NH4CL、NH3·H2O , (2分) c(NH4+)== c(Cl-)>c(H+)== c(OH-)(2分)查看更多