- 2021-08-06 发布 |
- 37.5 KB |
- 7页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
化学卷·2018届湖北省宜昌一中高二上学期期末考试(2017
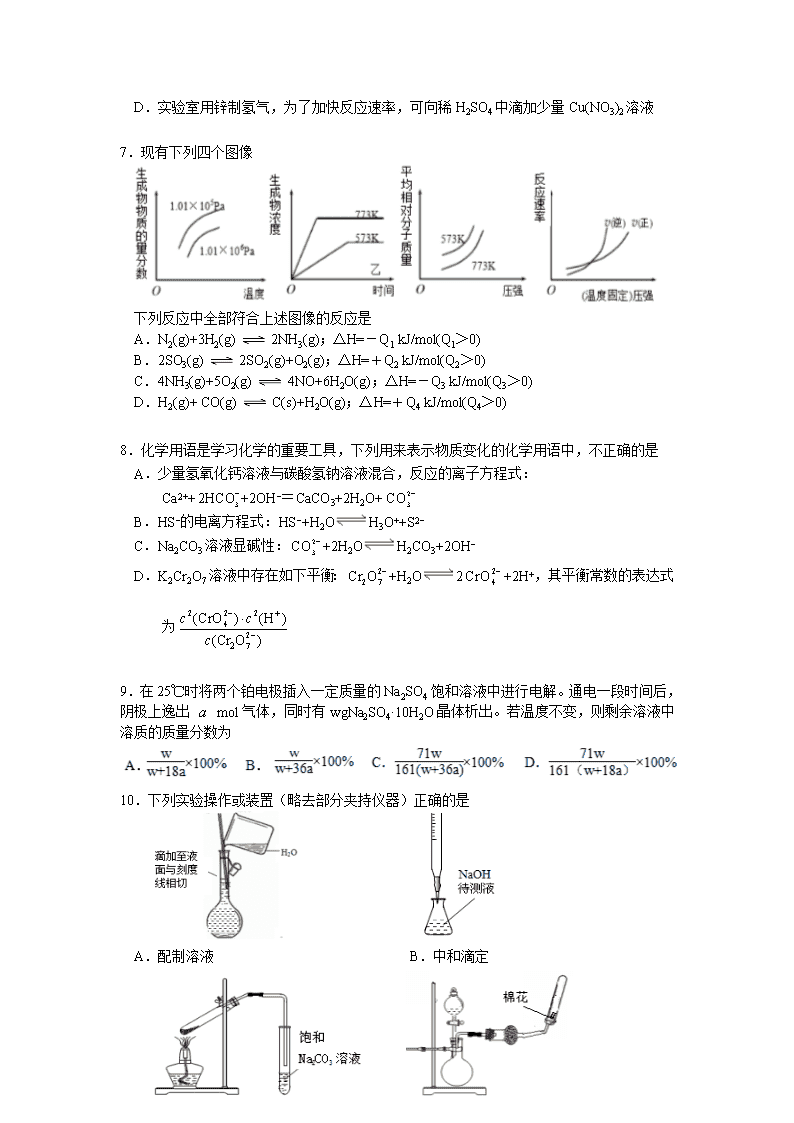
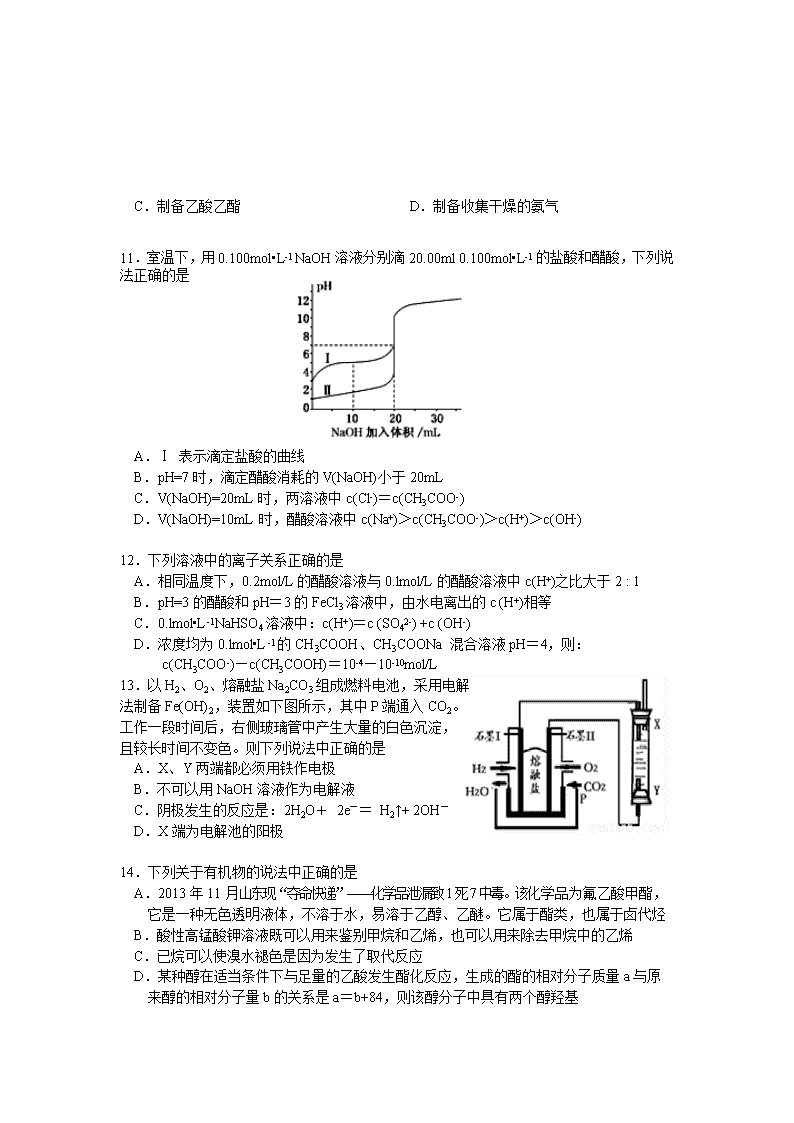
宜昌市第一中学2016年秋季学期高二年级期末考试 化 学 试 题 命题人:董颖超 审题人:范照彬 考试时间:90分钟 满分:100分 注意:请将答案填涂在答题卡上,写在试卷上一律无效。 相对原子质量:H-1 C-12 O-16 Na-23 S-32 K-39 Cr-52 第I卷 选择题(共48分) 每小题只有一个选项符合题意,每小题3分,共48分。 1. 化学与人类生产、生活密切相关,下列有关说法不正确的是 A.“海水淡化”可以解决淡水供应危机,向海水中加入明矾可以使海水淡化 B.漂白粉解决了氯水漂白时不稳定、难以保存、使用不方便、效果不理想的问题 C.钢铁的腐蚀最普遍的是吸氧腐蚀,最终产物为铁锈 D.温度、压强一定时,放热且熵增的反应能自发进行 2.25℃、101kPa下充分燃烧一定量丁烷(C4H10)气体放出的热量为Q kJ,用5mol/L的KOH溶液200mL完全吸收生成的CO2,并与之生成正盐,则丁烷的燃烧热的数值是 A.16Q B.8Q C.4Q D.2Q 3. 下列实验能达到实验目的的是 A. 将CuCl2溶液小心蒸干得到无水CuCl2 B. 用AgNO3溶液鉴别NO2和Br2蒸气 C.电解熔融的AlCl3制备金属铝 D.用饱和Na2CO3溶液除去CO2气体中混有的HCl 4.4 mol A气体和2 mol B气体在2L 容器中发生如下反应:2A(g)+B(g) 2C(g), 2s 时测得C的浓度为0.6mol•L-1 。下列说法中不正确的是 A.用物质A表示的反应平均速率为0.3 mol•L-1•s-1 B.2s时的压强是起始时的1.1倍 C.2s时物质A的转化率为30% D.2s时物质B的浓度为0.7 mol•L-1 5.下列有机物中同分异构体数目最少的是 A.C5H10 B.C6H14 C.C4H9Cl D.C4H10O 6.下列说法符合事实的是 A.常温下,加入铝粉能够产生氢气的溶液中水电离的c(H+)一定小于10-7mol·L-1 B.已知Ksp(AgCl)=1.56×10-10,Ksp(Ag2CrO4)=9.0×10-12。在含Cl— 、CrO42—浓度相同的溶液中滴加稀AgNO3溶液时,先生成Ag2CrO4沉淀 C.温度一定时,强电解质溶液的导电能力一定比弱电解质溶液强 D.实验室用锌制氢气,为了加快反应速率,可向稀H2SO4中滴加少量Cu(NO3)2溶液 7. 现有下列四个图像 下列反应中全部符合上述图像的反应是 A.N2(g)+3H2(g) 2NH3(g);△H=-Q1 kJ/mol(Q1>0) B.2SO3(g) 2SO2(g)+O2(g);△H=+Q2 kJ/mol(Q2>0) C.4NH3(g)+5O2(g) 4NO+6H2O(g);△H=-Q3 kJ/mol(Q3>0) D.H2(g)+ CO(g) C(s)+H2O(g);△H=+Q4 kJ/mol(Q4>0) 8.化学用语是学习化学的重要工具,下列用来表示物质变化的化学用语中,不正确的是 A.少量氢氧化钙溶液与碳酸氢钠溶液混合,反应的离子方程式: Ca2+++2OH−=CaCO3+2H2O+ B.HS−的电离方程式:HS−+H2OH3O++S2− C.Na2CO3溶液显碱性:+2H2OH2CO3+2OH− D.K2Cr2O7溶液中存在如下平衡:+H2O2+2H+,其平衡常数的表达式为 9. 在25℃时将两个铂电极插入一定质量的Na2SO4饱和溶液中进行电解。通电一段时间后,阴极上逸出 mol气体,同时有wgNa2SO4·10H2O晶体析出。若温度不变,则剩余溶液中溶质的质量分数为 10.下列实验操作或装置(略去部分夹持仪器)正确的是 A.配制溶液 B.中和滴定 C.制备乙酸乙酯 D.制备收集干燥的氨气 11. 室温下,用0.100mol•L-1 NaOH溶液分别滴20.00ml 0.100mol•L-1的盐酸和醋酸,下列说法正确的是 A.Ⅰ 表示滴定盐酸的曲线 B.pH=7时,滴定醋酸消耗的V(NaOH)小于20mL C.V(NaOH)=20mL时,两溶液中c(Cl-)=c(CH3COO-) D.V(NaOH)=10mL时,醋酸溶液中c(Na+)>c(CH3COO-)>c(H+)>c(OH-) 12.下列溶液中的离子关系正确的是 A.相同温度下,0.2mol/L的醋酸溶液与0.lmol/L的醋酸溶液中c(H+)之比大于2 : 1 B.pH=3的醋酸和pH=3的FeCl3溶液中,由水电离出的c (H+)相等 C.0.lmol•L-1NaHSO4溶液中:c(H+)=c (SO42-) +c (OH-) D.浓度均为0.lmol•L-1的CH3COOH、CH3COONa 混合溶液pH=4,则: c(CH3COO-)—c(CH3COOH)=10-4—10-10mol/L 13. 以H2、O2、熔融盐Na2CO3组成燃料电池,采用电解 法制备Fe(OH)2,装置如下图所示,其中P端通入CO2。 工作一段时间后,右侧玻璃管中产生大量的白色沉淀, 且较长时间不变色。则下列说法中正确的是 A.X、Y两端都必须用铁作电极 B.不可以用NaOH溶液作为电解液 C.阴极发生的反应是:2H2O+ 2e-= H2↑+ 2OH- D.X端为电解池的阳极 14.下列关于有机物的说法中正确的是 A.2013年11月山东现“夺命快递”——化学品泄漏致1死7中毒。该化学品为氟乙酸甲酯, 它是一种无色透明液体,不溶于水,易溶于乙醇、乙醚。它属于酯类,也属于卤代烃 B.酸性高锰酸钾溶液既可以用来鉴别甲烷和乙烯,也可以用来除去甲烷中的乙烯 C.已烷可以使溴水褪色是因为发生了取代反应 D.某种醇在适当条件下与足量的乙酸发生酯化反应,生成的酯的相对分子质量a与原 来醇的相对分子量b的关系是a=b+84,则该醇分子中具有两个醇羟基 15.常温下,0.1 mol·L-1某一元酸(HA)溶液的pH=3。下列叙述不正确的是 A.HA是一种弱酸 B.0.1 mol·L-1 HA溶液与0.05 mol·L-1 NaOH溶液等体积混合,所得溶液中: 2c(H+)+c(HA)=c(A-)+2c(OH-) C.体积、浓度均相等的HA溶液与盐酸溶液分别与足量锌反应,产生氢气质量相同 D.该HA溶液中:2c(H+)=c(OH-)+c(A-)+c(HA) 16.亚氯酸钠是一种高效氧化剂、漂白剂,主要用于棉纺、亚麻、纸浆等漂白。亚氯酸钠(NaClO2)在溶液中可生成ClO2、HClO2、ClO2-、Cl-等,其中HClO2和ClO2都具有漂白作用。经测定,25℃时各组分含量随pH变化情况如图所示(Cl-没有画出)。则下列分析不正确的是 A.亚氯酸钠在碱性条件下较稳定 B.25℃时,HClO2的电离平衡常数的数值Ka约为10-6 C.使用该漂白剂的最佳pH为3 D.ClO2可用于自来水的消毒 第Ⅱ卷 非选择题(共52分) 17.(10分)试回答下列问题(温度均为25℃): (1)将0. 2mol / L HB溶液与0.1 mol / L MOH溶液等体积混合,测得混合溶液的pH=4,则混合溶液中由水电离出的c(H+) 0. 2 mol / L HB溶液中由水电离出的c(H+)。(填“>”、“<”或“=” ) (2)pH=13的Ba(OH)2溶液a L与pH=3的HCl溶液b L混合。若所得混合溶液呈中性, 则a∶b= 。 (3) 在载人航天器的生态系统中,不仅要求分离去除CO2,还要求提供充足的O2。某种电化学装置可实现如下转化:2 CO2=2 CO+O2,得到的CO还可以用作燃料。已知某个电极的反应为:4OH--4e-=O2↑+2H2O,该电极为_____极;另一个电极的反应式为 _________________。 (4) 已知Ksp[Cu(OH)2] = 1×10-20 。要使0.2 mol / L 的CuSO4溶液中Cu2+沉淀较为完全,则应向溶液里加入NaOH溶液,调整溶液的pH范围为_________________。 18.(16分)已知可逆反应CO(g)+H2O(g) CO2(g) + H2(g) △H查看更多