- 2021-08-06 发布 |
- 37.5 KB |
- 3页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
化学卷·2018届四川省泸州市泸化中学高二上学期第二次月考(2016
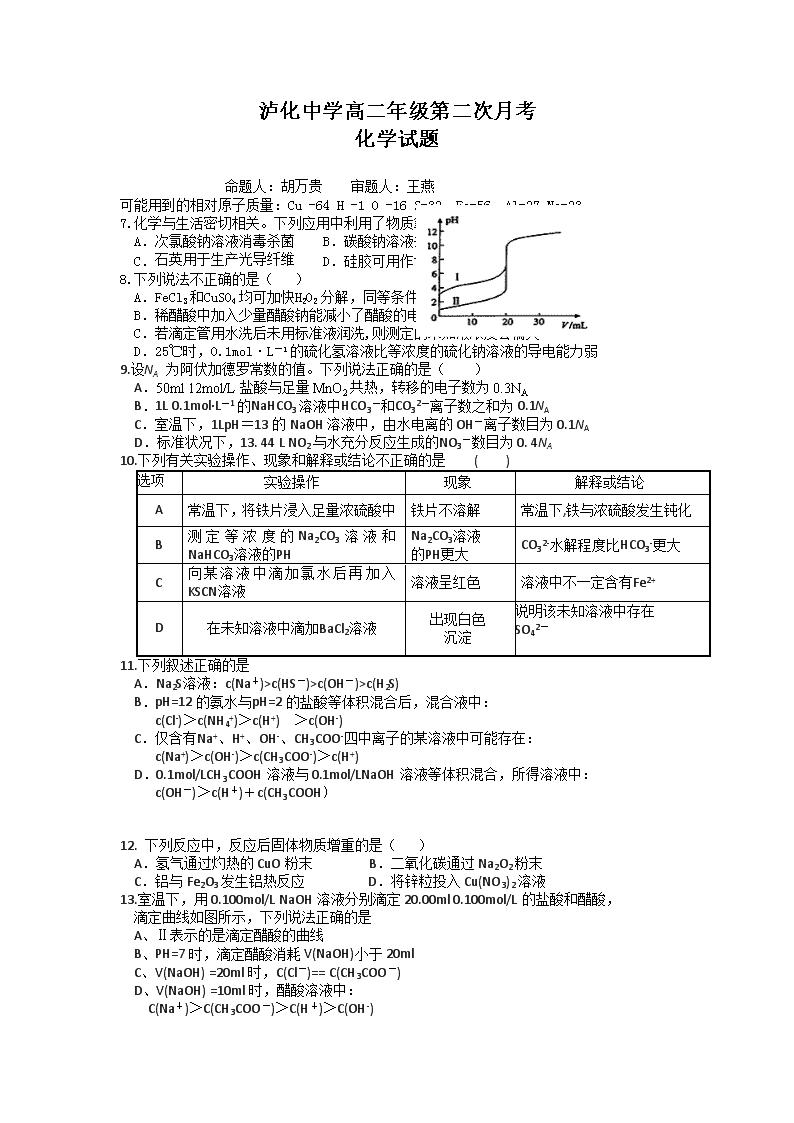
泸化中学高二年级第二次月考 化学试题 命题人:胡万贵 审题人:王燕 可能用到的相对原子质量:Cu -64 H -1 O -16 S-32 Fe-56 Al-27 Na-23 7.化学与生活密切相关。下列应用中利用了物质氧化性的是( ) A.次氯酸钠溶液消毒杀菌 B.碳酸钠溶液去油污 C.石英用于生产光导纤维 D.硅胶可用作食品干燥剂 8.下列说法不正确的是( ) A.FeCl3和CuSO4均可加快H2O2分解,同等条件下二者的催化效果相同 B.稀醋酸中加入少量醋酸钠能减小了醋酸的电离程度 C.若滴定管用水洗后未用标准液润洗,则测定的未知液浓度会偏大 D.25℃时,0.1mol·L-1的硫化氢溶液比等浓度的硫化钠溶液的导电能力弱 9.设NA 为阿伏加德罗常数的值。下列说法正确的是( ) A.50ml 12mol/L盐酸与足量MnO2共热,转移的电子数为0.3NA B.1L 0.1mol·L-1的NaHCO3溶液中HCO3-和CO32-离子数之和为0.1NA C.室温下,1LpH=13的NaOH溶液中,由水电离的OH-离子数目为0.1NA D.标准状况下,13. 44 L NO2与水充分反应生成的NO3-数目为0. 4NA 10.下列有关实验操作、现象和解释或结论不正确的是 ( ) 选项 实验操作 现象 解释或结论 A 常温下,将铁片浸入足量浓硫酸中 铁片不溶解 常温下,铁与浓硫酸发生钝化 B 测定等浓度的Na2CO3溶液和NaHCO3溶液的PH Na2CO3溶液 的PH更大 CO32-水解程度比HCO3-更大 C 向某溶液中滴加氯水后再加入KSCN溶液 溶液呈红色 溶液中不一定含有Fe2+ D 在未知溶液中滴加BaCl2溶液 出现白色 沉淀 说明该未知溶液中存在 SO42- 11.下列叙述正确的是 A.Na2S溶液:c(Na+)>c(HS-)>c(OH-)>c(H2S) B.pH=12的氨水与pH=2的盐酸等体积混合后,混合液中: c(Cl-)>c(NH4+)>c(H+) >c(OH-) C.仅含有Na+、H+、OH-、CH3COO-四中离子的某溶液中可能存在: c(Na+)>c(OH-)>c(CH3COO-)>c(H+) D.0.1mol/LCH3COOH溶液与0.1mol/LNaOH溶液等体积混合,所得溶液中: c(OH-)>c(H+)+c(CH3COOH) 12. 下列反应中,反应后固体物质增重的是( ) A.氢气通过灼热的CuO粉末 B.二氧化碳通过Na2O2粉末 C.铝与Fe2O3发生铝热反应 D.将锌粒投入Cu(NO3)2溶液 13.室温下,用0.100mol/L NaOH溶液分别滴定20.00ml 0.100mol/L的盐酸和醋酸, 滴定曲线如图所示,下列说法正确的是 A、Ⅱ表示的是滴定醋酸的曲线 B、PH=7时,滴定醋酸消耗V(NaOH)小于20ml C、V(NaOH) =20ml时,C(Cl-)== C(CH3COO-) D、V(NaOH) =10ml时,醋酸溶液中: C(Na+)>C(CH3COO-)>C(H+)>C(OH-) 27. (12分)五种短周期元素A、B、C、D、E,原子序数逐渐增大,A的氢化物与其最高价 氧化物的水化物反应生成一种盐,B的最外层电子数是次外层电子数的3倍,C、D、E 同处另一周期.C、B可按原子个数比2:1和1:1分别形成两种离子化合物甲和乙.E 是地壳中含量最多的金属元素.根据以上信息回答下列问题: (1)E的原子结构示意图 , D在周期表中的位置 (2)用电子式表示物质甲的形成过程 . (3)C的最高价氧化物的水化物与E的最高价氧化物的水化物能发生反应,写出发生反应 的化学方程式 . (4) A、B、C、D的简单离子半径的大小关系 .(用真实的离子符号表示)(5)将D、E的单质插入NaOH溶液中,构成原电池,其负极反应是 . 28.(16分)Ⅰ.已知在室温下的电离常数分别为: ① NH3.H2O Kb=1.7×10-5 mol•L-1 ② CH3COOH Ka=1.7×10-5 mol•L-1 ③ H2CO3 Ka1=4.4×10-7mol•L-1 Ka2=4.7×10-11 mol•L-1 (1)在CH3COONH4溶液中,c(NH4+) c(CH3COO-)(填“>”、“<”、“=”),NH4HCO3溶液呈 性。(填“酸”、“碱”、“中”)。 (2) 完成NH4HCO3溶液中的下列表达式 电荷守恒式:c(NH4+)+c(H+)= 。 (3) 已知1mol/LCH3COOH溶液与1mol/LCH3COONa溶液等体积混合后,c(CH3COO-)>c(Na+)。 ① c(H+) c(OH-)(填“>”、“<”、“=”)。 ② c(CH3COOH)+c(CH3COO-)= mol•L-1 Ⅱ.二甲醚是一种重要的清洁燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用。工业上可利用煤的气化产物(水煤气)合成二甲醚。请回答下列问题: (1)煤的气化(工业制水煤气)的主要化学反应方程式为:___________________________。 (2)煤燃烧过程中产生的有害气体SO2用Na2CO3溶液吸收,生成两种酸式盐,该反应的化学方程式为:________________________________________。 (3) 利用水煤气合成二甲醚的三步反应如下: ① 2H2(g) + CO(g) CH3OH(g);ΔH =-90.8 kJ·mol-1 ② 2CH3OH(g) CH3OCH3(g) + H2O(g);ΔH=-23.5 kJ·mol-1 ③ CO(g) + H2O(g) CO2(g) + H2(g);ΔH=-41.3 kJ·mol-1 总反应:3H2(g) + 3CO(g) CH3OCH3(g) + CO2 (g)的ΔH= ___________; 29.(14分)Ⅰ、将物质的量均为3.00mol物质A、B混合于5L容器中,发生如下反应: 3A+B2C,在反应过程中C的物质的量分数随温度变化如右图所示: (1)T0对应的反应速率v(正) v(逆)(用“=”、“>”或“<”表示,下同); (2)此反应的正反应为 热;(填“放”或“吸”) (3)X、Y两点A物质正反应速率的大小关系是Y X; (4)温度T<T0时,C%逐渐增大的原因是: ; (5)若Y点的C的物质的量分数为25%,则参加反应的A物质的量为 mol; Ⅱ、现有反应:CO(g)+H2O(g)CO2(g)+H2(g) ΔH<0,在850℃时,K=1。 (1)若升高温度到950℃,达到平衡时K________(填“大于”、“小于”或“等于”)1。 (2)850℃时,若向一容积可变的密闭容器中同时充入1.0 mol CO,3.0 mol H2O,1.0 mol CO2和5mol H2,则:上述反应向________(填“正反应”或“逆反应”)方向进行。 30.(16分)某粗氧化铜样品中含少量氧化亚铁及不溶于酸的杂质,某化学兴趣小组利用该样品制取胆矾晶体,测定胆矾晶体中结晶水的含量,并计算样品中氧化铜的含量,设计了如下方案进行实验。 查阅资料知Fe3+、Cu2+、Fe2+在水溶液中形成氢氧化物沉淀的pH范围如下: 请回答下列问题: (1)硫酸铜溶液显酸性,用离子方程式解释原因___________________________。 (2)物质X应选用_________(填字母)。 a.氢氧化钠 b.双氧水 c.铁粉 d.高锰酸钾 (3)加入物质物质X后,需取少量溶液检验Fe2+是否已全部被氧化,能否用酸性的KMnO4 溶液? (填“能”或“不能”)理由是: 。 (用离子方程式说明) (4) 为保证沉淀Ⅱ沉淀完全,操作③中溶液pH的调节范围为 。 (5)操作④的步骤有 、冷却结晶、 、自然干燥。 (6)在进行操作④之前通常会向溶液中加入少量稀H2SO4酸化,主要目的是______________ (7)该小组一位同学根据实验结果求出样品中CuO的质量分数为,另一位同学不同意,其原因是 查看更多