2019-2020学年甘肃省张掖市临泽县第一中学高二9月月考化学试题 (Word版)
临泽一中 2019-2020 学年上学期 9 月月考试卷
高二化学
(考试时间:90 分钟 试卷满分:100 分)
测试范围:人教选修 4 第 1−2 章。
可能用到的相对原子质量:H 1 C 12 O 16 Na 23 Si 28 P 31 S 32 Cl 35.5 Fe 56
第Ⅱ卷
一、选择题:本题共 18 个小题,每小题 3 分。在每小题给出的四个选项中,只有一项是符合题目要求的。
1.化学与人类生活、社会可持续发展密切相关,下列措施有利于节能减排、保护环境的是
①加快化石燃料的开采与使用 ②研发易降解的生物农药 ③应用高效洁净的能源转换技术 ④田间焚烧秸秆 ⑤推广使用节能环保材料
A.①③⑤ B.②③⑤ C.①②④ D.②④⑤ 2.下列反应中,一定不能自发进行的是
A.2KClO3(s) 2KCl(s)+3O2(g) ΔH=−78.03 kJ·mol −1,ΔS=+1 110 J·mol −1·K −1
B.CO(g) C(s,石墨)+ 1 O2(g) ΔH=+110.5 kJ·mol −1,ΔS=−89.36 J·mol −1·K −1
2
C.4Fe(OH)2(s)+2H2O(l)+O2(g) 4Fe(OH)3(s) ΔH=−444.3 kJ·mol −1,ΔS=−280.1 J·mol −1·K −1
D.NH4HCO3(s)+CH3COOH(aq) CO2(g)+CH3COONH4(aq)+H2O(l) ΔH=+37.301 kJ·mol −1,
ΔS=+184.05 J·mol −1·K −1
3. 在化学反应A(g)+3B(g) 2C(g)+D(g)中,各物质的平均反应速率间的关系式正确的是A.v(A)=v(B) B.v(A)=2v(C) C.3v(B)=v(C) D.v(B)=3v(D)
4. 某实验小组学生用 50 mL 0.50 mol·L −1 盐酸与 50 mL 0.55 mol·L −1 NaOH 溶液在如图所示的装置中进行中和反应,通过测定反应过程中放出的热量计算中和热。下列说法正确的是
A. 实验过程中没有热量损失
B. 图中实验装置缺少环形玻璃搅拌棒
C. 烧杯间填满碎泡沫塑料的作用是固定小烧杯 D.酸或碱的物质的量越大,所测中和热的数值越大
5. 进行如下实验,在A锥形瓶中放入10g块状CaCO3 ,在B锥形瓶中放入5g粉末状CaCO3 ,分别加入
50mL2mol/L盐酸。下图中能正确表示实验结果的是
3. 已知 450℃时,2SO2(g)+O2(g) 2SO3(g) ΔH=−Q1。在相同条件下,向一密闭容器中通入 1 mol SO2
和 0.5 mol O2,达到平衡时放出的热量为 Q2,则 Q1、Q2 满足的关系是
A.Q2=Q1/2 B.Q2
Q1/2 D.不能确定
1 2 1
4. 在 36 g 碳不完全燃烧所得气体中,CO 占3体积,CO2 占3体积,且 C(s)+2O2(g)===CO(g) ΔH=-110.5
1
kJ/mol;CO(g)+2O2(g)===CO2(g) ΔH=-283 kJ/mol
与这些碳完全燃烧相比,损失的热量是
A.172.5 kJ B.1149 kJ
C.283 kJ D.566 kJ
5. 可逆反应 aA(g)+bB(g) cC(g)的正、逆反应速率可用各反应物或生成物浓度的变化来表示。下列各关系式中能说明反应已达到平衡状态的是
A. av 正(A)=bv 正(B) B.bv 正(A)=av 逆(B)
C.av 正(C)=cv 正(A) D.av 正 (A)=bv 逆 (B) 9.下列物质都能与金属钠反应放出H2,产生H2 的速率排序正确的是
①C2H5OH
A.③﹥②﹥①
②NaOH 溶液
③醋酸溶液
B.②﹥①﹥③
C.①﹥②﹥③
D.③﹥①﹥②
10. 已知下列热化学方程式:
①Fe2O3(s)+3CO(g)===2Fe(s)+3CO2(g) ΔH1=−26.7 kJ·mol−1
②3Fe2O3(s)+CO(g)===2Fe3O4(s)+CO2(g) ΔH2=−50.75 kJ·mol−1
③Fe3O4(s)+CO(g)===3FeO(s)+CO2(g) ΔH3=−36.5 kJ·mol−1
则反应 FeO(s)+CO(g)===Fe(s)+CO2(g)的焓变为
A.+7.28 kJ·mol −1 B.−7.28 kJ·mol −1
C.+43.68 kJ·mol −1 D.−43.68 kJ·mol −1
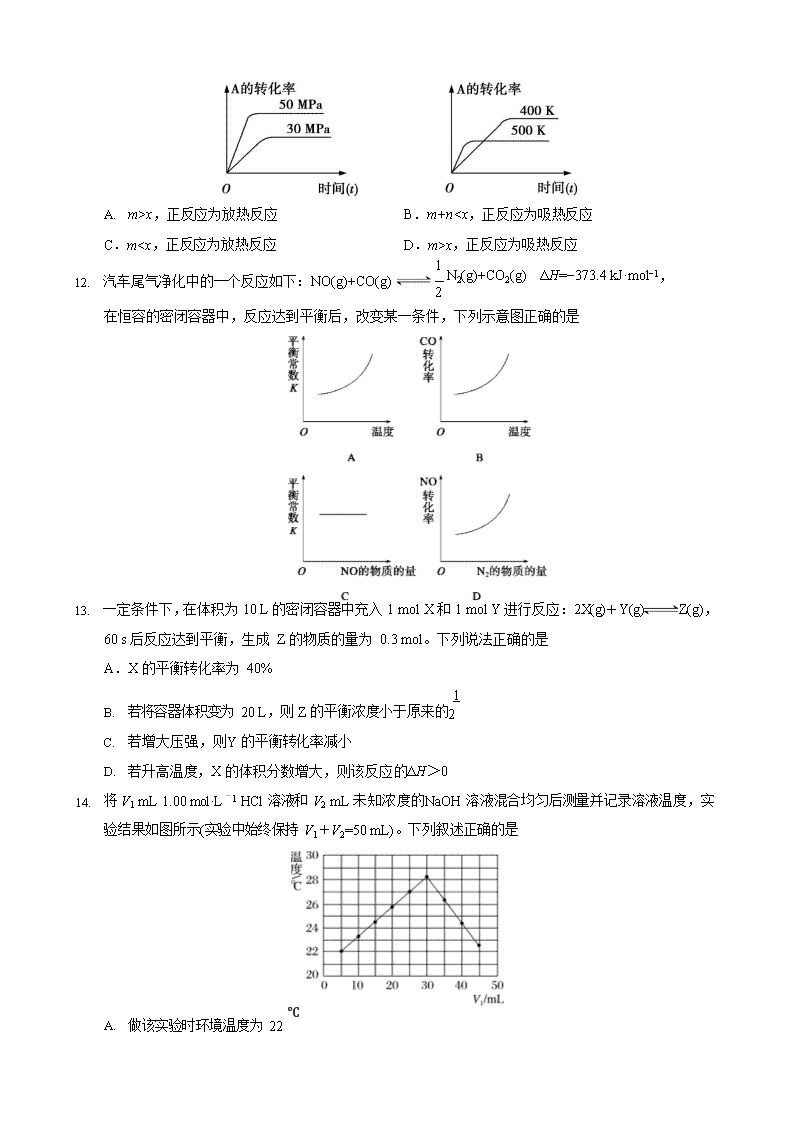
11. 如图表示可逆反应 mA(g)+nB(s) xC(g)在不同温度和压强下,反应物 A 的转化率变化情况。下列判断正确的是
A. m>x,正反应为放热反应 B.m+nx,正反应为吸热反应
11. 汽车尾气净化中的一个反应如下:NO(g)+CO(g)
�1 N2(g)+CO2(g) ΔH=−373.4 kJ·mol−1,
2
在恒容的密闭容器中,反应达到平衡后,改变某一条件,下列示意图正确的是
10. 一定条件下,在体积为 10 L 的密闭容器中充入 1 mol X 和 1 mol Y 进行反应:2X(g)+Y(g) Z(g),
60 s 后反应达到平衡,生成 Z 的物质的量为 0.3 mol。下列说法正确的是
A.X 的平衡转化率为 40%
1
B. 若将容器体积变为 20 L,则 Z 的平衡浓度小于原来的2
C. 若增大压强,则Y 的平衡转化率减小
D. 若升高温度,X 的体积分数增大,则该反应的ΔH>0
11. 将 V1 mL 1.00 mol·L -1 HCl 溶液和 V2 mL 未知浓度的NaOH 溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持 V1+V2=50 mL)。下列叙述正确的是
A. 做该实验时环境温度为 22 ℃
A. 该实验表明化学能可以转化为热能C.NaOH 溶液的浓度约为 1.00 mol·L -1
D.该实验表明有水生成的反应都是放热反应
11. 一定温度下,在容积为 2 L 的密闭容器中,X、Y、Z 三种气体的物质的量(n)随时间(t)变化的曲线如图所示。下列说法正确的是
A. 反应从开始到 10 s 时,用Z 表示的反应速率为 0.158 mol·L −1·s −1
B. 反应从开始到 10 s 时,X 的物质的量浓度减少了 0.79 mol·L −1
C. 反应从开始到 10 s 时,Y 的转化率为 79.0% D.反应的化学方程式为X(g)+Y(g) Z(g)
12. 在密闭容器中发生如下反应 mA(g)+nB(g) pC(g),达到平衡后,保持温度不变,将气体体积缩小
到原来的 1 ,当达到新平衡时,C 的浓度为原来的 1.9 倍,下列说法正确的是
2
A. m+n>p B.平衡向逆反应方向移动
C.A 的转化率提高 D.C 的体积分数增加
13. 在某一恒温、恒容的密闭容器中发生反应:3H2(g)+N2(g) 2NH3(g) ΔH<0。t1 时刻反应达到平衡, 在 t2 时刻改变某一条件,其反应过程如图所示。下列说法正确的是
A. Ⅰ、Ⅱ两过程达到平衡时,平衡常数:KⅠ
查看更多