- 2021-08-06 发布 |
- 37.5 KB |
- 9页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
高中化学58个精讲21碳族元素
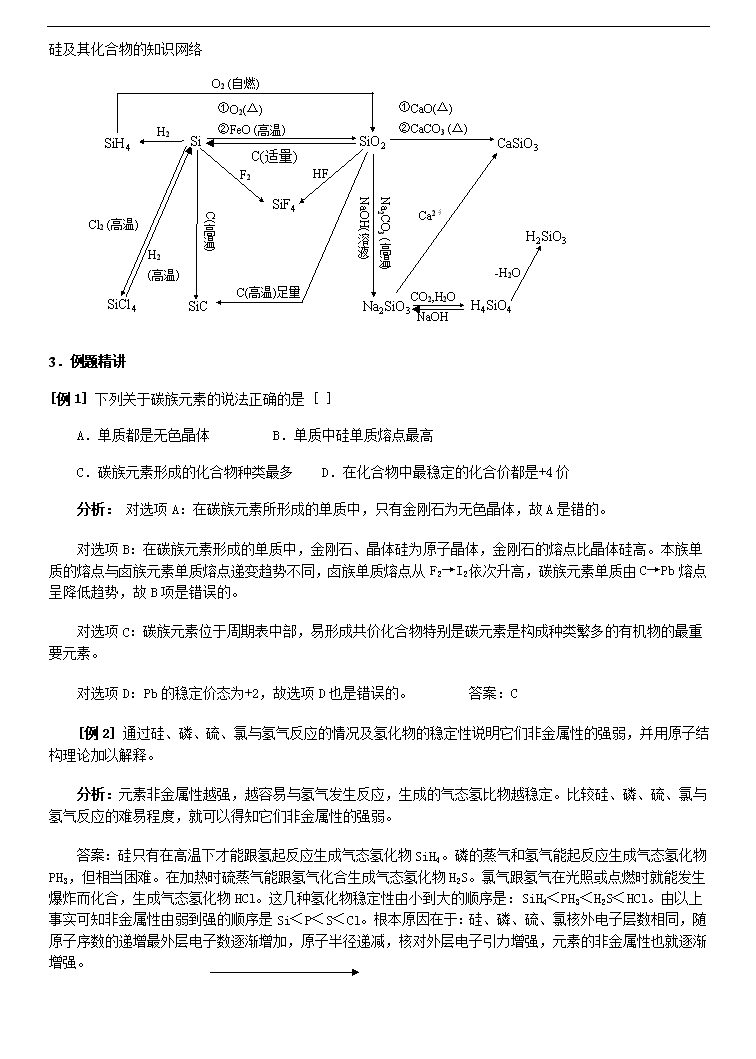
高中化学58个考点精讲 21、碳族元素.碳及其化合物 1.复习重点 1.碳族元素原子结构的特点、碳族元素化合价为正四价和正二价; 2.碳族元素的性质及其递变规律; 3.碳和硅的性质、用途。 2.难点聚焦 碳和硅的化学性质 化学性质 碳 硅 还原性 与单质反应 (不稳定) 与氧化物反应 与酸反应 不与、等反应,但有: 与水或碱溶液反应 与反应 专题三 二氧化碳和二氧化硅的结构、性质比较(见表7—7) 项目 类别 酸性氧化物 酸性氧化物 晶体类型 分子晶体 原子晶体 熔点和沸点 低 高,硬度大 化学性质 不溶于水,与水也不反应 联系 3 硅及其化合物的特性 1. Si的还原性大于C,但C却能在高温下还原出Si:也能发生。 10. Na2SiO3的水溶液称水玻璃,但它与玻璃的成分大不相同,硅酸钠水溶液(即水玻璃)俗称泡花碱,但它却是盐的溶液,并不是碱溶液。2. 非金属单质跟碱液作用一般无放出, 但Si却放出H2: 3. 非金属单质一般不跟非氧化性酸作用,但Si能与HF作用: 4. 非金属单质一般为非导体,但Si为半导体。 5. SiO2是的酸酐,但它不溶于水,不能直接将它与水作用制备H2SiO3。 6. 非金属氧化物的熔沸点一般较低,但SiO2的却很高。 7. 酸性氧化物一般不与酸作用,但SiO2能跟HF作用: 8. 无机酸一般易溶于水, 却难溶于水。 9. 因H2CO3的酸性大于H2SiO3,所以在Na2SiO3溶液中通入CO2能发生下列反应: , 但在高温下 4 硅与碱溶液的反应特点 硅与强碱溶液反应的实质是什么?究竟哪种物质是氧化剂?根据化学方程式: 进行分析,似乎和都是氧化剂,其实不然。上述反应实际分两步进行 ① ② 其中反应①为氧化还原反应,反应②为非氧化还原反应。合并①②两式得总反应方程式。其中NaOH既不是氧化剂,也不是还原剂,只是反应物、起氧化作用的只是H2O。所以H2O是①式的氧化剂,也是总反应的氧化剂。为表示反应的实质(或要求标出电子转移方向和数目时),可写成: 11.碳及其化合物的知识网络 C CO2 CaCO3 CaC2 C2H2 CO 有机物 NH4HCO3 CH4 H2CO3 Na2CO3 NaHCO3 O2 SiC 、CCl4 不完全燃烧 O2(不足) O2 (不足) ①O2 ②CuO 炽 热的碳 NH3·H2O O2 (点燃) △ H2O CaO △ Si、Cl2 (△) Mg (点燃) ①O2 (点) ②CuO (△) C、CO Na2O2 NaOH H2O NaOH H+ Ca(OH)2 ①高温②H+ Ca2+ CO2 、H2O △ Ca(OH)2 CO2 (水) ①OH― ②加热 Ca(HCO3)2 硅及其化合物的知识网络 Na2SiO3 CO2,H2O NaOH H2SiO3 SiH4 Si SiO2 CaSiO3 SiF4 H4SiO4 SiC SiCl4 O2 (自燃) H2 ①O2(△) ②FeO (高温) F2 HF Cl2 (高温) H2 (高温) C(高温) C(高温)足量 Na2CO3 (高温) NaOH(溶液) ①CaO(△) ②CaCO3 (△) Ca2+ -H2O C(适量) 3.例题精讲 [例1] 下列关于碳族元素的说法正确的是 [ ] A.单质都是无色晶体 B.单质中硅单质熔点最高 C.碳族元素形成的化合物种类最多 D.在化合物中最稳定的化合价都是+4价 分析: 对选项A:在碳族元素所形成的单质中,只有金刚石为无色晶体,故A是错的。 对选项B:在碳族元素形成的单质中,金刚石、晶体硅为原子晶体,金刚石的熔点比晶体硅高。本族单质的熔点与卤族元素单质熔点递变趋势不同,卤族单质熔点从F2→I2依次升高,碳族元素单质由C→Pb熔点呈降低趋势,故B项是错误的。 对选项C:碳族元素位于周期表中部,易形成共价化合物特别是碳元素是构成种类繁多的有机物的最重要元素。 对选项D:Pb的稳定价态为+2,故选项D也是错误的。 答案:C [例2] 通过硅、磷、硫、氯与氢气反应的情况及氢化物的稳定性说明它们非金属性的强弱,并用原子结构理论加以解释。 分析: 元素非金属性越强,越容易与氢气发生反应,生成的气态氢比物越稳定。比较硅、磷、硫、氯与氢气反应的难易程度,就可以得知它们非金属性的强弱。 答案:硅只有在高温下才能跟氢起反应生成气态氢化物SiH4。磷的蒸气和氢气能起反应生成气态氢化物PH3,但相当困难。在加热时硫蒸气能跟氢气化合生成气态氢化物H2S。氯气跟氢气在光照或点燃时就能发生爆炸而化合,生成气态氢化物HCl。这几种氢化物稳定性由小到大的顺序是:SiH4<PH3<H2S<HCl。由以上事实可知非金属性由弱到强的顺序是Si<P<S<Cl。根本原因在于:硅、磷、硫、氯核外电子层数相同,随原子序数的递增最外层电子数逐渐增加,原子半径递减,核对外层电子引力增强,元素的非金属性也就逐渐增强。 [例3] 最近,科学家研制得一种新的分子,它具有空心的类似足球状结构,化学式为C60,下列说法正确的是 [ ] A.C60是一种新型的化合物 B.C60和石墨都是碳的同素异形体 C.C60中含离子键 D.C60的式量是720 分析: 足球烯C60是课本正文中未曾学到过的,但只要明确单质、化合物、同素异形体、化学键、式量的概念,对各选项进行认真辩析,不难作答。C60是由同种元素(碳)组成的纯净物,属于单质;碳原子之间以共价键相结合;C60和石墨都是由碳元素形成的不同单质,都是碳的同素异形体,C60的式量=12×60=720。解题方法为概念辩析法。 答案:BD [例4] 如果发现114号新元素(位于第7周期IVA族),下列有关X可能具有的性质合理的是 [ ]。 A.X是非金属元素 B.X的+2价化合物比+4价化合物稳定 C.XO2具有强氧化性 D.X有稳定的气态氢化物 分析:根据碳族元素性质递变规律,可推知114号元素的金属性比铅还强,一定是金属元素。它的稳定价态应与铅相同,即为+2价,所以XO比XO2稳定。X4+离子另得电子变成X2+,所以XO2具有强氧化性。X是金属元素,不可能存在稳定的气态氢化物。 答案:BC [例5] 近年来,科学家在氦的气氛中给石墨电极通电,石墨挥发,在其挥发的黑烟中发现了C60,它与金刚石互称①。它是一种具有空心类似足球状结构的新分子,碳原子之间存在②键,它的摩尔质量是③,而金刚石是一种④结构的⑤晶体,碳原子间通过⑥键结合,含有碳原子构成的环,则最小环上有⑦(填数字)个碳原子,每个碳原子上的两个碳碳键的夹角都是⑧(填角度)。 分析:从C60分子组成便知,它是由碳元素组成的一种单质,与金刚石互为同素异形体。在分子中,碳原子与碳原子之间以共价键结合,它的摩尔质量可由化学式求,即12×60=720g/mol。金刚石是一种正四面体型空间网状结构,晶体中一个碳原子位于正四面体中心,四个碳原子以共价键与它结合,分别位于正四面体的四个顶点上。形成最小的环,含的碳原子数必须通过平时分析教材中插图或模型而知,键角为109°28′。本题着重考学生同素异形体概念及培养三维空间思维能力。 答案:①同素异形体②共价③720g/mol④空间网状⑤原子⑥共价⑦6⑧109°28′。 [例6] 二氧化硅的熔沸点较高的原因是 [ ] A.二氧化硅中,硅氧原子个数之比为1∶2 B.二氧化硅晶体是立体网状的原子晶体 C.二氧化硅中,SI-O键的键能大 D.二氧化硅晶体中原子以共价键相结合 分析:此题难度不大,但涉及二氧化硅晶体结构的重点知识。二氧化硅熔沸点较高的原因,是由于其晶体里SI-O键的键能很高,并形成了一种立体网状的原子晶体,熔融它需消耗较多的能量。所以,本题应选B、C两个选项。 答案:BC [例7] 下列说法正确的是 [ ] A.二氧化硅溶于水显酸性 B.二氧化碳通入水玻璃中可以得到原硅酸 C.因为高温时二氧化硅与碳酸钠反应放出二氧化碳,所以硅酸的酸性比碳酸强 D.二氧化硅是酸性氧化物,它不溶于任何酸 分析:此题是关于硅及其化合物性质的选择题,宜采用筛选法。 A.SiO2很难溶于水,无法显酸性。 B.原硅酸酸性比碳酸弱,CO2通入水玻璃(Na2SiO3溶液)会发生强酸制取弱酸的复分解反应: Na2SiO3+2H2O+CO2==Na2CO3+H4SiO4↓ C.高温时如下反应可以进行:SiO2+Na2CO3==Na2SiO3+CO2↑ 但因为CO2成气态逸出,并不说明硅酸比碳酸强,硅酸和碳酸酸性强弱的比较是指在水溶液中的情况。 D.SiO2可以溶于氢氟酸中,这是SiO2的一个重要特性。SiO2+4HF==SiF4↑+2H2O 答案:B [例8] 碳化硅(SiC)的一种晶体具有类似金刚石的结构,其中碳原子和硅原子的位置是交替的。在下列三种晶体①金刚石、②晶体硅、③碳化硅中,它们的熔点从高到低的顺序是: [ ] A. ①③② B. ②③① C. ③①② D. ②①③ 分析:此题是给出新情境的信息迁移题。给出的新情境,是碳化硅的一种晶体具有类似金刚石的结构;此题的考查内容,是化学键与晶体结构。 所列三种晶体均是原子晶体,结构相似,晶体内的结合力是呈空间网状的共价键: 共价键键长:C—C键<C—Si键<Si—Si键 共价键键能:C—C键>C—Si键>Si—Si键 共价键键长越短,键能越大,则原子晶体的熔点越高。所以三者的熔点由高到低的顺序是:金刚石、碳化硅、晶体硅。 答案:A [例9] 物质A是一种高熔点化合物,不溶于硫酸,硝酸等强酸。A与纯碱熔融反应,生成化合物B,同时放出气体C;把气体C通过B的溶液中,则得到化合物D;D在干燥空气中转变为化合物E;将E加热又得到化合物A。试写出A、B、C、D、E的化学式:A____、B____、C____、D____、E____。 分析:此题应根据对实验现象的分析,得出结论。A是不溶于硫酸、硝酸等强酸的高熔点化合物,它能与纯碱熔融反应,而且放出气体C,可初步判断A可能是SiO2,B可能是Na2SiO3,C可能是CO2。若把CO2通过Na2SiO3溶液中,会得到胶状沉淀H4SiO4,H4SiO4在干燥空气中易脱水生成H2SiO3,H2SiO3只有加热才能生成SiO2。这些都是与题目所给出的实验现象相符合,这就证实A确实是SiO2。A判断出来了,其它物质的推断就迎刃而解。 答案:A:SiO2、B:Na2SiO3、C:CO2、D:H4SiO4、E:H2SiO3 [例10] 下列关于二氧化硅的说法是否正确?简释理由。 A.二氧化硅分子是由1个硅原子和两个氧原子构成; B.二氧化硅又叫硅酐; C.二氧化硅与水化合生成对应水化物硅酸; D.二氧化硅为酸酐与碱反应不与酸反应; E.二氧化硅与碳酸钠反应生成CO2,所以硅酸酸性比碳酸强。 分析:判断是非题,一般属于概念性知识多,判断的正确率决定于掌握知识的正确性和完整性。A错,二氧化硅为原子晶体,晶体是氧原子与硅原子个数比为2∶1的网状主体结构,没有分子,SiO2为化学式而非分子式; B对,二氧化硅是硅酸的酸酐; C错,二氧化硅是不溶于水的酸酐; D错,二氧化硅为酸酐,具有酸酐的通性,能于碱反应,但二氧化硅具有特性,可与氢氟酸反应; E错,二氧化硅与碳酸钠反应生成硅酸钠是在高温,利用CO2的挥发性,促使反应完成,并不能说明硅酸酸性强于碳酸。 答案:B [例11] (1)怎样用化学方法检验生石灰里混有的石英和石灰石?并写出有关的化学方程式。 (2)怎样用一种试剂鉴别硅酸钠、硫酸钠、碳酸钠3瓶未知液?并写出实验现象及结论。 分析:(1)生石灰的成分是氧化钙,若不含杂质,加盐酸能完全溶解并且无气体生成。加盐酸充分反应后仍有不溶于水的固体,说明有石英杂质存在。加盐酸溶解,但放出无色无味并能使石灰水变浑的气体,说明生石灰中含有石灰石。 CaO+2HCl=CaCl2+H2O CaCO3+2HCl=CaCl2+H2O+CO2↑ CO2+Ca(OH)2=CaCO3↓+H2O (2)三种未知液均为钠盐,故应根据酸根离子的特性选择鉴别方法。碳酸盐和硅酸盐都能与盐酸反应,但现象不同,所以能用盐酸鉴别。用三支小试管分别取三种未知液各少许,分别滴加稀盐酸,有气体生成的是碳酸钠溶液,有白色胶状沉淀生成的是硅酸钠溶液,无明显现象的是硫酸钠溶液。 答案:见分析 [例12] 如何用所提供的试剂和方法除去各粉末状混合物中的杂质(括号内为杂质)。将所选答案的编号填入在表内相应的空格内(如果不需要外加试剂,则对应答案栏可空着)。 1.可供选择的试剂:A.盐酸 B.氢氧化钠溶液 C.氧气D.水 E.二氧化碳 Ⅰ.可选用的操作:①水洗 ②加热 ③高温灼烧 ④过滤 ⑤结晶 分析:可根据二氧化硅是不溶于水的酸性氧化物;它可跟强碱反应,不跟酸(氢氟酸除外)反应;它受热不分解等性质。而三氧化二铁,碳酸钙跟盐酸反应;硅酸、氯化铵能受热分解。通过一定操作,除去杂质。除杂过程中所发生的化学方程式如下: (1)SiO2+2NaOH==Na2SiO3+H2O (3)Fe2O3+6HCl==2FeCl3+3H2O (4)CaCO3+2HCl==CaCl2+CO2↑+H2O (5)H2SiO3SiO2+H2O (6)NH4ClNH3↑+HCl↑ 答案:(1)B,④ (2)D,④,⑤ (3)A,④ (4)A,④ (5)③ (6)② [例13] 锗是ⅣA族元素,它的单质晶体是一种良好的半导体材料,广泛用于电子工业,锗可以从燃烧的烟道灰中提取,其过程如下: 试写出上述过程中①、③、④步反应的化学方程式。 ①_________________; ③_________________; ④_________________; 分析:Ge为ⅣA族,最高正价为+4价,其氧化物为GeO2,又+4价稳定,与盐酸不发生氧化还原反应,只发生碱性氧化物与酸的反应。锗酸的化学式用硅酸迁移即得:H4GeO4或H2GeO3。 ①GeO2+4HCl==GeCl4+2H2O ③H4GeO4GeO2+2H20 (或H2GeO3GeO2+H2O) ④GeO2+2H2Ge+2H2O 答案:见分析 4.实战演练 一、选择题 1.以下气体因与人体的血红蛋白作用而引起中毒的是 A.Cl2 B.SO2 C.H2S D.CO 2.对反应方程式:SiO2+3CSiC+2CO↑,有关叙述正确的是 A.反应中SiO2是氧化剂,C只作还原剂 B.Si4+被还原了,而C只被氧化了 C.在反应中C既是氧化剂又是还原剂 D.在反应中氧化剂与还原剂的物质的量之比为1∶2 3.实验室用石灰石和盐酸制取CO2时,最佳的除杂试剂和方法是 A.水、浓H2SO4、洗气 B.饱和Na2CO3溶液、浓H2SO4、洗气 C.饱和NaHCO3溶液、浓H2SO4、洗气 D.NaOH溶液、浓H2SO4、洗气 4.下列各组物质中不起反应的是 A.SiO2与纯碱共熔 B.CO2通入Na2SiO3溶液C.SiO2与大理石共熔D.SiO2和浓H2SO4共热 5.将4.14 g Pb经充分氧化后得到氧化物的质量为4.46 g,则生成的氧化物化学式为 A.PbO2 B.Pb3O4C.PbO D.Pb2O5 6.由10 g含有杂质的CaCO3和足量盐酸反应,产生了0.1 mol CO2,推断杂质的组成可能是 A.KHCO3和MgCO3 B.K2CO3和Na2CO3C.MgCO3和Na2CO3 D.Na2CO3和NaHCO3 7.某二价金属的碳酸盐和碳酸氢盐的混合物与足量盐酸反应。消耗H+和产生CO2的物质的量之比为5∶4,该混合物中碳酸盐和碳酸氢盐的物质的量之比为 A.1∶2 B.2∶3C.3∶4 D.4∶5 8.将m g CaCO3与n g KHCO3分别加入100 mL 0.5 mol·L-1的盐酸中,若反应后两种溶液的质量相等,则m与n的关系是 A.m=n≤2.5 B.m=n>2.5C.m=n≥5 D.m<n<2.5 9.把100 g Na2CO3和NaHCO3的混合物同足量的盐酸反应,放出22.4 L(标准状况)的CO2,则混合物中Na2CO3的质量分数是 A.68.9% B.70.3% C.73.5% D.77.1% 10.把x mol CO2通入含y mol Ca(OH)2的澄清石灰水中充分反应,下列叙述中错误的是 A.当x≤y时,生成100x g沉淀C.当y<x<2y时,生成100(2y-x) g沉淀 B.当x≥y时,生成100y g沉淀D.当x≥2y时,产生的沉淀全部溶解 11.下列关于硅的说法不正确的是 A.硅是非金属元素,它的单质是灰黑色有金属光泽的固体 B.硅的导电性能介于金属和绝缘体之间,是良好的半导体材料 C.硅的化学性质不活泼,常温下不与任何物质起反应 D.加热到一定温度时,硅能与氢气、氧气等非金属反应 12.下列物质中能与二氧化硅起化学反应的是 ①浓硝酸 ②水 ③王水 ④氢氟酸 ⑤KOH溶液 A.①② B.②④ C.④⑤ D.③④ 13.能证明金刚石和石墨属于同素异形体的事实是 A.都具有较高的熔点 C.在O2里充分燃烧都只生成CO2 B.都难溶于一般的溶剂 D.在一定条件下,金刚石和石墨可以相互转化 14.由CO2和CO组成的混合气体,经分析测知含氧质量分数为70%,则该混合气体中CO和CO2的体积比为 A.1∶3 B.7∶33 C.33∶7 D.3∶1 15.将CO2通入下列物质的溶液中不与其反应的是 ①Na2CO3 ②Na2SiO3 ③NaAlO2 ④C6H5ONa⑤Ca(ClO)2 ⑥CaCl2 ⑦CaCO3 A.①③④⑤⑥ B.①和⑥ C.只有① D.只有⑥ 16.已知金刚砂SiC是原子晶体,则①金刚石②晶体硅③SiC,三者的熔沸点高低顺序正确的是 A.①>③>② B.③>②>①C.②>①>③ D.③>①>② 17.某混合气体的质量百分组成为CO占22%、O2占48%、N2占20%、H2占10%,则此混合气体的平均式量为 A.27.32 B.12.5C.20.17 D.17.95 二、非选择题(共49分) 18.(14分)将n mol木炭粉和1 mol FeO在反应器中混合,隔绝空气加强热。 (1)可能发生的化学反应有: ①FeO+C===Fe+CO↑ ②2FeO+C===2Fe+CO2↑ ③FeO+CO===Fe+CO2↑ ④ (2)若n<,充分反应后,反应器中的固体物质是 ,气体产物是 。 (3)若n>1,充分反应后,反应器中的固体物质是 ,气体产物是 。 (4)若反应的气体产物是混合物,n的取值范围是 。 (5)若反应的气体产物是混合物,且混合物中CO和CO2的物质的量相等,则n的值为 。 19.(8分)水蒸气通过灼热的煤所产生的混合气,其主要成分是CO、H2,还含有CO2和水蒸气。请用下列装置设计一个实验,以确认上述混合气中含有CO和H2。 (1)上图所示装置的正确连接顺序是(填各接口的代码字母): 混合气→( )( )接( )( )接( )( )接( )( )接( )( )。 (2)确认混合气体中含有H2的实验现象是 。其理由是 。 20.(12分)(2002年全国高考理综试题)在25℃,101 kPa条件下,将15 L O2通入10 L CO和H2的混合气体中,使其完全燃烧,干燥后,恢复至原来的温度和压强。 (1)若剩余气体的体积是15 L,则原CO和H2的混合气体中,V(CO)= L, V(H2)= L。 (2)若剩余气体的体积为a L,则原CO和H2的混合气体中,V(CO)∶V(H2)= 。 (3)若剩余气体的体积为a L,则a的取值范围是 。 21.(7分)将CO2通入0.02 mol 氢氧化钠的溶液中,产物在低温低压下蒸干,得到固体物质1.37 g。由此计算通入的CO2在标准状况下的体积是多少L? 22.(8分)C和CaCO3的混合物在空气中加强热后,CaCO3完全分解,C被完全氧化,若生成物中CO2的质量与原混合物的质量相等,求原混合物中C的质量分数。 附参考答案 一、1.D 2.C 3.C 4.D 5.解析:4.14 g Pb为0.02 mol,而反应中增加氧的质量为:4.46 g-4.14 g=0.32 g,即0.02 mol,所以Pb和O的原子个数之比为1∶1。 答案:C 6.解析:看式量,要一个大于100,一个小于100即可。答案:CD 7.B 8.A 9.D 10.B 11.C 12.C 13.C 14.D 15.D 16.A 17.B 二、18.(1)CO2+C===2CO (2)Fe和FeO CO2 (3)Fe和C CO (4)<n<1 (5)2/3 19.(1)(E)(F)接(C)(D)接(A)(B)[或(B)(A)]接(I)(J)接(G)(H) (2)黑色CuO变红,无水硫酸铜变蓝 因为H2通过灼热的CuO后生成Cu和水蒸气,水蒸气使无水CuSO4变蓝。 20.(1)5 5 (2)(a-10)∶(20-a) (3)10<a<20 21.0.336 L 22.17.35%查看更多