- 2021-08-06 发布 |
- 37.5 KB |
- 5页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2018届一轮复习人教版铁及化合物教案
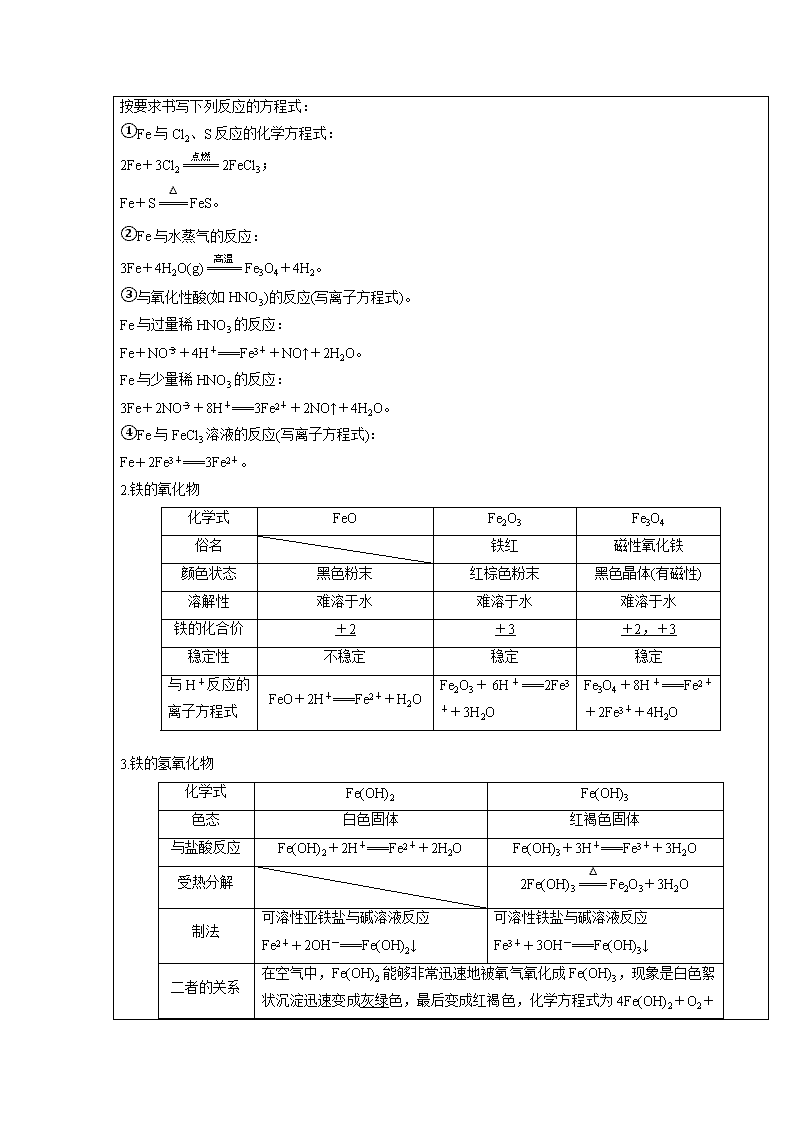
星期 第 节 年 月 日 课题 铁及其化合物 教 学 目 的 知识 技能 1.了解铁及其重要化合物的主要性质及其应用。2.能鉴别溶液中的Fe2+、Fe3+。 过程 方法 通过讲授法的形式,让学生学会梳理知识。 情感态度价值观 掌握一轮复习中系统学习的方法 重 点 1.了解铁及其重要化合物的主要性质及其应用。2.能鉴别溶液中的Fe2+、Fe3+。 难 点 1.了解铁及其重要化合物的主要性质及其应用。2.能鉴别溶液中的Fe2+、Fe3+。 学情分析 目前,学生已经进入到一轮复习有一段时间,对于元素化合物的学习也掌握了基本的方法,所以老师只要对知识点进行系统的归纳,学生再进行应用知识点进行强化训练基本就可以。目前配备的资料正好有基础练习部分,也有难点突破部分。 教学过程 一、铁的单质、氧化物和氢氧化物 1.铁 (1)物理性质 银白色固体,熔点较高,具有良好的导热、导电、延展性,能被磁铁吸引。 (2)结构 (3)化学性质 铁元素性质活泼,有较强的还原性,主要化合价为+2价和+3价。 按要求书写下列反应的方程式: ①Fe与Cl2、S反应的化学方程式: 2Fe+3Cl22FeCl3; Fe+SFeS。 ②Fe与水蒸气的反应: 3Fe+4H2O(g)Fe3O4+4H2。 ③与氧化性酸(如HNO3)的反应(写离子方程式)。 Fe与过量稀HNO3的反应: Fe+NO+4H+===Fe3++NO↑+2H2O。 Fe与少量稀HNO3的反应: 3Fe+2NO+8H+===3Fe2++2NO↑+4H2O。 ④Fe与FeCl3溶液的反应(写离子方程式): Fe+2Fe3+===3Fe2+。 2.铁的氧化物 化学式 FeO Fe2O3 Fe3O4 俗名 铁红 磁性氧化铁 颜色状态 黑色粉末 红棕色粉末 黑色晶体(有磁性) 溶解性 难溶于水 难溶于水 难溶于水 铁的化合价 +2 +3 +2,+3 稳定性 不稳定 稳定 稳定 与H+反应的离子方程式 FeO+2H+===Fe2++H2O Fe2O3+6H+===2Fe3++3H2O Fe3O4+8H+===Fe2++2Fe3++4H2O 3.铁的氢氧化物 化学式 Fe(OH)2 Fe(OH)3 色态 白色固体 红褐色固体 与盐酸反应 Fe(OH)2+2H+===Fe2++2H2O Fe(OH)3+3H+===Fe3++3H2O 受热分解 2Fe(OH)3Fe2O3+3H2O 制法 可溶性亚铁盐与碱溶液反应 Fe2++2OH-===Fe(OH)2↓ 可溶性铁盐与碱溶液反应 Fe3++3OH-===Fe(OH)3↓ 二者的关系 在空气中,Fe(OH)2能够非常迅速地被氧气氧化成Fe(OH)3,现象是白色絮状沉淀迅速变成灰绿色,最后变成红褐色,化学方程式为4Fe(OH)2+O2 +2H2O===4Fe(OH)3 4.防止Fe(OH)2氧化的方法 (1)将配制溶液的蒸馏水煮沸,驱除溶液中的氧气。 (2)将盛有NaOH溶液的胶头滴管尖端插入试管的亚铁盐溶液底部,并慢慢挤出NaOH溶液。 (3)在亚铁盐溶液上面充入保护气,如H2、N2、稀有气体等。 (4)在亚铁盐溶液上面加保护层,如苯、植物油等。 (5)用Fe作阳极,石墨作阴极,电解NaOH溶液,利用新产生的Fe2+与OH-反应制取。 二、Fe2+、Fe3+的性质及检验 1.亚铁盐 (1)Fe2+的氧化性和还原性 含有Fe2+的溶液呈浅绿色,Fe2+处于铁的中间价态,既有氧化性,又有还原性,其中以还原性为主,如:遇Br2、Cl2、H2O2、NO(H+)等均表现为还原性。 Fe2+的酸性溶液与H2O2反应的离子方程式:2Fe2++H2O2+2H+===2Fe3++2H2O。 (2)可水解 Fe(OH)2是弱碱,含Fe2+的盐(如硫酸亚铁)溶液呈酸性。配制硫酸亚铁溶液时常加少量硫酸抑制Fe2+的水解,加少量铁屑防止Fe2+被氧化。 2.铁盐的性质及应用 (1)氧化性:含有Fe3+的溶液呈棕黄色,Fe3+处于铁的高价态,遇Fe、Cu、HI、H2S等均表现为氧化性。 ①Fe3+与S2-、I-、HS-、SO等具有较强还原性离子不能大量共存。 ②Fe3+可腐蚀印刷电路板上的铜箔,反应的离子方程式为2Fe3++Cu===Cu2++2Fe2+。 (2)易水解:Fe(OH)3是很弱的碱,且溶度积很小,因而Fe3+极易水解,只能存在于酸性较强的溶液中。 ①利用Fe3+易水解的性质,实验室可用FeCl3滴入沸水中制取氢氧化铁胶体,反应的化学方程式:FeCl3+3H2OFe(OH)3(胶体)+3HCl。 ②利用Fe3+易水解的性质,工业上常用调节pH方法除去溶液中的铁离子。 ③利用Fe3+易水解的性质,实验室配制氯化铁溶液,通常将氯化铁固体先溶于较浓的盐酸中,然后再稀释至所需浓度。 ④Fe3+与HCO、AlO、CO、ClO-等水解呈碱性的离子不能大量共存。 3.Fe2+、Fe3+的检验方法 (1)用KSCN溶液和氯水 溶液 (2)用NaOH溶液 溶液 (3)含Fe2+、Fe3+的混合溶液中Fe3+、Fe2+的检验 溶液变红色,说明含有Fe3+ KMnO4溶液紫红色褪去,说明含有Fe2+。 (4)Fe2+的特征检验方法 溶液产生蓝色沉淀,说明溶液中含有Fe2+,3Fe2++2[Fe(CN)6]3-===Fe3[Fe(CN)6]2↓ 4.含Fe2+、Fe3+的除杂问题 主要成分 杂质 除杂方法 FeCl3(aq) FeCl2(aq) 加入氯水或H2O2 FeCl2(aq) FeCl3(aq) 加过量铁粉后过滤 FeCl2(aq) CuCl2(aq) 加过量铁粉后过滤 混合溶液中Fe3+、Fe2+的除去的常用方法 (1)除去Mg2+中混有的Fe3+的方法 向混合溶液中加入Mg、MgO、MgCO3、Mg(OH)2中之一,与Fe3+水解产生的H+反应,促进Fe3+的水解,将Fe3+转化为Fe(OH)3沉淀除去。 (2)除去Cu2+中混有的Fe3+的方法 向混合溶液中加入CuO、CuCO3、Cu(OH)2、Cu2(OH)2CO3中之一,与Fe3+水解产生的H+反应,促进Fe3+的水解,将Fe3+转化为Fe(OH)3沉淀而除去。 (3)除去Mg2+中混有的Fe2+的方法 先加入氧化剂(如H2O2)将溶液中的Fe2+氧化成Fe3+,然后再按(1)的方法除去溶液中的Fe3+。 (4)除去Cu2+中混有的Fe2+的方法 先加入氧化剂(如H2O2)将溶液中的Fe2+氧化成Fe3+,然后再按(2)的方法除去溶液中的Fe3+。 三、 Fe及其化合物的转化关系 “铁三角”的转化关系 完成下列变化的离子方程式,体会Fe2+与Fe3+转化条件。 (1)将H2S气体通入FeCl3溶液中产生淡黄色沉淀: H2S+2Fe3+===S↓+2Fe2++2H+。 (2)将FeCl3溶液滴入KI淀粉溶液,溶液变蓝: 2I-+2Fe3+===I2+2Fe2+。 (3)FeCl3可溶解铁片: 2Fe3++Fe===3Fe2+。 (4)FeSO4可使酸性KMnO4溶液褪色: 5Fe2++MnO+8H+===5Fe3++Mn2++4H2O。 (5)将FeCl2溶液滴入到HNO3溶液中,有无色气体放出: 3Fe2++NO+4H+===3Fe3++NO↑+2H2O。 作业布置: 大一轮学案、习案以及《加练半小时》微考点20 板书设计 一、 铁的单质、氧化物和氢氧化物 1、 铁 2、 铁的氧化物 3、 铁的氢氧化物 4、 防止Fe(OH)2氧化的方法 二、 Fe2+、Fe3+的性质及检验 1、 亚铁盐 2、 铁盐的性质及应用 3、Fe2+、Fe3+的检验方法 4、含Fe2+、Fe3+的除杂问题 三、Fe及其化合物的转化关系 教学反思:查看更多