- 2021-08-06 发布 |
- 37.5 KB |
- 18页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2017-2018学年安徽省六安市第一中学高二上学期期末考试化学试题 解析版
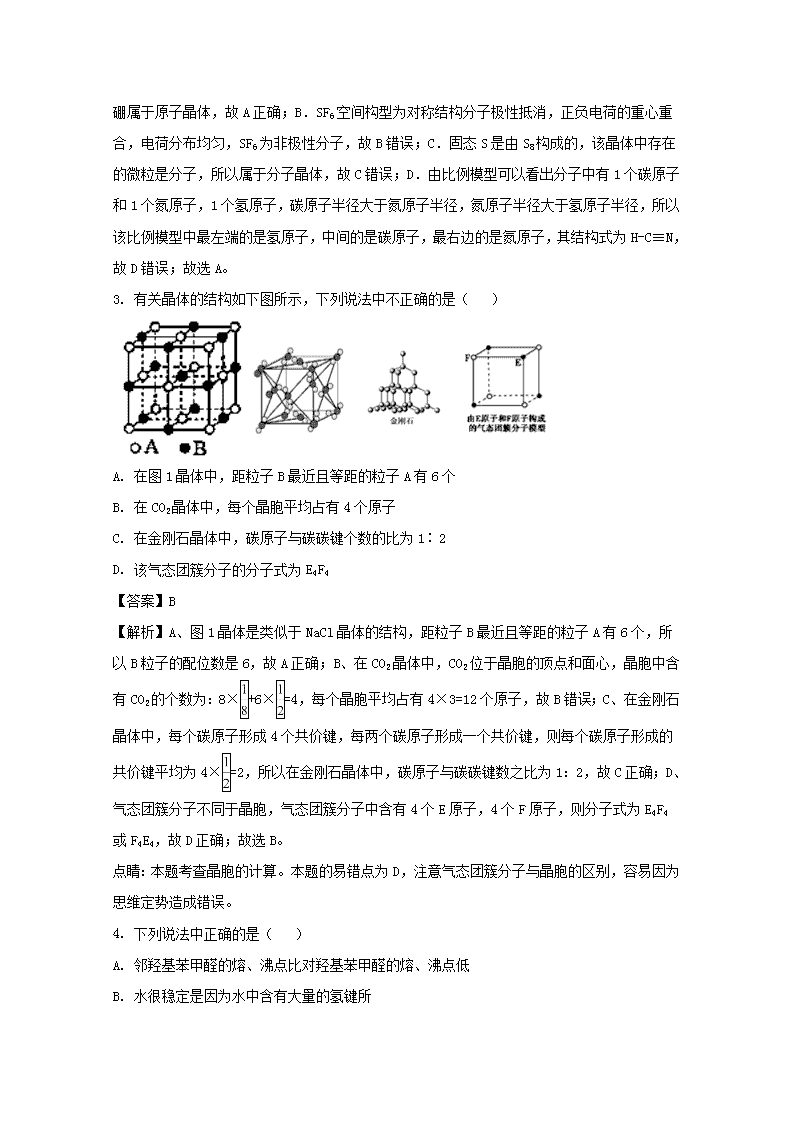
安徽省六安市第一中学2017-2018学年高二上学期期末考试化学试题 一、选择题(每小题3分,共48分,每小题仅有一个最佳答案) 1. 下列有关描述正确的是( ) A. 第一电离能: B>Be>Li B. 电负性: F>N>O C. Br-的核外电子排布式为: [Ar]4s24p6 D. 基态Ni 原子的价电子排布图: 【答案】D 【解析】A、Be元素最外层为半充满结构,较稳定,第一电离能最大,所以第一电离能:Be>B> Li,故A错误;B、非金属性越强电负性越大,所以电负性F>O>N,故B错误;C、35Br的电子排布式为1s22s22p63s23p63d104s24p5,则35Br的电子排布式可简写为[Ar]3d104s24p5,故C错误;D、Ni是28号元素,其核外电子排布式为:1s22s22p43s23p43d84s2,价电子数为10,价电子排布式为3d84s2,价电子排布图:,故D正确;故选D。 点睛:本题考查原子核外电子排布,明确原子序数及价电子排布是解答本题的关键。本题的易错点为A,注意电子排布规律及全满、半满为稳定结构。 2. 观察下列模型并结合有关信息,判断有关说法正确的是( ) B12结构单元 SF6分子 S8 HCN 结构模 型示意 图 备注 熔点1873 K — 易溶于CS2 — A. 单质硼属于原子晶体 B. SF6是由极性键构成的极性分子 C. 固态硫S8属于原子晶体 D. HCN的结构式为HC=N 【答案】A 【解析】A.由图知,每个B原子与周围的B原子均通过共价键连接,且熔点很高,因此单质硼属于原子晶体,故A正确;B.SF6空间构型为对称结构分子极性抵消,正负电荷的重心重合,电荷分布均匀,SF6为非极性分子,故B错误;C.固态S是由S8构成的,该晶体中存在的微粒是分子,所以属于分子晶体,故C错误;D.由比例模型可以看出分子中有1个碳原子和1个氮原子,1个氢原子,碳原子半径大于氮原子半径,氮原子半径大于氢原子半径,所以该比例模型中最左端的是氢原子,中间的是碳原子,最右边的是氮原子,其结构式为H-C≡N,故D错误;故选A。 3. 有关晶体的结构如下图所示,下列说法中不正确的是( ) A. 在图1晶体中,距粒子B最近且等距的粒子A有6个 B. 在CO2晶体中,每个晶胞平均占有4个原子 C. 在金刚石晶体中,碳原子与碳碳键个数的比为1∶2 D. 该气态团簇分子的分子式为E4F4 【答案】B 【解析】A、图1晶体是类似于NaCl晶体的结构,距粒子B最近且等距的粒子A有6个,所以B粒子的配位数是6,故A正确;B、在CO2晶体中,CO2位于晶胞的顶点和面心,晶胞中含有CO2的个数为:8×+6×=4,每个晶胞平均占有4×3=12个原子,故B错误;C、在金刚石晶体中,每个碳原子形成4个共价键,每两个碳原子形成一个共价键,则每个碳原子形成的共价键平均为4×=2,所以在金刚石晶体中,碳原子与碳碳键数之比为1:2,故C正确;D、气态团簇分子不同于晶胞,气态团簇分子中含有4个E原子,4个F原子,则分子式为E4F4或F4E4,故D正确;故选B。 点睛:本题考查晶胞的计算。本题的易错点为D,注意气态团簇分子与晶胞的区别,容易因为思维定势造成错误。 4. 下列说法中正确的是( ) A. 邻羟基苯甲醛的熔、沸点比对羟基苯甲醛的熔、沸点低 B. 水很稳定是因为水中含有大量的氢键所 C. H2O、NH3、CH4分子中的O、N、C原子分别采取sp、sp2、sp3杂化 D. 配合物[Cu(H2O)4]SO4中,中心离子是Cu2+,配位体是SO42-,配位数是1 【答案】A 【解析】A.能形成分子间氢键的物质沸点较高,邻羟基苯甲醛容易形成分子内氢键,对羟基苯甲醛易形成分子间氢键,所以邻羟基苯甲醛的沸点比对羟基苯甲醛的沸点低,故A正确;B.水很稳定(1000℃以上才会部分分解)是因为水中含有的H-O键非常稳定,与存在氢键无关,故B错误;C.H2O分子中O原子为sp3杂化,H原子只含有1个s轨道,则H2O分子中的共价键是由O原子的sp3杂化轨道和H原子的s轨道形成的s-sp3σ键,同样,NH3分子中的N原子采取sp3杂化,故C错误;D.根据配合物[Cu(H2O)4]SO4结构分析,含有空轨道的金属阳离子为中心离子,所以中心离子为Cu2+、有孤对电子的原子或离子为配体,所以配体为H2O、配位数就是配体的个数,所以配位数为4,故D错误;故选A。 5. 四种短周期元素W、X、Y、Z的原子序数依次增大。其原子的最外层电子数之和为19,W和X元素原子内质子数之比为l∶2,X2+和Z-的电子数之差为8。下列说法不正确的是( ) A. WY2是由极性键构成的非极性分子 B. 元素原子半径从大到小的顺序是X>Y>Z C. WZ4分子中W、Z 原子通过共价键结合且最外层均达到8电子结构 D. Z 元素含氧酸有多种,其酸性HZO>HZO3>HZO4 【答案】D 【解析】短周期元素W、X、Y、Z的原子序数依次增大,由X2+和Z-离子所带电荷可知,X处于ⅡA族,Z处于ⅦA族,X2+和Z-离子的电子数之差为8,X的阳离子比Z的阴离子少一层电子,则X、Y同周期,由四原子最外层电子数之和为19,则W、Y原子最外层电子数之和为19-2-7=10,故W不能处于IA族,结合原子序数可知,Y一定为主族元素,W不可能处于第三周期,W只能处于第二周期,W和X元素原子内质子数之比为1:2,则X处于第三周期,故X为Mg,则Z为Cl、W为C,Y原子最外层电子数为10-4=6,原子序数大于Mg,故Y为S。A. CS2的结构类似于CO2,是由极性键构成的非极性分子,故A正确;B.同周期自左而右原子半径减小,故原子半径Mg>S>Cl,故B正确;C.CCl4分子中C、Cl原子最外层均达到8电子结构,故C正确;D.Cl元素含氧酸有多种,其中HClO、HClO3、HClO4的非羟基氧数目分别为0、2、3,酸性HClO<HClO3<HClO4,故D错误;故选D。 6. 已知NO和O2转化为NO2的反应机理如下: ①2NO(g)N2O2(g)(快)△H1<0 平衡常数K1 ②N2O2(g)+O2(g)2NO2(g)(慢)△H2<0 平衡常数K2 下列说法正确的是( ) A. 2NO(g)+O2(g)2NO2(g)的△H=-(△H1+△H2) B. 2NO(g)+O2(g)2NO2(g)的平衡常数K= K1/K2 C. 反应②的速率大小决定2NO(g)+O2(g)2NO2(g)的反应速率 D. 反应过程中的能量变化可用图表示 【答案】C 【解析】A.根据盖斯定律分析, ①+②即可得到反应,2NO(g)+O2(g)2NO2(g),故反应热为△H= (△H1+△H2),错误;B. 因为反应2NO(g)+O2(g)2NO2(g)为①+②的结果,所以其平衡常数K= K1K2,故错误;C. 反应慢的速率决定总反应速率,所以反应②的速率大小决定2NO(g)+O2(g)2NO2(g)的反应速率,故正确;D.图a表示前者为吸热,与题中信息不符合,故错误。 7. 下列关于化学反应的图像的说法不正确是( ) A. 图1可表示反应2NO2N2O4 在等温等压条件下平衡后t1时刻充入NO2时反应速率变化 B. 图2可表示CO(g)+2H2(g)CH3OH(g)在一定温度下,将0.5molCO和0.5molH2在体积为2L的密闭容器中发生反应时CO的体积分数随时间变化图像。 C. 图3可表示反应2SO2+O22SO3,温度T1>T2,反应为吸热反应。 D. 图4 可表示反应mA(g)+nB(g)pC(g)+qD(g),正反应是吸热反应,且m+n>p+q。 【答案】C 【解析】A. 在等温等压条件下,平衡后t1时刻充入NO2,正反应速率增大,逆反应速率减小,最后重新达到平衡状态,故A正确;B. 将0.5mol CO和0.5mol H2在体积为2L的密闭容器中发生反应,起始时CO与H2的体积比为1:1,CO的体积分数为50%,设反应过程中CO消耗xmol,则: CO(g)+2H2(g)CH3OH(g) 起始(mol) 0.5 0.5 0 转化(mol) x 2x x 则CO的体积分数为:×100% =×100%=50%,所以在反应过程中CO的体积分数不变,故B正确;C. 根据“先拐先平数值大”的原则,温度T2>T1,温度高时SO3的体积分数小,说明升高温度平衡逆向移动,则正反应为放热反应,故C错误;D. 由图可知,升高温度,A的转化率增大,说明升高温度平衡正向移动,正反应为吸热反应,压强越大,A的转化率越大,说明增大压强,平衡正向移动,正反应方向为气体减少的方向,则m+n>p+q,故D正确;答案选C。 8. 下列说法正确的是( ) A. 加入少量硫酸铜可加快锌与稀硫酸的反应速率,说明Cu2+具有催化作用 B. CH3Clg)+Cl2(g)CH2Cl2(l)+HCl(g)常温下能自发进行,则该反应的△H<0 C. 在恒温密闭容器中发生反应PCl3(g)+Cl2(g)PCl5(s),当PCl3的体积分数不变时,反应达到平衡状态 D. 常温下pH=3的盐酸与pH=11的Ba(OH)2溶液等体积混合,溶液呈碱性 【答案】B 【解析】A、加入硫酸铜可使锌与稀硫酸的反应速率加快,是因为锌置换出铜,构成锌-铜-稀硫酸原电池,加快反应速率,故A错误;B、反应能否自发进行的判据:△H-T△S<0,反应CH3Cl(g)+Cl2(g)CH2Cl2(l)+HCl(g)是熵减的反应,则该反应的△H<0,故B正确;C、温度不变,平衡常数不变,当起始PCl3(g)和Cl2(g)的物质的量之比为1:1时,PCl3的体积分数始终不变,因此当PCl3的体积分数不变时,反应不一定达到平衡状态,故C错误;D、pH=11的某碱为强碱时,等体积混合显中性,则pH=3的盐酸与pH=11的某碱溶液等体积混合溶液呈碱性,说明该碱为弱碱,与氢氧化钡为强碱不符,故D错误;故选B。 9. 部分弱酸的电离平衡常数数据如下表,则下列选项正确的是( ) 弱电解质 HCOOH HCN H2CO3 电离平衡常数 Ka=1.77×10-4 Ka=4.9×10-10 Ka1=4.3×10-7Ka2=5.6×10-11 A. 向NaCN溶液中通入CO2发生反应:2CN-+H2O+CO2=2HCN+CO32- B. 相同物质的量浓度的HCOONa、NaCN、Na2CO3溶液,pH值大小为:NaCN>Na2CO3>HCOONa C. 等体积等浓度的HCOONa和NaCN溶液中所含离子总数前者大于后者 D. 中和等体积、等pH的HCOOH和HCN,消耗NaOH的物质的量前者大于后者 【答案】C 【解析】A、酸性由强到弱的顺序为:H2CO3>HCN>HCO3-,依据强酸制弱酸的原理可知,CN-+H2O+CO2=HCN+HCO3-,故A错误;B、酸性越弱其酸根的水解程度越大,所以等物质的量浓度的各溶液pH关系为:pH(Na2CO3)>pH(NaCN)>pH(HCOONa),故B错误;C.根据电荷守恒,c(HCOO-)+c(OH-)=c(Na+)+c(H+),c(CN-)+c(OH-)=c(Na+)+c(H+),即离子总数是n(Na+ )+n(H+)的2倍,而NaCN的水解程度大,即NaCN溶液中的c(OH-)大,c(H+)小,c(Na+)相同,所以甲酸钠中离子浓度大,故C正确;D.等pH、等体积的HCOOH和HCN,n(HCN)>n(HCOOH),中和酸需要碱的物质的量与酸的物质的量、酸的元数成正比,所以中和等体积、等pH的HCOOH和HCN消耗NaOH的量前者小于后者,故D错误;故选C。 点睛:本题考查弱电解质的电离,根据平衡常数确定酸性强弱,从而确定酸之间的转化,结合电荷守恒来分析解答。本题的易错点为D,弱酸的电离平衡常数越大,其酸性越强,等pH的弱酸溶液,酸性越强,其物质的量浓度越小。 10. 已知: ①298K时K(HF)=3.5×10-4,Ksp(CaF2)= 1.8×10-7 ②HF(aq)H+(aq)+F-(aq) △H<0 根据以上已知信息判断下列说法正确的是( ) A. 298K时,加蒸馏水稀释HF溶液,保持不变 B. 308K时,HF的电离常数Ka>3.5×10-4 C. 298K时,向饱和CaF2溶液中加入少量CaCl2,Ksp(CaF2)会减小 D. 2HF(aq)+Ca2+(aq)CaF2(s)+2H+(aq) K≈0.68 【答案】D 11. 下列叙述正确的是( ) A. 95℃纯水的pH<7,说明加热可导致水呈酸性 B. pH=3的醋酸溶液,稀释至10 倍后pH=4 C. pH均为3,等体积的醋酸和盐酸分别与足量Zn反应,醋酸产生的H2多 D. pH=3 的醋酸溶液,与pH=11的氢氧化钠溶液等体积混合后pH>7 【答案】C 【解析】A.加热促进水的电离,溶液中c(H+)=c(OH-),溶液呈中性,故A错误;B.醋酸为弱酸,稀释促进电离,pH=3的醋酸溶液,稀释至 10 倍后 pH<4,故B错误;C.醋酸为弱电解质,等pH等体积时醋酸的物质的量多,则醋酸生成的氢气多,故C正确; D.pH=3的醋酸溶液,与pH=11的氢氧化钠溶液的浓度相等,但醋酸为弱酸,不能完全电离,醋酸过量,反应后呈酸性,故D错误;故选C。 12. 改变0.1mol·L-1二元弱酸H2A溶液的pH, 溶液中的H2A、HA-、A2-的物质的量分数∮(X)随pH的变化如图所示[已知:∮(X)=]。下列叙述错误的是( ) A. pH=1.2 时,c (H2A)=c(HA-) B. lg[K2(H2A)]=-4.2 C. pH=2.7时,c(HA-) >c(H2A)=c(A2-) D. pH=4.2时,c (HA-)=c(A2-)=c(H+) 【答案】D 【解析】由图像可知,pH=1.2时,c(H2A)=c(HA-),pH=2.7时,c(H2A)=c(A2-),pH=4.2时,c(HA-)=c(A2-),随着pH的增大,c(H2A)逐渐减小,c(HA-)先增大后减小,c(A2-)逐渐增大。A.由图像可知pH=1.2时,H2A与HA-的曲线相交,则c(H2A)=c(HA-),故A正确;B.pH=4.2时,c(H+)=10-4.2mol/L,c(HA-)=c(A2-),K2(H2A)==10-4.2,则lg[K2(H2A)]=-4.2,故B正确;C.由图像可知,pH=2.7时,c(H2A)=c(A2-),由纵坐标数据可知c(HA-)>c(H2A)=c(A2-),故C正确;D.pH=4.2时,c(HA-)=c(A2-),但此时c(H2A)≈0,如体积不变,则c(HA-)=c(A2-)=0.05mol•L-1,c(H+)=10-4.2mol/L,如体积变化,则不能确定c(HA-)、c(A2-)与c(H+)浓度大小关系,故D错误;故选D。 点睛:本题考查弱电解质的电离,侧重考查学生的分析能力和计算能力。本题注意把握弱电解质的电离特点以及题给图像的曲线变化。本题的易错点为B,要注意根据K2(H2A)的表达式结合图像分析判断。 13. 某兴趣小组同学利用氧化还原反应:2KMnO4+10FeSO4+8H2SO4=2MnSO4+5Fe2(SO4)3+K2SO4↓+8H2O设计如右图原电池装置,盐桥中装有饱和的K2SO4溶液,下列说法正确的是( ) A. a 电极上发生的反应为:MnO4-+8H++5e-=Mn2++4H2O B. 外电路电子的流向是从a到b C. 电池工作时,盐桥中的SO42-移向甲烧杯 D. b 电极上发生还原反应 【答案】A 【解析】试题分析:A、总电极反应式:2MnO4-+10Fe2++16H+=2Mn2++10Fe3++8H2O,a极是正极得电子,电极反应式=总电极反应式-b极反应式,得出:2MnO4-+16H++10e-=2Mn2++8H2O,化简得:MnO4-+8H++5e-=Mn2++4H2O,A正确;B、根据A的分析,外电路电子流向是从b流向a,B错误;C、根据原电池的工作原理:阴离子向负极移动,阳离子向正极移动,SO42-向b极移动,C错误;D、根据原电池的工作原理:负极失电子,发生氧化反应,正极得电子发生还原反应,b极上电极反应式:Fe2+-e-=Fe3+,D错误,答案选A。 【考点定位】本题主要是考查原电池的工作原理及常见的化学电源 【名师点晴】根据氧化还原反应理论分析反应2KMnO4+10FeSO4+8H2SO4=2MnSO4+5Fe2(SO4)3+K2SO4+8H2O可知,Mn元素的化合价降低,得到电子,Fe元素的化合价升高,失去电子,再结合原电池理论,则b为负极,a为正极,结合原电池中负极发生氧化反应,电流从正极流向负极,阴离子向负极移动来解答即可。 14. 清华大学首创三室膜电解法制备LiOH,其工作原理如图。下列说法正确的是( ) A. N为阳离子交换膜 B. X 电极连接电源负极 C. 制备2.4gLiOH产生2.24LH2(标况) D. Y 电极反应式为O2+2H2O+4e-=4OH- 【答案】A .................. 15. 关于下列各图说法正确的是( ) A. 装置①中阳极上析出红色固体 B. 装置②中待镀铁制品应与电源的正极相连 C. 装置③中外电路电子由b极流向a极 D. 装置④中离子交换膜可以避免氯气与氢氧化钠溶液反应 【答案】D 【解析】A.装置①中阳极上氯离子放电生成氯气,阴极上铜离子放电生成铜,所以阴极上析出红色固体,故A错误;B.装置②的待镀铁制品应与电源负极相连,充当阴极,故B错误;C.装置③中,a电极是负极,b电极是正极,负极上氢气失电子,正极上氧气得电子,所以电子从a极沿导线流向b极,故C错误;D、装置④中的离子交换膜允许离子通过,氯气不能通过,可以避免生成的Cl2与NaOH溶液反应,故D正确;故选D。 16. 某原电池装置如右图所示,电池总反应为2Ag+Cl2=2AgCl。下列说法正确的是( ) A. 正极反应为AgCl+e-=Ag+Cl- B. 放电时,交换膜右侧溶液中有大量白色沉淀生成 C. 若用NaCl溶液代替盐酸,则电池总反应随之改变 D. 当电路中转移0.01mol e-时,交换膜左侧溶液中约减少0.02 mol 离子 【答案】D 【解析】试题分析:根据电池总反应为2Ag+Cl2═2AgCl可知,Ag失电子作负极失电子,氯气在正极上得电子生成氯离子。A、正极上氯气得电子生成氯离子,其电极反应为:Cl2+2e-═2Cl- ,故A错误;B、放电时,交换膜左侧溶液中生成银离子,银离子与氯离子反应生成氯化银沉淀,所以交换膜左侧溶液中有大量白色沉淀生成,故B错误;C、根据电池总反应为2Ag+Cl2═2AgCl可知,用NaCl溶液代替盐酸,电池的总反应不变,故C错误;D、放电时,当电路中转移0.01mol e-时,交换膜左则会有0.01mol氢离子通过阳离子交换膜向正极移动,同时会有0.01molAg失去0.01mol电子生成银离子,银离子会与氯离子反应生成氯化银沉淀,所以氯离子会减少0.01mol,则交换膜左侧溶液中约减少0.02mol离子,故D正确。 考点:考查了原电池原理的应用等相关知识。 视频 二、填空题(共52分,每空2分) 17. W、M、X、Y、Z为原子序数依次增大的前四周期元素,非金属元素W所在周期数等于族序数;M最外层电子数是电子层数的两倍;X与M同族,X单质与O2反应生成化合物XO2;Y 是第三周期原子半径最小的元素;Z是生活中常见金属,既不属于主族,也不属于副族。回答下列问题: (1) W与M可以形成多种化合物,写出其中最简单化合物的电子式_____________。 (2) 已知:①X的单质结构为(,每个X原子周围都与4个X成键形成的庞大结构);化合物XO2结构为(,每个X与4个O成键,每个O都与2个X成键形成的庞大结构)。 ②有关键能的数据如下表: 化学键 X-O O=O X-X 键能(kJ/mol) 460 498.8 176 写出单质X 在O2中燃烧的热化学方程式________________________。(用具体元素符号书写方程式) (3) 写出Z的单质与H2O反应的化学方程式_____________________________________。 (4)Y和Z形成的化合物的水溶液呈酸性的原因_______________________________(用离子方程式解释)。 【答案】 (1). (2). Si(s)+O2(g)=SiO2(s) △H=-989.2kJ/mol (3). 3Fe+4H2O(g)Fe3O4+4H2 (4). Fe3++3H2OFe(OH)3+3H+ (不写可逆符号不给分) 【解析】W、M、X、Y、Z为原子序数依次增大的前四周期元素,Y 是第三周期原子半径最小的元素,Y为Cl元素;Z是生活中常见金属,既不属于主族,也不属于副族,Z属于第Ⅷ族,Z为Fe元素;非金属元素W所在周期数等于族序数,则W为H元素;M最外层电子数是电子层数的两倍;X与M同族,X单质与O2反应生成化合物XO2;则M为第2周期元素,为C,X为Si元素。 (1) H与C可以形成多种化合物,其中最简单化合物为甲烷,电子式为,故答案为:; (2) 根据题意,硅在氧气中燃烧生成二氧化硅,其中硅和二氧化硅均为原子晶体,其中1 mol Si中含有2 mol Si—Si 键;1 mol SiO2中含有4 mol Si—O键;则硅在氧气中燃烧的热化学方程式为Si(s)+O2(g)=SiO2(s) △H=反应物总键能-生成物总键能=176×2+498.8-460×4=-989.2kJ/mol,故答案为:Si(s)+O2(g)=SiO2(s) △H=-989.2kJ/mol; (3) 铁与H2O蒸气反应的化学方程式为3Fe+4H2O(g)Fe3O4+4H2,故答案为:3Fe+4H2O(g)Fe3O4+4H2; (4)氯化铁属于强酸弱碱盐,水解显酸性,水解的离子方程式为Fe3++3H2OFe(OH)3+3H+,故答案为: Fe3++3H2OFe(OH)3+3H+。 18. (1) 基态Si原子中,电子占据的最高能层符号为________,该能层具有的原子轨道数为_________。 (2) CH3COOH中C原子轨道杂化类型为_________;1molCH3COOH分子含有σ键的数目为_________。 (3) 复化硼(BN)晶体有多种相结构。六方相氮化硼是通常存在的稳定相,与石墨相似,具有层状结构,可作高温润滑剂。立方相氮化硼是超硬材料,有优异的耐磨性。它们的晶体结构如图所示。 ①基态硼原子的电子排布式为__________。 ②六方相氮化硼晶体层内一个硼原子与相邻氮原子构成的空间构型为__________,分析其结构,与石墨相似却不导电,原因是__________。 ③NH4BF4 (氟硼酸铵)是合成氮化硼纳米管原料之一。1mol NH4BF4 含有__________mol 配位键。 (4) Ge单晶具有金刚石型结构,其中Ge原子的杂化方式为_______,微粒之间存在的作用力是__________。 (5) 晶胞有两个基本要素: ①原子坐标参数,表示晶胞内部各原子的相对位置,下图为金刚石的晶胞,其中原子坐标参数A为(0,0 ,0);B为(,0,);C为(,,0)。则D原子的坐标参数为__________。 ②晶胞参数,描述晶胞的大小和形状,已知金刚石晶胞参数acm,其密度为__________g·cm-3(列出计算式即可)。 【答案】 (1). M (2). 9 (3). sp3和sp2 (4). 7NA(或7×6.02×1023) (5). 1s22s2p1 (6). 平面三角形 (7). 层状结构中没有自由移动的电子 (8). 2 (9). sp3 (10). 共价键 (11). (;;) (12). 【解析】(1)Si原子核外电子数为14,基态原子核外电子排布为1s22s22p63s23p2,电子占据的最高能层符号为M,该能层具有的原子轨道数为1+3+5=9;故答案为:M;9; (2)CH3COOH中C原子分别形成4个、3个δ键,没有孤对电子,分别为sp3杂化、sp2 杂化,CH3CHOOH分子中含有1个C-C、3个C-H、1个C-O、1个C=O、1个O-H等化学键,则1mol CH3COOH分子中含有σ键的数目为7mol或7×6.02×1023,故答案为:sp3和sp2;7mol或7×6.02×1023; (3)①基态硼原子核外有5个电子,分别位于1s、2s、2p能级,根据构造原理知其基态的电子排布式1s22s22p1,故答案为:1s22s22p1; ②六方相氮化硼晶体层内一个硼原子与相邻氮原子形成3个共价单键,且B原子不存在孤电子对,所以构成的空间构型为平面三角形,该物质的层状结构中不存在自由移动的电子,所以不导电,故答案为:平面三角形;层状结构中没有自由移动的电子; ③一个NH4BF4中N原子和其中一个H原子之间存在配位键、B原子和其中一个F原子之间存在一个配位键,所以含有2个配位键,则1mol NH4BF4含有2mol配位键,故答案为:2; (4)Ge单晶具有金刚石型结构,Ge原子与周围4个Ge原子形成正四面体结构,向空间延伸的立体网状结构,属于原子晶体,Ge原子之间形成共价键,Ge原子杂化轨道数目为4,采取sp3杂化,故答案为:sp3;共价键; (5)①D与周围4个碳原子形成正四面体结构,D与顶点A的连线处于晶胞体对角线上,过面心B、C及上底面面心原子的平面且平行侧面将晶胞2等分,同理过D原子的且平行侧面的平面将半个晶胞再2等份,可知D处于到各个面的处,则D原子的坐标参数为(,,),故答案为:(,,); ②晶胞中C原子数目为4+8×+6×=8,结合阿伏伽德罗常数,可知出晶胞的质量为g,晶胞参数acm,其密度为g÷(acm)3=g·cm-3,故答案为:。 点睛:本题考查了物质结构和性质,涉及配位键、原子杂化方式的判断、微粒空间构型的判断、晶胞结构的计算等知识点。本题的易错点为(2)中CH3COOH中C原子的杂化类型,难点是(5)①D的坐标的确定,要能够从图像中看出D与顶点A的连线处于晶胞体对角线上、过面心B、C及上底面面心原子的平面且平行侧面将晶胞2等分,同理过D原子的且平行侧面的平面将半个晶胞2等分。 19. (1) 肼(N2H4)是火箭推进器中常用的高能燃料,已知0.4mol液态肼和足量H2O2反应,生成N2和水蒸气,放出256.65kJ的热量,请写出该反应的热化学方程式:__________________________。 (2) 工业上制氢气的一个重要反应是:CO(g)+H2O(g)=CO2(g)+H2(g) 已知在25℃时: C(石墨)+ O2(g)=CO(g) △H1=-111kJ·mol-1 H2(g)+O2(g)=H2O(g) △H2=-242kJ·mol-1 C(石墨)+O2(g)=CO2(g) △H3=-394kJ·mol-1 试计算25℃时一氧化碳与水作用转化为氢气和二氧化碳反应的反应热△H=________kJ·mol-1 (3) 高铁酸钾(K2FeO4)可作净水剂,也可用于制造高铁电池。高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为3Zn+2K2FeO4+8H2O=3Zn(OH)2+Fe(OH)3+4KOH,该电池放电时正极反应式为____________。 (4) 用该电池电解 100mL1mol·L-1的AgNO3溶液,写出电解反应方程式:____________________。当电路中通过0.01mol电子时,被电解溶液的pH为________(溶液体积变化忽略不计)。 【答案】 (1). N2H4(l)+2H2O(l)=N2(g)+4H2O △H=-641.625kJ/mol (2). -41 (3). FeO42-+4H2O+3e-=Fe(OH)3+5OH- (4). 4AgNO3+2H2O=4Ag+O2+4HNO3 (5). 1 【解析】(1)0.4mol液态肼和足量H2O2反应,生成氮气和水蒸气,放出256.65kJ的热量,1mol液态肼与足量液态双氧水反应时放出的热量641.625kJ,则热化学方程式为:N2H4(l)+2H2O2(l)═N2(g)+4H2O(g)△H=-641.625 kJ•mol-1,故答案为:N2H4(l)+2H2O2(l)═N2(g)+4H2O(g)△H=-641.625 kJ•mol-1; (2)①C(石墨)+ O2(g)=CO(g) △H1=-111kJ·mol-1,②H2(g)+O2(g)=H2O(g) △H2=-242kJ·mol-1,③C(石墨)+O2(g)=CO2(g) △H3=-394kJ·mol-1,依据盖斯定律③-②-①得到:CO(g)+H2O(g)=CO2(g)+H2(g)△H=-41kJ/mol;故答案为:-41; (3)根据总反应3Zn+2K2FeO4+8H2O=3Zn(OH)2+Fe(OH)3+4KOH,高铁酸钾在正极得到电子,发生还原反应,电极反应式为FeO42-+4H2O+3e-=Fe(OH)3+5OH-,故答案为:FeO42-+4H2O+3e-=Fe(OH)3+5OH-; (4)该电池电解100mL 1mol•L-1的AgNO3溶液,阳极: 2H2O—4e- = O2↑+ 4H+,阴极:4Ag+ + 4e- = 4Ag↓,总方程式:4AgNO3 + 2H2O 4Ag↓+ O2↑+ 4HNO3。根据阳极的电极反应:2H2O—4e- = O2↑+ 4H+,所以产生的H+的物质的量为0.01mol,其物质的量浓度为=0.1mol/L,所以pH=1,故答案为:4AgNO3+2H2O=4Ag+O2+4HNO3;1。 20. 连二次硝酸(H2N2O2)是一种二元酸,可用于制N2O气体。 (1) 连二次硝酸中氮元素的化合价为________。 (2) 常温下,用0.01mol·L-1的NaOH溶液滴定10mL0.01mol·L-1的H2N2O2溶液,测得溶液的pH 与NaOH客液体积的关系如图所示。 ①写出H2N2O2在水溶液中的电离方程式:________。 ②b点时溶液中c(H2N2O2)________c(N2O22-)。(填“>”“<”或“=”下同) ③a 点时溶液中c(Na+)________c(HN2O2-)+c(N2O22-)。 【答案】 (1). +1 (2). H2N2O2H++HN2O2-, HN2O2-H++N2O22- (3). > (4). > 【解析】(1)H2N2O2分子中H的化合价为+1,O元素的化合价为-2,设N元素的化合价为x,根据总化合价之和为0可知:2x+(+1)×2+(-2)×2=0,解得:x=1,即N元素的化合价为+1,故答案为:+1; (2)①根据图像可知,氢氧化钠溶液体积为0时,0.01mol/L的H2N2O2溶液的pH=4.3,说明H2N2O2为二元弱酸,二元弱酸以第一步电离为主,则其电离方程式为:H2N2O2HN2O2-+H+,HN2O2- H++N2O22-,故答案为:H2N2O2HN2O2-+H+,HN2O2- H++N2O22-; ②b点溶质为NaHN2O2,溶液的pH>7,说明溶液显示碱性,则HN2O2-的水解程度大于其电离程度,所以c(H2N2O2)>c(N2O22-),故答案为:>; ③根据图像可知,a点时溶液的pH=7,溶液呈中性,则c(OH-)=c(H+),根据电荷守恒可知c(Na+)=c(HN2O2-)+2c(N2O22-),所以c(Na+)>c(HN2O2-)+c(N2O22-),故答案为:>。 21. (1)一定温度下,Ksp[Mg3(PO4)2]=6.0×10-29,Ksp[Ca3(PO4)2]=6.0×10-26。向浓度均为 0.20mol·L-1的 MgCl2 和 CaCl2 混合溶液中逐滴加入 Na3PO4,先生成沉淀________(填化学式);当测得溶液其中一种金属阳离子沉淀完全(浓度小于10-5mol·L-1)时,溶液中的另一种金属阳离子的物质的量浓度c________。 (2)毒重石的主要成分BaCO3(含Ca2+、Mg2+、Fe3+等杂质),实验室利用毒重石制备BaCl2·2H2O的流程如下: 已知: Ksp(BaC2O4)=1.6×10-7, Ksp(CaC2O4)=2.3×10-9 Ca2+ Mg2+ Fe3+ 开始沉淀时的pH 11.9 9.1 1.9 完全沉淀时的pH 13.9 11.1 3.7 ①毒重石用盐酸浸取前需充分研磨,目的是________。 ②加入NH3·H2O调节pH=8 可除去________(填离子符号),滤渣Ⅱ中含________(填化学式)。加入H2C2O4时应避免过量,原因是________________。 【答案】 (1). Mg3(PO4)2 (2). <10-4mol·L-1 (3). 可以增大反应物的接触面积,增大反应速率 (4). Fe3+ (5). Mg(OH)2、Ca(OH)2 (6). 会导致生成BaC2O4沉淀,产品产量会减少 【解析】(1)难溶物溶度积常数小的先沉淀,根据溶度积常数相对大小知,Mg3(PO4)2先生成沉淀,当溶液中c(Mg2+)<10-5 mol/L时,认为镁离子完全沉淀,则溶液中的磷酸根浓度为c2(PO43-)>==6.0×10-14 mol2·L-2,所以c(Ca2+)<=10-4 mol·L-1,故答案为:Mg3(PO4)2;<10-4 mol·L-1; (2)制备BaCl2•2H2O的流程:毒重石的主要成分BaCO3(含Ca2+、Mg2+、Fe3+等杂质),加盐酸溶解,碳酸钡和盐酸反应:BaCO3+2H+=Ba2++CO2↑+H2O,加入氨水,调pH为8,Fe3+完全沉淀时的pH为3.2,只有Fe3+完全沉淀,滤渣1为Fe(OH)3,溶液中主要含Ca2+、Mg2+、Ba2+,加入氢氧化钠调节PH=12.5,Ca2+完全沉淀时的pH为13.9,Mg2+完全沉淀时的pH为11.1,Mg2+完全沉淀,Ca2+部分沉淀,滤渣Ⅱ中含Mg(OH)2、Ca(OH)2;溶液中主要含Ca2+、Ba2+,加入H2C2O4,得到CaC2O4↓,除去Ca2+,蒸发浓缩冷却结晶得到BaCl2•2H2O。 ①化学反应的速率与反应物的接触面积有关,毒重石用盐酸浸取前需充分研磨,可以增大反应物的接触面积,增大反应速率,故答案为:增大接触面积从而使反应速率加快; ②根据流程图和表中数据可知:Fe3+完全沉淀时的pH为3.2,加入氨水,调pH为8,Fe3++3NH3•H2O=Fe(OH)3↓+3NH4+,Fe3+完全沉淀,滤渣1为Fe(OH)3,加入氢氧化钠调节PH=12.5,Ca2+完全沉淀时的pH为13.9,Mg2+完全沉淀时的pH为11.1,Mg2+完全沉淀,Ca2+部分沉淀,滤渣Ⅱ中含Mg(OH)2、Ca(OH)2,溶液中主要含Ca2+、Ba2+,Ksp(BaC2O4)=1.6×10-7 ,Ksp(CaC2O4)=2.3×10-9,易形成CaC2O4沉淀,加入H2C2O4时应避免过量,防止CaC2O4沉淀完全后,过量的H2C2O4会导致生成BaC2O4沉淀,产品的产量减少,故答案为:Fe3+;Mg(OH)2、Ca(OH)2;H2C2O4过量会导致生成BaC2O4沉淀,产品的产量减少。 点睛:本题考查了实验室利用毒重石制备BaCl2•2H2O的设计方法,涉及影响反应速率的因素、沉淀溶解平衡的应用等知识,结合物质的性质分析是解答的关键。本题的难点是(1),难溶物溶度积常数小的先沉淀,当溶液中c(Mg2+)<10-5 mol/L时,认为镁离子完全沉淀,再根据磷酸根浓度计算c(Ca2+)。 查看更多