- 2021-08-06 发布 |
- 37.5 KB |
- 12页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2017-2018学年江苏省扬州市高二上学期期末考试 化学(选修) Word版
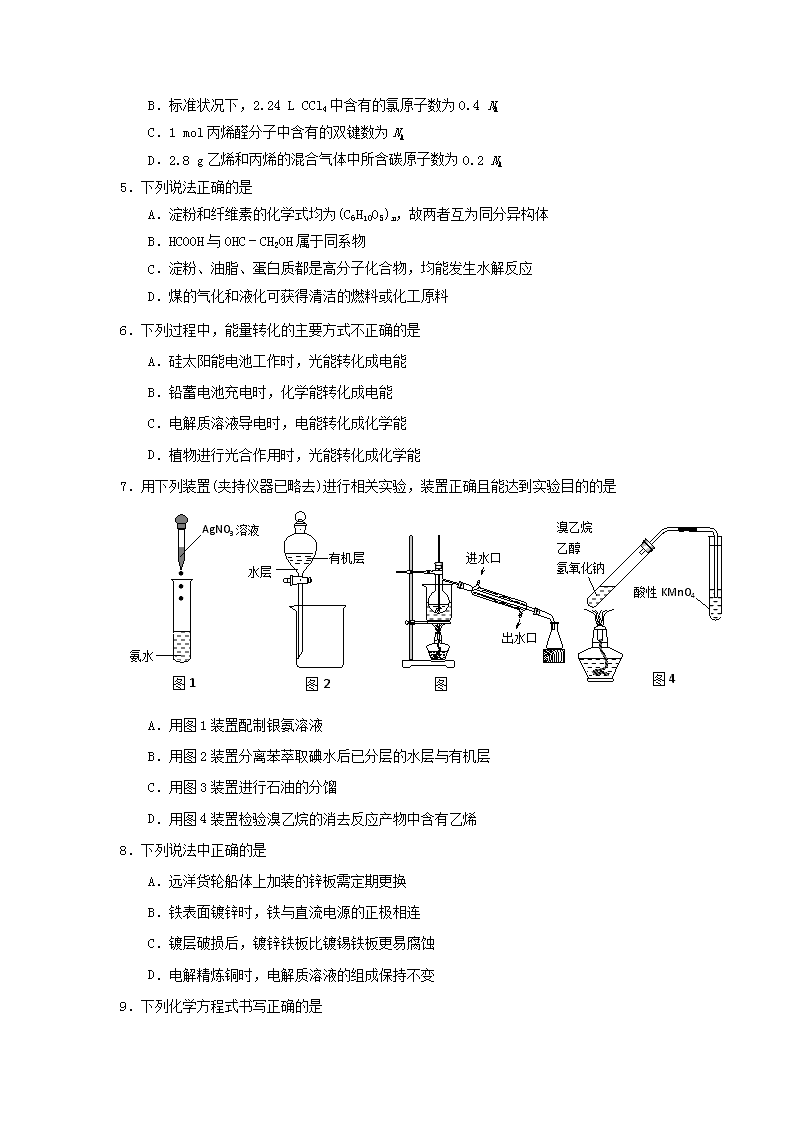
2017-2018学年江苏省扬州市高二上学期期末考试化学(选修) 201802 注意事项: 1.答卷前,考生务必将本人的学校、姓名、考号用0.5毫米黑色签字笔写在答题卡的相应位置。 2.选择题答案请用2B铅笔在答题卡指定区域填写,如需改动,用橡皮擦干净后再填涂其它答案。非选择题用0.5毫米黑色签字笔在答题卡指定区域作答。 3.如有作图需要,可用2B铅笔作答,并加黑加粗,描写清楚。 可能用到的相对原子质量:H∶1 C∶12 O∶16 Al∶27 第Ⅰ卷(选择题 共40分) 单项选择题(本题包括10小题,每小题2分,共计20分。每小题只有一个选项符合题意。) 1.化学与生产、生活密切相关。下列说法不正确的是 A.将地沟油回收加工成燃料,可提高资源的利用率 B.推广使用聚碳酸酯等可降解塑料,可减少“白色污染” C.煤的干馏与石油的分馏均属于化学变化 D.开发利用可再生能源,减少化石燃料的使用 2.下列有关化学用语表示正确的是 A.乙烯的结构简式:CH2CH2 B.丙烯的键线式: C.醛基的电子式: D.乙醇分子的球棍模型: 3.下列有机物命名正确的是 A. 2﹣乙基丙烷 B. 3﹣丁醇 C. 邻二甲苯 D. 2﹣甲基﹣2﹣丙烯 4.设NA为阿伏加德罗常数的值,下列说法中正确的是 A.1 mol CH4含有的电子数为NA B.标准状况下,2.24 L CCl4中含有的氯原子数为0.4 NA C.1 mol丙烯醛分子中含有的双键数为NA D.2.8 g乙烯和丙烯的混合气体中所含碳原子数为0.2 NA 5.下列说法正确的是 A.淀粉和纤维素的化学式均为(C6H10O5)n,故两者互为同分异构体 B.HCOOH与OHC﹣CH2OH属于同系物 C.淀粉、油脂、蛋白质都是高分子化合物,均能发生水解反应 D.煤的气化和液化可获得清洁的燃料或化工原料 6.下列过程中,能量转化的主要方式不正确的是 A.硅太阳能电池工作时,光能转化成电能 B.铅蓄电池充电时,化学能转化成电能 C.电解质溶液导电时,电能转化成化学能 D.植物进行光合作用时,光能转化成化学能 7.用下列装置(夹持仪器已略去)进行相关实验,装置正确且能达到实验目的的是 图2 . . . 图1 图4 图3 AgNO3溶液 氨水 水层 有机层 进水口 出水口 溴乙烷 乙醇 氢氧化钠 酸性KMnO4 A.用图1装置配制银氨溶液 B.用图2装置分离苯萃取碘水后已分层的水层与有机层 C.用图3装置进行石油的分馏 D.用图4装置检验溴乙烷的消去反应产物中含有乙烯 8.下列说法中正确的是 A.远洋货轮船体上加装的锌板需定期更换 B.铁表面镀锌时,铁与直流电源的正极相连 C.镀层破损后,镀锌铁板比镀锡铁板更易腐蚀 D.电解精炼铜时,电解质溶液的组成保持不变 9.下列化学方程式书写正确的是 A.乙酸乙酯的制备: CH3COOH + CH3CH218OHCH3COOCH2CH3 + H218O B.乙醛与新制氢氧化铜悬浊液共热: CH3CHO + 2Cu(OH)2 + NaOH CH3COONa + Cu2O↓+ 3H2O C.苯酚钠溶液中通入少量二氧化碳: 2 + CO2 + H2O 2 + Na2CO3 D.用铁作电极电解饱和氯化钠溶液: 2NaCl + 2H2O2NaOH + H2↑+ Cl2↑ 10.下列化合物的1H-NMR谱图中吸收峰的数目不正确的是 A. B. C. D. 不定项选择题(本题包括5小题,每小题4分,共计20分。每小题只有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题得0分;若正确答案包括两个选项时,只选一个且正确的得2分,选两个且都正确的得满分,但只要选错一个,该小题就得0分。) 11.除去下列物质中混入的少量杂质(括号内物质为杂质),能达到实验目的的是 A.溴乙烷(溴):加入饱和NaHSO3溶液,充分振荡、静置、分液 B.甲烷(乙烯):通入足量的酸性KMnO4溶液,洗气 C.苯(苯酚):加入足量的NaOH溶液,充分振荡、静置、分液 D.乙酸乙酯(乙酸):加入饱和NaOH溶液,充分振荡、静置、分液 12.某药物合成中间体的结构简式如下图所示。下列有关叙述正确的是 A.该有机物的分子式为C11H8O5 B.该有机物能发生氧化反应、消去反应 C.该有机物在一定条件下与NaOH溶液完全反应时,最多能消耗2mol NaOH D.该有机物在一定条件下与足量H2反应后的产物中有6个手性碳原子 13.某种碱性阴离子交换膜燃料电池的工作原理如下图所示。若以甲醇为燃料,空气为助燃气,下列说法正确的是 A.电极A为该电池的负极,工作时电子由电极A经负载流向电极B B.电极B上发生的电极反应为:O2+2H2O+4e-===4OH- C.电路中每通过6 mol电子,理论上需要消耗32 g甲醇 D.该电池工作时的总反应式为:2CH3OH+3O2===2CO2+4H2O 14.下列有关实验操作能达到实验目的或得出相应结论的是 选项 实验目的 实验操作 A 验证铁的吸氧腐蚀 将铁钉放入试管中,用稀盐酸浸没 B 检验溴乙烷中是否含有溴元素 将溴乙烷与氢氧化钠溶液共热后,滴加AgNO3溶液,观察是否有淡黄色沉淀产生 C 验证淀粉是否水解完全 向淀粉溶液中加入稀硫酸,水浴加热一段时间后,加入NaOH溶液至溶液呈碱性,再加入新制Cu(OH) 2悬浊液,加热煮沸,观察是否有砖红色沉淀产生 D 验证蛋白质的盐析过程是否可逆 向蛋白质溶液中滴加饱和Na2SO4溶液,有固体析出,过滤,向固体中加足量蒸馏水,观察固体是否溶解 15.某药物中间体合成路线如下(部分产物已略去),下列说法正确的是 A.步骤①的反应类型是取代反应 B.A的结构简式为 C.B中含有酯基、醛基 D.在NaOH醇溶液中加热,E可以发生消去反应 第Ⅱ卷(非选择题 共80分) 16.(12分)有机物X是合成治疗癌症药物的中间体,其合成部分路径如下: 请回答下列问题: (1)反应①的反应条件为 ▲ 。 (2)由B制备X的过程中,有副产物C生成(与X互为同分异构体),C的结构简式为 ▲ 。 (3)下列有关X的说法正确的是 ▲ 。 A.该物质属于芳香烃 B.X分子中含有一个手性碳原子 C.X可发生还原反应 D.用酸性高锰酸钾溶液可鉴别化合物X与B (4)写出苯甲酸的一种含有苯环的同分异构体的结构简式 ▲ 。 (5)B在一定条件下发生聚合反应可得到一种高吸水性树脂,其结构简式为 ▲ 。 (6)写出X与NaOH溶液反应的化学方程式 ▲ 。 17. (14分) 某兴趣小组学生用如下图所示装置制取丙烯酸甲酯,步骤如下: Ⅰ.取10.0 g丙烯酸(CH2=CHCOOH)和6.0 g甲醇、适量的浓硫酸放置于三颈烧瓶中,连接好冷凝管,用搅拌棒搅拌,水浴加热。 Ⅱ.充分反应后,冷却,向混合液中加入5% Na2CO3溶液洗涤至中性。 Ⅲ.分液,取上层油状液体,加入无水Na2SO4固体,过滤后蒸馏,收集70~90 ℃馏分。 回答下列问题: (1) 冷凝管的作用是 ▲ 。 (2) 步骤Ⅰ中浓硫酸有提高丙烯酸甲酯产率的作用,但是浓硫酸过多,产率却降低, 原因是 ▲ 。该实验中可能生成有机副产物的结构简式为 ▲ (填一种即可)。 (3) 步骤Ⅱ中混合液用5% Na2CO3溶液洗涤的目的是 ▲ 。 (4) 步骤Ⅲ中加入无水Na2SO4固体的作用是 ▲ 。 (5)为测定丙烯酸甲酯的产率,设计如下实验: ①将所得产品平均分成3份,取出1份置于锥形瓶中,加入3.0 mol·L-1 KOH溶液30.00 mL,加热使之完全水解。 ②向冷却后的溶液中滴加2.0 mol·L-1 H2SO4溶液,中和过量的KOH,消耗硫酸17.00 mL。则丙烯酸甲酯的产率为 ▲ 。(结果保留3位有效数字) (6)已知甲醇易挥发且有毒性,请写出1条在本实验中需要采取的安全防护措施 ▲ 。 18.(12分)以乙苯为原料合成高分子纤维E的路线如下图。已知B能发生银镜反应,C分子中含有一个甲基。 已知:① ② (1)A的结构简式为 ▲ 。 (2)写出反应类型:反应① ▲ ;反应⑤ ▲ 。 (3)B的结构简式为: ▲ 。 (4)反应⑤的化学方程式为: ▲ 。 (5)一定条件下D还能生成酯类物质F(C20H20O4),F的结构简式为: ▲ 。 (6)下列物质中与D互为同分异构体的为 ▲ 。 19.(14分)金属铝在现代生产和日常生活中应用广泛。 (1)工业上用电解熔融氧化铝的方法来制取金属铝。 ①金属铝在 ▲ (填电极名称)生成。 ②电解过程中作阳极的石墨易消耗,原因是 ▲ 。 (2)用电解氧化法可以在铝制品表面形成致密、耐腐蚀的氧化膜,电解质溶液一般为 H2SO4﹣H2C2O4混合溶液。 ①阳极电极反应式为 ▲ 。 ②在电解过程中,阴极附近溶液的pH ▲ (填 “增大”,“减小”或“不变”) 。 (3)英国《自然》杂志近期报道了一种新型铝离子 电池,以金属铝和石墨为电极,用AlCl4—和有机 阳离子构成电解质溶液,其放电工作原理如右图 所示。 ①电池放电时负极的电极反应式为 ▲ 。 ②充电时有机阳离子向 ▲ 电极移动(填“铝”或“石墨”)。 ③电池充电时,电路中每转移0.3 mol电子,理论上生成 ▲ g铝。 20.(13分) 氮氧化物(NOx)是一种主要的大气污染物,必须进行处理。 (1)汽车发动机工作时会引发N2和O2反应生成NO,其反应过程中的能量变化如下: 反应 N2(g)→2N(g) O2(g)→2O(g) N(g)+O(g)→NO(g) 反应热 ΔH 1 ΔH 2 ΔH 3 热量值kJ·mol-1 945 498 630 ①ΔH 1 ▲ 0,ΔH 3 ▲ 0。(填“>”或“<”) ②N2(g)+O2(g) === 2NO(g) ΔH= ▲ kJ·mol-1。 (2)利用NH3在一定条件下与NO反应生成无污染的气体。其热化学方程式为: 4NH3 (g)+6NO(g) ===5N2(g)+6H2O(g) ΔH=-1807.98 kJ·mol-1,下列能表示该反应中能量变化的是 ▲ (填字母)。 A B C (3)利用甲烷催化还原氮氧化物。已知: CH4 (g)+4NO2(g) === 4NO(g)+CO2(g)+2H2O(g) ΔH= -574 kJ·mol-1 CH4(g)+4NO(g) === 2N2(g)+CO2(g)+2H2O(g) ΔH= -1160 kJ·mol-1 H2O(l) === H2O(g) ΔH=44 kJ·mol-1 CH4 与NO2 反应生成N2(g)和H2O(g)的热化学方程式为 ▲ ,1.6 g CH4还原NO2 生成N2和液态水时放出的热量为 ▲ kJ。 电源 尾气 H2 NO Na2SO4 溶液 阳离子 交换膜 (4)利用电解法处理含氮氧化物的废气。实验室模拟电解法吸收NO,装置如右图所示(均为石墨电极),电解过程中NO转化为硝酸的化学方程式为 ▲ 。 21.(15分)亮菌甲素(物质F)用于治疗急性胆道感染。其早期的合成工艺如下: (1)亮菌甲素中含氧官能团除了羟基外,还有 ▲ 、 ▲ 。 (2)C的结构简式为 ▲ ,设计步骤②和④的目的为 ▲ 。 (3) E生成F的反应类型为 ▲ 。 (4)写出满足下列条件的F的一种同分异构体的结构简式 ▲ 。 ①1 mol F 与足量银氨溶液反应,生成8 mol Ag; ②能发生水解反应,其水解产物之一能与FeCl3溶液发生显色反应; ③分子中只有4种不同化学环境的氢。 (5)请结合题给信息以和CH3CH2OH为原料制备,写出相应的合成路线流程图(无机试剂任选,合成路线流程图示例见本题题干)。 ▲ 2017-2018学年度第一学期高二期末调研测试化学 参考答案 1-10单选每题2分, 11-15多选每题4分,漏选2分 1 2 3 4 5 6 7 8 C D C D D B B A 9 10 11 12 13 14 15 B A AC AD C D AC 16.(每空2分,共12分) (1)NaOH水溶液,加热 (2) (3) BC (4) (任写一种) (5) (6) 17.(每空2分,共14分) (1)冷凝回流,提高原料利用率。 (2)浓硫酸具有强氧化性,能氧化有机反应物(答“可能发生副反应”亦给分)。CH3OCH3 (3)除去混合液中的丙烯酸、甲醇、硫酸 (4)除去有机层中的水 (5)47.5% (6)在通风橱中实验、防止明火(或其他合理答案) 18.(共12分) (1) (2分) (2)氧化反应、缩聚反应(各1分,共2分) (3) (2分) (4) (2分) (5) (2分) (6)CD(2分) 19. (每空2分,共14分) (1)①阴极 ②石墨电极被阳极上产生的O2氧化 (2)①2Al-6e-+3H2O=Al2O3+6H+ ②增大 (3)①Al-3e-+7AlCl4-=4Al2Cl7- ②铝 ③2.7 20. (共13分) (1)① > < (各1分) ②183(2分) (2) B(2分) (3) CH4 (g)+2NO2(g)=N2 (g)+CO2(g)+2H2O(g) ΔH=-867 kJ·mol-1 (3分) 95.5(2分) (4) 2NO+4H2O2HNO3+3H2 (2分) 21.(共15分) (1)羰基(1分) 酯基(1分) (2) (2分) 保护酚羟基(2分) (3)取代反应(2分) (4) 或(2分) (5) (每步1分,共5分)查看更多