河南省信阳高级中学2018-2019学年高二10月月考化学试题
信阳高中2020届高二10月月考
化学试题
可能用到的相对原子质量: H 1 C 12 N 14 O 16 Na 23 Mg 24 Al 27 S 32 Cl 35.5 K 39 Ca 40 Mn 55 Fe 56 Cu 64 Zn 65 Ag 108 Pb 207 Ba 137
一、单选题(每题3分,共60分)
1.下列离子方程式书写正确的是
A.Fe3O4 溶于足量氢碘酸:Fe3O4 + 8H+ = Fe2+ + 2Fe3+ + 4H2O
B.过氧化钠投入水中发生: 2Na2O2 +2H2O = 4OH- + 4Na+ + O2↑
C.向100ml 0.5mol/L NaOH溶液中通入足量 CO2 (标准状况):
CO2 +2OH‾ = CO+ 2H2O
D.向含1mol FeBr2的溶液中通入少量Cl2:2Br‾+ Cl2 = Br2 + 2Cl‾
选项
①
②
③
实验结论
A
稀硫酸
Na2SO3
Na2SiO3溶液。
非金属性:S>Si
B
浓硫酸
蔗糖
溴水
浓硫酸具有脱水性、氧化性
C
稀盐酸
Na2SO3
Ba(NO3)2溶液
SO2与可溶性钡盐均可生成白色沉淀
D
浓硝酸
Na2CO3
Na2SiO3溶液
酸性:硝酸>碳酸>硅酸
2.利用下图所示装置进行下列实验,能得出相应实验结论的是:
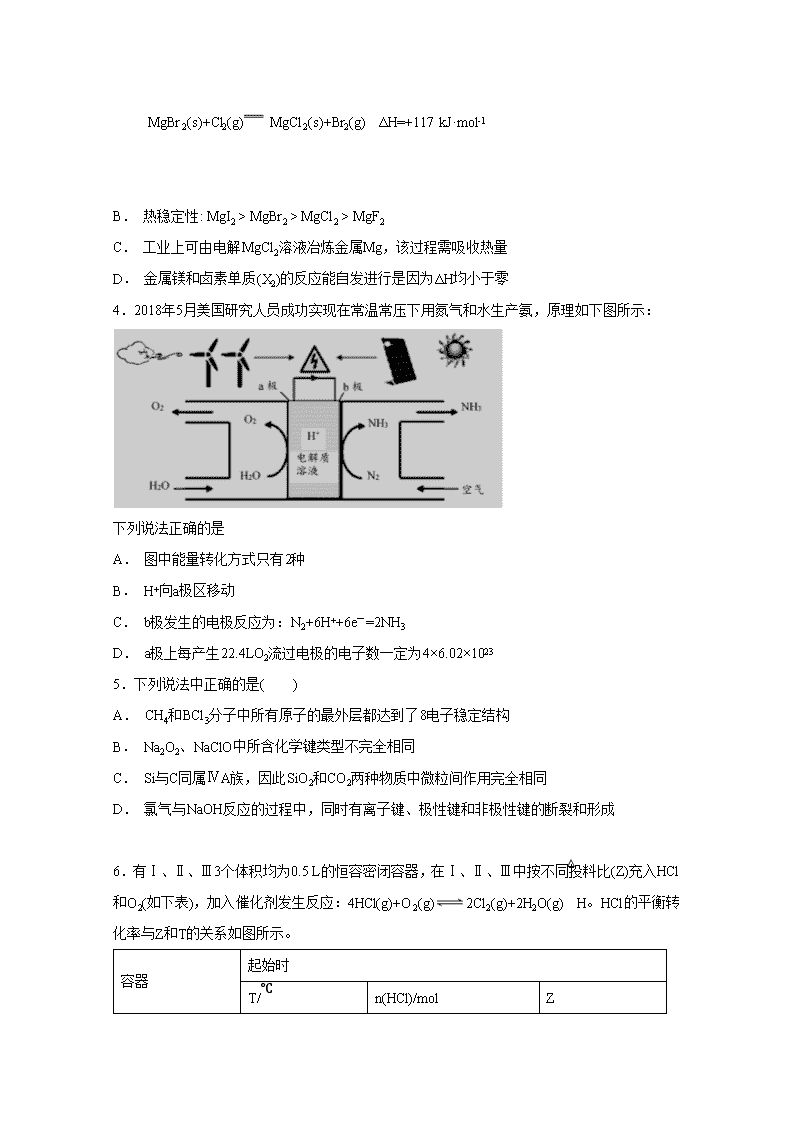
3.下图是金属镁和卤素单质(X2)反应的能量变化示意图。下列说法正确的是( )
A. 由图可知此温度下MgBr2(s)与Cl2(g)反应的热化学方程式为:
MgBr2(s)+Cl2(g) MgCl2(s)+Br2(g) ΔH=+117 kJ·mol-1
B. 热稳定性: MgI2 > MgBr2 > MgCl2 > MgF2
C. 工业上可由电解MgCl2溶液冶炼金属Mg,该过程需吸收热量
D. 金属镁和卤素单质(X2)的反应能自发进行是因为ΔH均小于零
4.2018年5月美国研究人员成功实现在常温常压下用氮气和水生产氨,原理如下图所示:
下列说法正确的是
A. 图中能量转化方式只有2种
B. H+向a极区移动
C. b极发生的电极反应为:N2+6H++6e-=2NH3
D. a极上每产生22.4LO2流过电极的电子数一定为4×6.02×1023
5.下列说法中正确的是( )
A. CH4和BCl3分子中所有原子的最外层都达到了8电子稳定结构
B. Na2O2、NaClO中所含化学键类型不完全相同
C. Si与C同属ⅣA族,因此SiO2和CO2两种物质中微粒间作用完全相同
D. 氯气与NaOH反应的过程中,同时有离子键、极性键和非极性键的断裂和形成
6.有Ⅰ、Ⅱ、Ⅲ3个体积均为0.5 L的恒容密闭容器,在Ⅰ、Ⅱ、Ⅲ中按不同投料比(Z)充入HCl和O2(如下表),加入催化剂发生反应:4HCl(g)+O2(g)2Cl2(g)+2H2O(g) △H。HCl的平衡转化率与Z和T的关系如图所示。
容器
起始时
T/℃
n(HCl)/mol
Z
Ⅰ
300
0.25
a
Ⅱ
300
0.25
b
Ⅲ
300
0.25
4
下列说法不正确的是( )
A. △H<0
B. a<4
v(逆)
D. 300 ℃时,该反应平衡常数的值为320
7.下列说法正确的是( )
A. 用盐酸标准溶液测定NaOH溶液浓度滴定实验中,滴定前无气泡而滴定后有气泡,会使测定值偏高
B. 将地下钢管与直流电源的正极相连,用来保护钢管
C. 已知在101KPa下,1gH2燃烧生成水蒸气放出121kJ热量,其热化学方程式为:2H2(g)+O2(g)=2H2O(g) △H=-484 kJ·mol-1
D. 25℃,101kPa时,强酸与强碱的稀溶液发生中和反应的中和热为57.3kJ·mol-1,表示稀H2SO4与KOH 溶液反应的中和热的热化学方程式为:H2SO4(aq)+2KOH(aq)=K2SO4(aq)+2H2O(l)△H=-114.6kJ·mol-1
8.已知胆矾溶于水时溶液温度降低。胆矾分解的热化学方程式为CuSO4·5H2O(s)==CuSO4(s)+5H2O(l) ΔH=+Q1 kJ·mol-1,室温下,若将1 mol无水硫酸铜溶解为溶液时放热Q2 kJ,则( )
A. Q1=Q2 B. Q1>Q2 C. Q1c(Bˉ-)
B. 水的电离程度:b=c>a
C. 溶液中离子总物质的量:b>c>a
D. 溶液中离子总浓度:a>b>c
20.25℃时, c mol·L—1CH3COOH 溶液加水稀释, 溶液中 CH3COOH 和 CH3COOˉ二者中各自所占的物质的量分数(α)随溶液 pH 变化的关系如图所示。下列说法不正确的是
A. 由图可知, 25℃时醋酸的 Ka=10-4.76
B.c mol·L—1CH3COOH 溶液加水稀释中, α(CH3COOˉ)增大, c(CH3COOˉ)也一定增大
C. 在 pH=4.76 的溶液中通入 HCl, α(CH3COOH)增大,α(CH3COOˉ)减小, α(CH3COOH)+α(CH3COOˉ)=1
D. 对于图像中曲线上任意一点所对应的溶液中,都有 c(CH3COOˉ)+c(OHˉ)=c(H+)
二、填空题(共40分)
21.硫单质及其化合物在化工生成等领域应用广泛。
(1)工业尾气中的SO2一直是环境污染的主要原因之一,工业上常采用如下方法降低尾气中的含硫量:
①方法1:燃煤中加入生石灰,将SO2转化为CaSO3,再氧化为CaSO4
已知:a. CaO(s)+CO2(g) =CaCO3(s) ΔH=-178.3kJ·mol-1
b.2CaCO3(s)+2SO2(g)+O2(g)=2CaSO4(s)+2CO2(g) ΔH=-2762.2kJ·mol-1
c.2CaSO3(s)+O2(g)=2CaSO4(s) ΔH=-2314.8kJ·mol-1
写出CaO(s)与SO2(g)反应生成CaSO3(s)的热化学方程式:_________________________________。
②方法2:用氢氧化钠溶液将SO2转化为NaHSO3,再氧化为 Na2SO4。
实验测得NaHSO3溶液中= 1500,则溶液的pH为______________(已知:H2SO3的Ka1=1.5×10-2,Ka2=1.0×10-7)。
(2)煤制得的化工原料气中含有羰基硫(0=C=S),该物质可转化为H2S,反应为COS(g) +H2(g)H2S (g)+CO(g) ΔH>0。
①恒温恒容条件下,密闭容器中发生上述反应,下列事实不能说明反应达到平衡状态的是__________
(填字母)。
a.COS的浓度保持不变 b.化学平衡常数不再改变
c.混合气体的密度不再改变 d.形成2molH-S键的同时形成1mol H-H键
②T1℃时,在恒容的密闭容器中,将一定量的CO和H2S混合加热并达到下列平衡:H2S(g)+ CO(g) COS(g)+H2(g),K=0.25,则该温度下反应COS(g)+H2(g)H2S(g)+ CO(g)的平衡常数K=__________。
T1℃时,向容积为10 L的恒容密闭容器中充入1mol COS(g)和1molH2(g),达到平衡时COS的转化率为______________________。
(3) 过二硫酸(H2S2O8)是一种强氧化性酸,其结构式为
。
①在Ag+催化作用下,S2O82-能与Mn2+在水溶液中发生反应生成SO42-和MnO4-,1mol S2O82-能氧化的Mn2+的物质的量为_________mol。
②工业上可用惰性电极电解硫酸和硫酸铵混合溶液制备过二硫酸铵。则阳极的电极反应式为______________________。
22.I.根据下表所示化学反应与数据关系,回答下列问题:
化学反应
平衡常数
温度
973 K
1173 K
①Fe(s)+CO2(g)⇌FeO(s)+CO(g)
K1
1.50
2.15
②Fe(s)+H2O(g)⇌FeO(s)+H2(g)
K2
2.40
1.67
③CO(g)+H2O(g)⇌CO2(g)+H2(g)
K3
?
?
(1)反应①是________(填“吸热”或“放热”)反应。
(2)在973K时,K3=_________。
(3)要使反应③在一定条件下建立的平衡向逆反应方向移动,可采取的措施有______(填写字母序号)。
A.缩小反应容器的容积 B.扩大反应容器的容积 C.升高温度
D.使用合适的催化剂 E.设法减小平衡体系中的CO浓度
Ⅱ.无机和有机氰化物在工农业生产中应用广泛,尤其是冶金工业常用的氰化物,含氰废水的处理显得尤为重要。含氰废水中的氰化物常以[Fe(CN)6]3-和CN-的形式存在,
工业上有多种废水处理方法。
(1)电解处理法:
用如图所示装置处理含CN-废水时,控制溶液pH为9~10并加入NaCl,一定条件下电解,阳极产生的ClO-将CN-氧化为无害物质而除去。铁电极为__________(填“阴极” 或“阳极”),阳极产生ClO-的电极反应为__________________________,阳极产生的ClO-将CN-氧化为无害物质而除去的离子方程式为__________________________。
(2)UV(紫外光线的简称)—H2O2氧化法。
实验过程:取一定量含氰废水,调节pH,加入一定物质的量的H2O2,置于UV工艺装置中,
光照一定时间后取样分析。
【查阅资料】
①在强碱性溶液中4[Fe(CN)6]3-+4OH-===4[Fe(CN)6]4-+O2↑+2H2O,[Fe(CN)6]4-更稳定;
②[Fe(CN)6]3-转化为CN-容易被H2O2除去;
③HCN是有毒的弱酸,易挥发。
【问题设计】
①请写出HCN的电子式________________。
②含氰废水在不同pH下的除氰效果如图所示,pH选择的最佳范围应为________________(选填编号:a.7~10;b.10~11;c.11~13),解释该pH不宜太大的原因___________________。
23
.滴定法是化学常用来定量测定物质浓度的一种重要的实验方法。在食品工业、药品制造、化妆品行业等等都被广泛应用。
中华人民共和国国家标准(GB2760-2011)规定葡萄酒中SO2最大使用量为0.25 g·L-1。某兴趣小组用如图装置(夹持装置略)收集某葡萄酒中SO2,并对其含量进行测定。
(1)仪器A的名称是________,水通入A的进口为________。B中加入300.00 mL葡萄酒和适量盐酸,加热B使SO2全部逸出并与C中H2O2完全反应。
(2)除去C中过量的H2O2,然后用0.090 0 mol·L-1NaOH标准溶液进行滴定,若滴定终点时溶液的pH=8.8,则选择的指示剂为________。滴定终点现象为_______________。
(3)滴定至终点时,消耗NaOH溶液25.00 mL,该葡萄酒中SO2含量为:________g·L-1。
(4)该测定结果往往比实际值偏高,最可能的原因是_________________,在不改变装置的情况下,如何改进:______________________________________________。
高二化学参考答案
1.B 2.B 3.D 4.C 5.B 6.D 7.C 8.B 9.B 10.B 11.C 12.B
13.D 14.B 15.A 16.D 17.B 18.B 19.B 20.B
21. CaO(s)+SO2(g)==CaSO3(s) ΔH=-402.0kJ·mol-1 6 bc 4 66.7% 0.4 2SO42--2e-=S2O82-
22. 吸热 1.60 CE 阴极 Cl-+2OH--2e-=ClO-+H2O 2CN-+5ClO-+2OH-=N2↑+5Cl-+2CO32-+H2O b pH太大溶液中发生[4Fe(CN)6]3-+4OH-=4[Fe(CN)6]4-+O2↑+2H2O,生成更稳定[Fe(CN)6]4-难以除去
23.冷凝管 b 酚酞 当滴入最后一滴烧碱溶液时,溶液变红且半分钟不褪色 0.24 盐酸的挥发 用不挥发的强酸如硫酸代替盐酸,或用蒸馏水代替葡萄酒进行对比实验,扣除盐酸挥发的影响