陕西省榆林市绥德县绥德中学2019-2020学年高二下学期阶段性测试化学试题 Word版缺答案
绥德中学2019-2020学年高二下学期第二次阶段性测试
化学试卷
第Ⅰ卷(选择题,共54分)
一、选择题(本大题共18个小题,每小题3分,共54分。在每小题给出的四个选项中有一项是符合题目要求的。)
1. 新型冠状病毒是一种致病性很强的RNA病毒,下列说法错误的是 ( )
A.新型冠状病毒组成元素中含有C、H、O
B.用“84消毒液”进行消毒时,消毒液越浓越好
C.3M防颗粒物口罩均使用3M专有高效过滤材料——聚丙烯材质,聚丙烯属于高分子
D.不去人群聚集处、勤洗手可预防新型冠状病毒
2. 下列关于古籍中的记载说法正确的是 ( )
A.直径为20nm的纳米碳酸钙属于胶体
B.氢化钙的电子式是:Ca2+[∶H]2—
C.“千锤万凿出深山,烈火焚烧若等闲。”这句古诗包含了吸热反应过程
D.《本草经集注》中关于鉴别硝石(KNO3)和朴硝(Na2SO4)的记载:“以火烧之,紫青烟起,乃真硝石也”,该方法应用了显色反应
3. 阿伏加德罗常数的值为NA,下列说法正确的是 ( )
A.标准状况下,2.24LCH3OH分子中共价键的数目为0.5NA
B.1mol Na2O2与足量CO2充分反应,转移的电子数为2 NA
C.25℃1LpH=12的Na2CO3溶液中,由水电离出H+的数目为0.01NA
D.0.1 mol H2和0.1 molI2于密闭容器中充分反应后,HI分子总数为0.2NA
4. 常温下,下列各组离子一定能在指定溶液中大量共存的是 ( )
A.在pH=7的溶液中:Fe3+、K+、Cl-、SO
B.滴加KSCN溶液显红色的溶液中:NH、K+、Cl-、I-
C.c(OH-)/c(H+)=10-12的溶液中:NH、Cu2+、NO、SO
D.水电离产生的c(OH-)=10-12 mol·L-1的溶液中:Na+、Al3+、Cl-、NO
5. 下列反应的离子方程式书写正确的是 ( )
A.向氯化铝溶液中加入过量氨水:Al3++4NH3·H2O ==AlO +4NH
B.以石墨作电极电解氯化铝溶液:2Cl-+2H2O2OH-+H2↑+Cl2↑
C.硫酸亚铁溶液与稀硫酸、双氧水混合:2Fe2++H2O2+2H+===2Fe3++2H2O
D.硫酸氢钠溶液与足量氢氧化钡溶液混合:
2H++SO+Ba2++2OH-===BaSO4↓+2H2O
1. 下列关于冰融化为水的过程判断正确的是 ( )
A.ΔH>0,ΔS<0 B.ΔH<0,ΔS>0
C.ΔH>0,ΔS>0 D.ΔH<0,ΔS<0
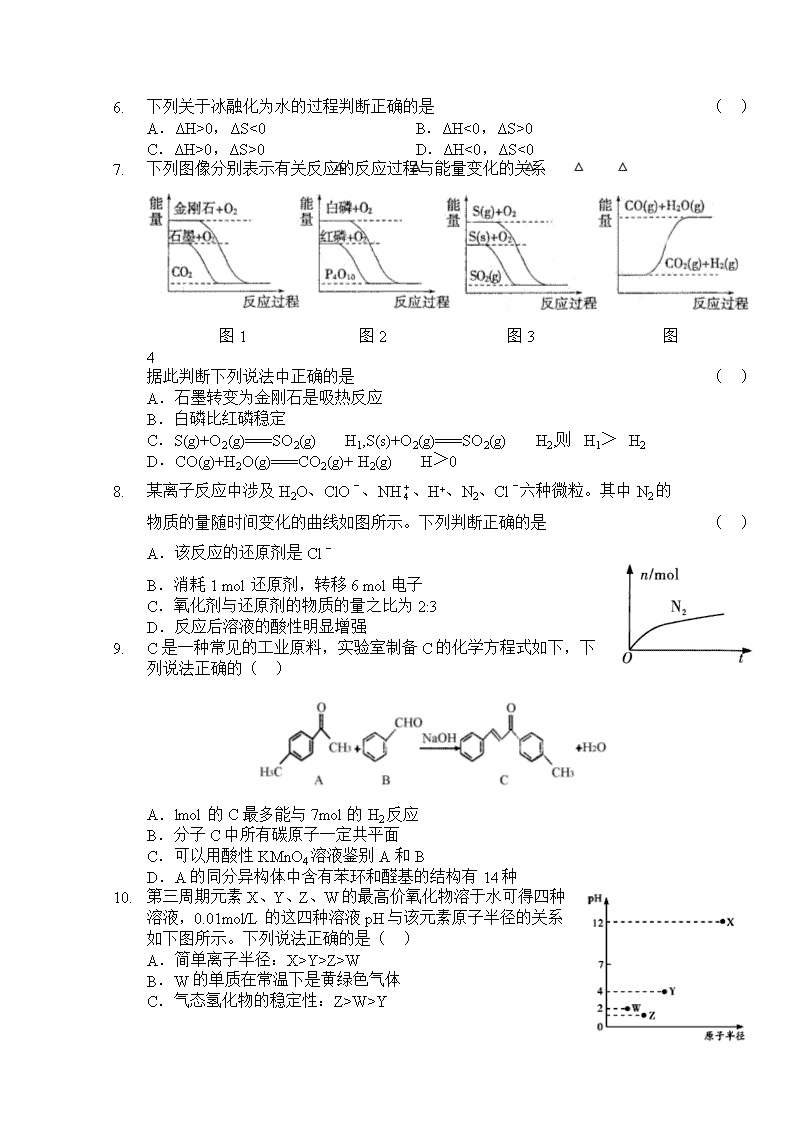
2. 下列图像分别表示有关反应的反应过程与能量变化的关系
图1 图2 图3 图4
据此判断下列说法中正确的是 ( )
A.石墨转变为金刚石是吸热反应
B.白磷比红磷稳定
C.S(g)+O2(g)===SO2(g) △H1,S(s)+O2(g)===SO2(g) △H2,则△H1>△H2
D.CO(g)+H2O(g)===CO2(g)+ H2(g) △H>0
3. 某离子反应中涉及H2O、ClO、NH、H+、N2、Cl六种微粒。其中N2的物质的量随时间变化的曲线如图所示。下列判断正确的是 ( )
A.该反应的还原剂是Cl
B.消耗1 mol还原剂,转移6 mol电子
C.氧化剂与还原剂的物质的量之比为2:3
D.反应后溶液的酸性明显增强
4. C是一种常见的工业原料,实验室制备C的化学方程式如下,下列说法正确的( )
A.lmol的C最多能与7mol的H2反应
B.分子C中所有碳原子一定共平面
C.可以用酸性KMnO4溶液鉴别A和B
D.A的同分异构体中含有苯环和醛基的结构有14种
5. 第三周期元素X、Y、Z、W的最高价氧化物溶于水可得四种溶液,0.01mol/L的这四种溶液pH与该元素原子半径的关系如下图所示。下列说法正确的是(
)
A.简单离子半径:X>Y>Z>W
B.W的单质在常温下是黄绿色气体
C.气态氢化物的稳定性:Z>W>Y
D.X和Y的最高价氧化物对应的水化物恰好中和时,溶液中的微粒共有2种
1. 某小组为研究电化学原理,设计如图装置。下列叙述正确的是( )
A.a和b用导线连接时,铁电极上发生还原反应
B.a和b用导线连接时,电子经硫酸铜溶液从铁电极流向铜电极
C.无论a和b是否连接,铜电极质量都增加
D.无论a和b是否连接,铁片均会溶解,溶液均从蓝色逐渐变成浅绿色
2. 在密闭容器中,一定条件下进行反应mA(g)+nB(g)pC(g)+qD(g),若增大压强或升高温度,重新达到平衡,速率随时间变化过程如图所示,则对该反应叙述正确的是( )
A.正反应是放热反应,m+n
p+q
C.正反应是放热反应,m+n>p+q
D.逆反应是放热反应,m+nC
B.A、C两点气体的颜色:A深,C浅
C.由状态B到状态A,可以用加热的方法
D.A、C两点气体的平均相对分子质量:A>C
5. 某温度下在密闭容器中发生如下可逆反应:2M(g)+N(g)2E(g),若开始时只充入2molE(g),达平衡时,E的转化率为40%;若开始时只充入2molM和1molN的混合气体,达平衡时混合气体的压强比起始时减少了 ( )
A.20% B.40% C.60% D.80%
6. 下列溶液中有关物质的量浓度的关系正确的是 ( )
A.在NaHCO3溶液中,[H+]+[H2CO3]=[OH-]
B.含有、的溶液中,离子浓度大小关系可能为:
C.物质的量浓度相等的溶液和溶液等体积混合:
D.的
溶液中:
1. 下列实验中,依据实验操作及现象得出的结论正确的是 ( )
2. 空间实验室“天宫一号”的供电系统中有再生氢氧燃料电池(RFC),RFC是一种将水电解技术与氢氧燃料电池技术相结合的可充电电池。下图为RFC工作原理示意图,有关说法正确的是 ( )
A.转移0.1 mol电子时,a电极产生1.12 L H2
B.b电极上发生还原反应
C.酸性电解质溶液中H+移向c电极
D.d电极上发生的电极反应是:O2+4H++4e-=2H2O
第II卷(非选择题,共46分)
二、非选择题(共46分)
3. (7分)在室温下,下列五种溶液:
①0.1mol/L NH4Cl ②0.1mol/L CH3COONH4 ③ 0.1mol/L NH4HSO4
④0.1mol/L NH3•H2O和0.1mol/L NH4Cl混合液 ⑤0.1mol/L NH3•H2O
请根据要求填写下列空白:
(1)溶液①呈 性(填“酸”、“碱”或“中”),其原因是
(用离子方程式表示)
(2)在上述五种溶液中,pH最小的是 ;c(NH4+)最小的是 ﹝填序号﹞
(3)在溶液④中, 离子的浓度为0.1mol/L;NH3•H2O和 离子的物质的量浓度之和为0.2 mol/L
(4)室温下,测得溶液②的pH=7,则CH3COO-与NH4+浓度的大小关系是:
c(CH3COO-) c(NH4+)(填“>”、“<”或“=”)
1. (15分)以煤为原料可合成一系列燃料。
(1)已知:①2H2(g)+O2(g)=2H2O(g) ΔH=-483.6kJ/mol
②CH3OH(g)+H2O(g)=CO2(g)+3H2(g) ΔH=+49.0kJ/mol
请写出甲醇燃烧生成H2O(g)的热化学方程式_________;
(2)向1L密闭容器中加入2mol CO、4mol H2,在适当的催化剂作用下,发生反应:2CO(g)+4H2(g)CH3OCH3(l)+H2O(l) ΔH=+71kJ/mol
①该反应能否_________自发进行(填“能”、“不能”或“无法判断”)
②下列叙述能说明此反应达到平衡状态的是_________.
a.混合气体的平均相对分子质量保持不变
b.CO和H2的转化率相等
c.CO和H2的体积分数保持不变
d.混合气体的密度保持不变
e.1mol CO生成的同时有1mol O-H键断裂
(3)CO2(g)+3H2(g)CH3OH(g)+H2O(g) ΔH<0在一定条件下,某反应过程中部分数据如下表:
反应条件
反应时间
CO2(mol)
H2(mol)
CH3OH(mol)
H2O(mol)
恒温恒容
(T1℃、2L)
0min
2
6
0
0
10min
4.5
20min
1
30min
1
①0~10min内,用H2O(g)表示的化学反应速率v(H2O)=_________mol/(L·min)
②达到平衡时,该反应的平衡常数K=_________(用分数表示),平衡时H2的转化率是_________。
③在其他条件不变的情况下,若30min时向容器中再充入1mol CO2(g)和1mol H2O(g),则平衡_________移动(填“正向”、“逆向”或“不”).
(4)用甲醚(CH3OCH3)作为燃料电池的原料,请写出在碱性介质中电池负极反应式_________.
2. (12分)二硫化钨(WS2,WS2中W的化合价为+4)可用作润滑剂及石油化工领域中的催化剂。由钨铁矿(其主要成分是FeWO4,还含少量Al2O3)制备二硫化钨的工艺流程如下:
请回答下列问题:
(1)“滤渣Ⅰ”的化学式为__________。
(2)提高“熔融”速率的措施有_____________________(写一条即可)。
(3)用离子方程式表示通入过量CO2的主要目的是:________________________。
(4)钨酸与氨水反应时控制温度为58℃,温度不宜太高,其原因是___________。
(5)已知2(NH4)2WS4+3O22WS2+4NH3+2S+2SO2+2H2O,若该反应转移了8mol电子,则生成的气体产物在标准状况下的体积为_________L。
(6)常温下,Ksp(CaWO4) =1×10-10。在钨酸钠溶液中滴加澄清石灰水产生钨酸钙沉淀,当溶液中pCa=-1g c(Ca2+)=4,c(WO)=__________。
1. (12分)草酸(H2C2O4,二元弱酸)与草酸盐在实验和工业生产中都起着重要的作用。
(1)硫酸酸化的KMnO4能与Na2C2O4溶液反应生成Mn2+和CO2,该反应的离子方程式为_________________________________________________。
(2)分别使10mL pH=3的H2C2O4溶液和100mL pH=4的H2C2O4溶液全部转化为Na2C2O4,所需等浓度的NaOH溶液的体积为V1和V2,则V1_____V2(填“>”“<”或“=”)
(3)常温下,用0.1000mol/L NaOH溶液滴定20.00mL某未知浓度的H2C2O4溶液,滴定曲线如图,c点所示溶液中:
①该草酸溶液的物质的量浓度为______________。
②a点所示溶液中各离子的浓度由大到小的顺序为________________________。
(4)已知:某温度时,Ksp(FeC2O4)=2.0×10-7,Ksp(CaC2O4)=2.5×10-9。
①此温度下,CaC2O4饱和溶液的物质的量浓度为________。
②此温度下,向Na2C2O4溶液中加入FeCl2与CaCl2,当两种沉淀共存时,溶液中c(Fe2+):c(Ca2+)=________。